英夫利昔与肠内营养联用治疗克罗恩病的Meta分析
杨 欢,王 双,姜 政
1.重庆医科大学附属第一医院消化内科,重庆 400016;2.重庆市长寿区人民医院
克罗恩病(Crohn’s disease,CD)是一种可于肠道任何部分发生病变的、病因机制仍不明确的慢性非特异性的炎症性疾病[1],是炎症性肠病的一种亚型,该病全球发病率不论在成人、还是儿童群体都较以往明显上升,且迄今尚无彻底治愈方法[2]。其病因不明,目前认为主要通过遗传易感性、肠道微生物和导致免疫系统失调的环境因素之间的相互作用介导[3-4]。CD主要以腹痛、腹泻等消化道症状起为主,可影响消化道的任何部分,也可能伴有肠外表现如影响关节、皮肤、眼睛、肝胆系统、胰腺等,及出现消瘦、贫血等全身性症状[5],且其反复发作,部分患者可伴随终身,严重影响生活质量,近年来国内外日益升高的发病率使其治疗备受重视。人鼠嵌合体IgG1单克隆抗体英夫利西单克隆抗体(Infliximab, IFX)是抗肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)单克隆抗体的一种,商品名为类克(Remicade),2007年我国国家食品药品监督管理局(State Food and Drug Administration, SFDA)已正式批准将其应用于CD的治疗,通过拮抗CD免疫炎性发病通路中起关键作用的前炎性因子TNF-α而起治疗作用,已在世界各地应用十多年[6],已被多项研究[7-8]证实对CD的诱导缓解和维持治疗有显著效果,美国胃肠病协会(AGA)也建议对于中度CD患者应采用抗TNF-α药物治疗以诱导病情缓解(推荐强度强,证据等级中等)[9]。同时,CD患者营养不良也是一大主要表现,不同程度存在着体质量下降、负氮平衡、贫血、低蛋白血症[10],而肠内营养(enteral nutrition, EN)通过胃肠道补给可满足机体和肠黏膜的营养,改善骨骼健康,减轻肠道组织局部的炎症反应,有利于肠黏膜屏障的修复,降低术后复发,对于诱导和维持CD缓解有极大的作用,甚至可以代替药物或手术成为一种重要的治疗手段,在儿童和青少年活动期的CD诱导缓解首推EN[11],对于成人CD可在激素治疗失败或不耐受时用于诱导缓解,且部分EN能够有效地延长CD缓解期[12]。近年来IFX和EN联用治疗CD的研究已越来越引起国内外研究者的重视,但其临床应用的安全性和疗效在国内仍缺乏相关的循证医学证据,本研究通过Meta分析对目前研究结果的疗效、安全性等指标进行综合评价,为临床治疗提供证据。
1 资料与方法
1.1文献检索计算机检索数据库PubMed、Embase、Medline、Ovid、Cochrane Library、中国知网(CNKI)、万方数据库(WanFang)、维普数据库(VIP)。检索时限均为建库至2017年9月。中文检索词:“英夫利昔单抗”、“类克”、“抗肿瘤坏死因子抗体”、“肠内营养”、“克罗恩病”、“节段性肠炎”、“局限性肠炎”、“肉芽肿性肠炎”。英文检索词:“Infliximab”、“anti-tumor necrosis factor”、“IFX”、“enteral nutrition”、“elemental diet”,“Crohn’s disease”、“Crohn disease”。中文/英文随机对照试验和队列研究。
1.2纳入与排除标准
1.2.1 纳入标准:(1)研究类型:研究IFX与EN联用治疗CD的原始研究,包括随机对照试验、队列研究;(2)纳入对象:所有患者均明确提出符合中-重度CD的诊断标准[13]。患者性别、人种及国籍等不限;(3)干预措施:试验组为IFX+EN治疗CD;对照组为IFX治疗CD;(4)对疗效评判在研究设计中有明确的标准。
1.2.2 排除标准:研究中出现下列情况之一时,均予以排除:(1)综述、Letter to editor述评、病例报道等;(2)重复发表的文献。
1.3资料提取对于纳入研究的资料提取研究题目、年份、患者人群特点、样本量、随访时间、干预措施、疗效评价标准、疗效指标、结果,缺乏的资料邮箱或电话联系原文作者,由两人分别独立完成,当意见不一致时进行讨论或征求第三方意见。
1.4文献评价由两名评价员共同按照Cochrane系统评价员手册(5.1.0版)中随机对照试验(randomized controlled trial,RCT)的偏倚风险评价标准对所纳入的随机对照试验进行方法学质量评价,对于队列研究使用针对非随机对照试验的质量评价方法 Newcastle Ottawa scale(NOS)评分量表进行评价。
1.5统计学分析数据结果在RevMan 5.3中完成。异质性分析:Q检验:当I2≤50%,P≥0.1时,提示纳入的研究异质性小,使用固定效应模型合并分析;当I2>50%,P<0.1时,则认为各研究异质性大,应分析异质性来源进行亚组分析,并解释研究结果。分类资料采用优势比(OR)及其95%CI作为分析统计量,P<0.05为差异有统计学意义。
2 结果
2.1文献检索通过检索上述数据库,共检索到文献693篇,利用Endnote去重,根据纳入、排除标准,最终纳入8篇文章(1篇中文,7篇英文)。文献筛选过程如图1所示。

图1 文献筛选流程图Fig 1 Process of literate screening and results
2.2文献基本特征与质量评价在纳入的文献中,共纳入研究对象总例数668例,试验组(IFX+EN)306例,对照组(IFX)362例,CD患者的类型均为诊断明确的中-重度CD(见表1)。其中RCT1篇,前瞻性队列研究2篇,回顾性队列研究5篇。文献质量评价:高质量7篇,中等质量1篇(见表1)。

表1 纳入文献基本特征及文献质量Tab 1 Characteristics and quality grade of included trials
2.3Meta分析结果
2.3.1 有效率:有8项研究[14-21]报道了其有效率,各研究之间行异质性检验时异质性小(P=0.26,I2=22%),Meta分析使用固定效应模型,结果表明,IFX联合EN的临床有效率较IFX治疗CD的有效率明显提高,差异有统计学意义(OR=2.38, 95%CI: 1.65~3.42,Z=4.66,P<0.00001)(见图2)。

图2 临床有效率Meta分析结果Fig 2 Results of clinical efficacy rate
2.3.2 不良反应发生率:有2项研究[14,21],报道了其不良反应发生率,各研究之间行异质性检验(P=0.10,I2=63%),考虑异质性来源于患者不良反应严重程度、随访时间,Meta分析使用随机效应模型,结果表明,IFX联合EN的不良反应发生率与IFX治疗CD相比,差异无统计学意义(OR=0.73, 95%CI: 0.12~4.45,Z=0.34,P=0.73)(见图3)。

图3 不良反应率Meta分析结果Fig 3 Results of adverse reaction rate
2.3.3 复发率:有4项研究[14-15,17,19]报道了其复发率,各研究之间行异质性检验时异质性小(P=0.64,I2=0),Meta分析使用固定效应模型,结果表明,IFX联合EN在CD维持缓解治疗期间的疾病复发率较IFX相比明显降低,差异具有统计学意义(OR=0.31, 95%CI: 0.18~0.53,Z=4.25,P<0.0001)(见图4)。
2.4偏倚风险比较因纳入发表文献<10篇,未作发表偏倚分析。
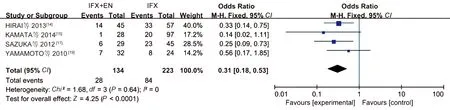
图4 复发率的Meta分析结果Fig 4 Results of recurrence rate
3 讨论
CD目前被认为是可累及消化道任何部位及肠外器官的一种慢性、持续性、不可治愈的炎症性疾病[1],其主要表现为发作与缓解相交替的天然性免疫或获得性免疫,包括肠黏膜屏障损伤、溃疡经久不愈、炎性增生等病理改变,住院率及手术率都较高,严重影响患者的生活质量,也造成了巨大的经济负担,其发病特点表现为多样性、难治疗性、近年来日益升高的发病率,治疗方案越来越引起当今研究学者的重视。
IFX作为一种拮抗TNF-α炎性因子的药物,目前已广泛用于CD的诱导和缓解治疗,研究[22]表明,IFX适用于对中-重度CD患者、对糖皮质激素治疗无效或激素依赖者、和(或)免疫抑制剂(如硫唑嘌呤等)治疗无效者或不能耐受上述药物治疗(存在禁忌证或严重不良反应)者进行诱导,对于缓解期的治疗,相比不包含抗TNF-α药物的治疗方案,更推荐采用抗TNF-α药物治疗以维持其疾病的缓解状态[9],但同时,IFX在治疗的同时也会增加机会性感染、肝功能异常、血液系统受累、恶性肿瘤等风险[22]。而对于激素不耐受;患者拒绝使用激素、药物治疗无效或禁忌(激素无效、不耐受、骨质疏松)等成人活动期CD,也可考虑使用EN进行诱导缓解。朱维铭等[23]比较了在中-重度CD的诱导缓解中,IFX与EN在中度严重度的患者中,EN能达到与IFX相同疗效,在生活质量、营养状况的改善均更有意义,且经济花费更低,而在重度CD患者中IFX的疗效更好,两者经济成本接近。YAMAMOTO等[24]也发现在临床缓解期CD患者EN对临床、内镜疾病活动和黏膜炎症细胞因子白细胞介素(IL)-1β、IL-6和TNF-α水平具有明显的抑制作用。近年来,上述IFX与EN联用治疗中-重度CD的治疗也逐渐开展,但两药联合治疗的有效性和安全性至今于国内未见相关的综合分析研究报道,仅有国外1篇相关的Meta分析[25],但纳入文献少,地域局限,暂无进一步循证医学方法数据为临床提供指导,为进一步得出可靠结论,需要对现有的资料进行合成与综合分析。
此次Meta分析研究更全面地检索了国内外的数据库,纳入研究数量、病例数量增加,8篇文献中7篇文献质量评价均为高质量文献,1篇为中等质量文献,研究之间异质性低,并从临床有效率、复发率、不良反应发生率多方面分析了联合用药的疗效和安全性,结果显示,IFX联合EN治疗CD的临床有效率高于IFX治疗组,复发率低于IFX治疗组,总不良反应发生率差异无统计学意义。目前在日本地区,EN已被广泛用于CD患者的维持期治疗[14],TAKAGI等[26]认为,每天EN至少需要保证900~1 200 kcal能量供应,而纳入研究SAZUKA等[17]的分析显示,每天热卡>600 kcal即可有统计学意义,且EN的配方并不改变IFX在维持期对患者的疗效。对比纳入的研究EN组每天热卡量为600~900 kcal,在维持期大多EN方式选择部分肠内营养(PEN)达到有效缓解,每天EN配方YAMAMOTO等[19]、SAZUKA等[17]、TANAKA等[18]均使用了Elental(Ajinomoto, Tokyo)。在EN方式的选择上,既往研究[27]显示,在热卡量>600 kcal后建议使用管饲,在治疗时间>4周情况下,建议使用经皮内镜胃造瘘(percutaneous endoscopic gastrostomy, PEG),但纳入文献除胡晓东[21]阐述使用鼻饲外,余具体实施方式未作阐述无法得出EN方式在此研究中的分析。
既往关于在CD中对比单用EN与单用IFX的系统评价中[28]示两者之间的疗效、安全性差异均无统计学意义,在此次研究中,IFX与EN联用相较于单用IFX更能促进患者对IFX的反应性和有效性,达到更有效的炎症缓解。对于IFX的反应性,CD仅累及小肠的患者强于其他同时累及小肠、大肠或仅累及大肠的患者,但YAMAMOTO等[19]的研究显示,不管是单独在小肠组还是在小肠与结肠组,联合用药组与IFX单药的缓解率差异均无统计学意义。在用药安全性上,联合用药组和IFX用药组均可引起不同程度的不良反应,如输液反应、感染、咽喉炎、腹泻、肝功能异常、梅尼埃病等,TANAKA等[18]研究中,5例患者分别由于肠梗阻、不同程度出血等原因在治疗期间进行了手术治疗,但由于该研究未将这部分人员进行细化分组,故文中Meta分析的不良反应异质性既与患者疾病严重程度、随访时间有关,也与无法完全纳入研究结果有关。
此次纳入研究中疗效评判标准基本均是以CDAI、CRP、临床表现等指数为指标,而未涉及到内镜下的黏膜愈合率,与纳入研究试验少、质量不高,及其他回顾性研究由于不能完整追踪内镜愈合率有关。本次Meta分析仍有其他不足,此次研究纳入的文献虽相较之前的Meta分析包含了随机对照试验,但纳入文献试验仅在中国,地域局限,另外纳入的文献研究均为队列研究,且部分研究并没有提及患者的依从性问题。从而更需要在今后的工作中需要更进一步纳入更多、地域分布更广泛、质量更高的随机对照试验,提高样本量,增加文章可靠性进一步行Meta分析。
综上,IFX联合EN较IFX治疗中-重度CD有更好的临床疗效,且安全性无明显差异,可为临床上治疗CD提供一定的指导意义,但临床更进一步的推广还需要更大规模、多中心的临床研究来进一步论证其有效率、不良反应发生率、EN与IFX的在诱导期和维持缓解期的剂量和浓度及疗程,EN的方式和成分都需要更进一步的高质量研究进行验证,以期指导临床应用。
[1] BROWN I S, MILLER G C, BETTINGTON M L, et al. Histopathological findings of extra-ileal manifestations at initial diagnosis of Crohn’s disease-related ileitis [J]. Virchows Arch, 2016, 469(5):515-522. DOI: 10.1007/s00428-016-2009-7.
[2] BERNSTEIN C N. Review article: changes in the epidemiology of inflammatory bowel disease-clues for aetiology [J]. Aliment Pharmacol Ther, 2017, 46(10): 911-919. DOI: 10.1111/apt.14338.
[3] LOFTUS E V. Crohn’s Disease: etiology, complications, assessment, therapy, and management [J]. Gastroenterol Clin North Am, 2017, 46(3): xiii-xv. DOI: 10.1016/j.gtc.2017.06.001.
[4] SHOUVAL D S, RUFO P A. The role of environmental factors in the pathogenesis of inflammatory bowel diseases: a review [J]. JAMA Pediatr, 2017, 171(10): 999-1005. DOI: 10.1001/jamapediatrics.2017.2571.
[5] PEYRIN-BIROULET L, BOUHNIK Y, ROBLIN X, et al. French national consensus clinical guidelines for the management of Crohn’s disease [J]. Dig Liver Dis, 2017, 49(4): 368-377. DOI: 10.1016/j.dld.2016.12.008.
[6] BAU M, ZACHARIAS P, RIBEIRO D A, et al. Safety profile of anti-TNF therapy in Crohn’s disease management: a Brazilian single-center direct retrospective comparison between infliximab and adalimumab [J]. Arq Gastroenterol, 2017, 54(4): 328-332. DOI: 10.1590/S0004-2803.201700000-43.
[7] TORRES J, CAPRIOLI F, KATSANOS K H, et al. Predicting outcomes to optimize disease management in inflammatory bowel diseases [J]. J Crohns Colitis, 2016, 10(12): 1385-1394. DOI: 10.1093/ecco-jcc/jjw116.
[8] HARBORD M, ANNESE V, VAVRICKA S R, et al. The first european evidence-based consensus on extra-intestinal manifestations in inflammatory bowel disease [J]. J Crohns Colitis, 2016, 10(3): 239-254. DOI: 10.1093/ecco-jcc/jjv213.
[9] TERDIMAN J P, GRUSS P, HEIDELBAUGH J J, et al. American Gastroenterological Association Institute Guideline on the use of thiopurines, methotrexate, and anti-TNF-α biologic drugs for the induction and maintenance of remission in inflammatory Crohn’s disease [J]. Gastroenterology, 2013, 145(6): 1459-1463. DOI: 10.1053/j.gastro.2013.10.047.
[10] SIGALL-BONEH R, LEVINE A, LOMER M, et al. Research gaps in diet and nutrition in inflammatory bowel disease. A topical review by D-ECCO Working Group (Dietitians of ECCO) [J]. J Crohns Colitis, 2017, 11(12):1407-1419. DOI: 10.1093/ecco-jcc/jjx109.
[11] CRITCH J, DAY A S, OTLEY A, et al. Use of enteral nutrition for the control of intestinal inflammation in pediatric Crohn disease [J]. J Pediatr Gastroenterol Nutr, 2012, 54 (2): 298-305. DOI: 10.1097/MPG.0b013e318235b397.
[12] KUGATHASAN S, DENSON L A, HYAMS J S. Exclusive and partial enteral nutrition for Crohn’s disease - Authors’ reply [J]. Lancet, 2017, 390(10101): 1486-1487. DOI: 10.1016/S0140-6736(17)32157-8.
[13] OOI C J, MAKHARIA G K, HILMI I, et al. Asia Pacific Consensus Statements on Crohn’s disease. Part 1: Definition, diagnosis, and epidemiology: (Asia Pacific Crohn’s Disease Consensus--Part 1) [J]. J Gastroenterol Hepatol, 2016, 31(1): 45-55. DOI: 10.1111/jgh.12956.
[14] HIRAI F, ISHIHARA H, YADA S, et al. Effectiveness of concomitant enteral nutrition therapy and infliximab for maintenance treatment of Crohn’s disease in adults [J]. Dig Dis Sci, 2013, 58(5): 1329-1334. DOI: 10.1007/s10620-012-2374-2.
[15] KAMATA N, OSHITANI N, WATANABE K, et al. Efficacy of concomitant elemental diet therapy in scheduled infliximab therapy in patients with Crohn’s disease to prevent loss of response [J]. Dig Dis Sci, 2015, 60(5): 1382-1388. DOI: 10.1007/s10620-014-3493-8.
[16] MATSUMOTO T, IIDA M, KOHGO Y, et al. Therapeutic efficacy of infliximab on active Crohn’s disease under nutritional therapy [J]. Scand J Gastroenterol, 2005, 40(12):1423-1430. DOI: 10.1080/00365520510023639.
[17] SAZUKA S, KATSUNO T, NAKAGAWA T, et al. Concomitant use of enteral nutrition therapy is associated with sustained response to infliximab in patients with Crohn’s disease [J]. Eur J Clin Nutr, 2012, 66(11): 1219-1223. DOI: 10.1038/ejcn.2012.120.
[18] TANAKA T, TAKAHAMA K, KIMURA T, et al. Effect of concurrent elemental diet on infliximab treatment for Crohn’s disease [J]. J Gastroenterol Hepatol, 2006, 21(7): 1143-1149. DOI: 10.1111/j.1440-1746.2006.04317.x.
[19] YAMAMOTO T, NAKAHIGASHI M, UMEGAE S, et al. Prospective clinical trial: enteral nutrition during maintenance infliximab in Crohn’s disease [J]. J Gastroenterol, 2010, 45(1): 24-29. DOI: 10.1007/s00535-009-0136-5.
[20] YAMAMOTO T, NAKAHIGASHI M, SHIMOYAMA T, et al. The long-term efficacy of concomitant enteral nutritional therapy during maintenance infliximab in patients with Crohn’s disease: A prospective observational trial [J]. J Crohns Colitis, 2015, 9(1): S364. DOI: 10.1093/ecco-jcc/jju027.685.
[21] 胡晓东. 英夫利西单抗与肠内营养治疗Crohn病的疗效观察[J]. 国际医药卫生导报, 2015, 21(16): 2410-2412. DOI: 10.3760/cma.j.issn.1007-1245.2015.16.035.
HU X D. Clinical efficacy of infliximab therapy and enteral nutrition in the treatment of Crohn’s disease [J]. IMHGN, 2015, 21(16): 2410-2412. DOI: 10.3760/cma.j.issn.1007-1245.2015.16.035.
[22] 中华医学会消化病学分会炎症性肠病学组. 抗肿瘤坏死因子α单克隆抗体治疗炎症性肠病专家共识 (2017) [J]. 协和医学杂志, 2017, 8(4-5): 239-243. DOI: 10.3969/j.issn.1674-9081.2017.05.009.
[23] 朱维铭, 左芦根, 李毅, 等. 肠内营养与英夫利西单抗诱导中重度克罗恩病缓解的疗效及成本分析[J]. 中华内科杂志, 2013, 52(9): 721-725. DOI: 10.3760/cma.j.issn.0578-1426.2013.09.003.
ZHU W M, ZUO L G, LI Y, et al. A comparative study of induction of remission and cost-effectiveness of enteral nutrition versus infliximab in moderate-to-severe Crohn’s disease [J]. Chin J Intern Med, 2013, 52(9): 721-725. DOI: 10.3760/cma.j.issn.0578-1426.2013.09.003.
[24] YAMAMOTO T, NAKAHIGASHI M, SANIABADI A R, et al. Impacts of long-term enteral nutrition on clinical and endoscopic disease activities and mucosal cytokines during remission in patients with Crohn’s disease: a prospective study [J]. Inflamm Bowel Dis, 2007, 13(12): 1493-1501. DOI: 10.1002/ibd.20238.
[25] NGUYEN D L, PALMER L B, NGUYEN E T, et al. Specialized enteral nutrition therapy in Crohn’s disease patients on maintenance infliximab therapy: a meta-analysis [J]. Therap Adv Gastroenterol, 2015, 8(4): 168-175. DOI: 10.1177/ 1756283X15578607.
[26] TAKAGI S, UTSUNOMIYA K, KURIYAMA S, et al. Effectiveness of an ‘half elemental diet’ as maintenance therapy for Crohn’s disease: a randomized-controlled trial [J]. Aliment Pharmacol Ther, 2006, 24(9): 1333-1340. DOI: 10.1111/j.1365-2036.2006.03120.x.

[28] TSERTSVADZE A, GURUNG T, COURT R, et al. Clinical effectiveness and cost-effectiveness of elemental nutrition for the maintenance of remission in Crohn’s disease: a systematic review and meta-analysis [J]. Health Technol Assess, 2015, 19(26): 1-138. DOI: 10.3310/hta19260.

