激素对杂交魔芋不定芽分化的影响
蔡阳光 刘次鹏 杨凉花
(陕西省安康市魔芋产业研究院,陕西 安康 725021) (陕西省安康市农业科学研究所,陕西 安康 725021) (陕西省安康市魔芋产业研究院,陕西 安康 725021;陕西省安康市农业科学研究所,陕西 安康 725021)
魔芋(Amorphophalluskonjac)属于天南星科魔芋属多年生草本植物[1]。除了通过有性杂交获得实生种子进行繁育以外,无性繁殖是其最重要的繁育途径。其中组织培养技术又是重中之重,它不仅可以对珍稀品种进行保种,还可在短时间内使得新品种及优良单株等得以快速扩繁[2]。前人针对花魔芋、白魔芋及其他品种魔芋的组培研究很多,利用的外植体包括魔芋的叶、球茎、根状茎、顶芽、叶柄、花药以及实生种子等。如陈永刚等[3]研究发现,花魔芋经过5次继代培养后的愈伤组织出芽数最多,平均达到了3个,芽分化率达到了73.3%;且随着增殖继代次数的增加,愈伤组织芽分化率逐渐提高,平均每块愈伤组织的出芽数也逐渐增多,但这种差异有逐渐缩小的趋势。陈国爱[4]在对花魔芋根状茎组培中发现,诱导不定芽分化的最佳培养基配方为MS+6-BA 2.0mg/L+NAA 0.5mg/L,分化率高达86.7%,增殖系数为2.5。段龙飞等[5]以花魔芋实生种子为外植体,比较不同激素浓度配比对愈伤诱导、芽分化的影响,发现不定芽分化配方为MS+6-BA 2.0mg/L+NAA 0.5mg/L,分化率高达100%,增殖系数为4.6。孙枝柳等[6]用魔芋苞片进行组织培养发现,MS+6-BA 3.0mg/L+NAA 1.0mg/L为魔芋苞片愈伤组织诱导最优组合,愈伤组织诱导率达到72.67%。在对红魔芋进行组培的过程中发现,诱导红魔芋块茎不定芽分化的最适培养基是MS+6-BA 2.0mg/L+NAA 1.0mg/L[7]。潘登浪等[8]以海南本地野生疣柄魔芋球茎顶芽为外植体,采用MS+6-BA 3.0mg/L+NAA 0.1mg/L+蔗糖30g/L+琼脂7g/L培养基,较有利于从顶芽基部直接诱导出丛芽,且增殖系数较高,达4.37。如上所述的研究还有很多,在一定程度上为后来的研究者提供了较好的研究基础,在对品种扩繁以及珍稀品种的保种等工作上前人也取得了较大的成就。但因为地域、品种以及其他主客观因素的影响,笔者在借鉴前人的研究成果对选育的杂交魔芋后代优良单株进行组培扩繁的过程中发现,在愈伤组织分化成芽这一阶段,分化出芽的速度、分化的效果以及分化的芽数均不理想,很大程度上影响了整个扩繁的进度。因此,本研究通过设计正交试验,重新探讨适合杂交魔芋ZH品系的最佳激素组合,以加快这一阶段的分化速度及分化效果,为杂交魔芋后代优良单株及新品种的快速扩繁提供科学依据。
1 材料与方法
1.1 材料
采用陕西省安康市农业科学研究所自选杂交魔芋ZH优良单株球茎分化的愈伤组织,筛选细胞分裂快、结构疏松、颜色浅而透明的愈伤作为试验材料。
1.2 培养基
采用MS基本培养基+蔗糖20g/L+琼脂4.2g/L+植物激素,在121℃、0.1MPa条件下高压灭菌30min,pH5.8,灭菌后将培养基分装于培养瓶中,每瓶装培养基50~60mL。
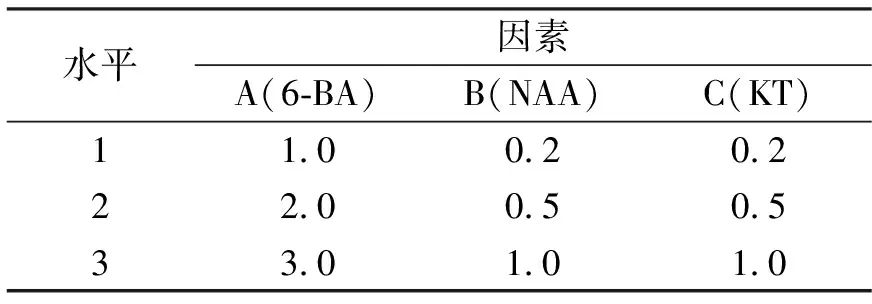
表1 正交试验因素与水平表 mg/L
1.3 正交试验设计
按3因素3水平设计正交试验,如表1所示。
1.4 试验方法
挑选生长良好、一致且质地均匀的同一批愈伤组织,于超净台上将所选愈伤组织平均切成1cm3的小块,然后转接于芽分化诱导培养基上。每个处理接种30瓶,每瓶接种1个,共3个重复。于25℃温室下进行培养,光照强度1500~2000lx,光照时间为每天12h,1个月后统计不定芽分化数量,并计算不定芽分化率。其中不定芽分化率=(分化的愈伤数/接种的愈伤数)×100%,分化的芽数即3个重复中所分化芽数的平均数。
1.5 数据处理
利用Excel 2003与SPSS 13.0软件进行数据整理与统计分析。
2 结果与分析
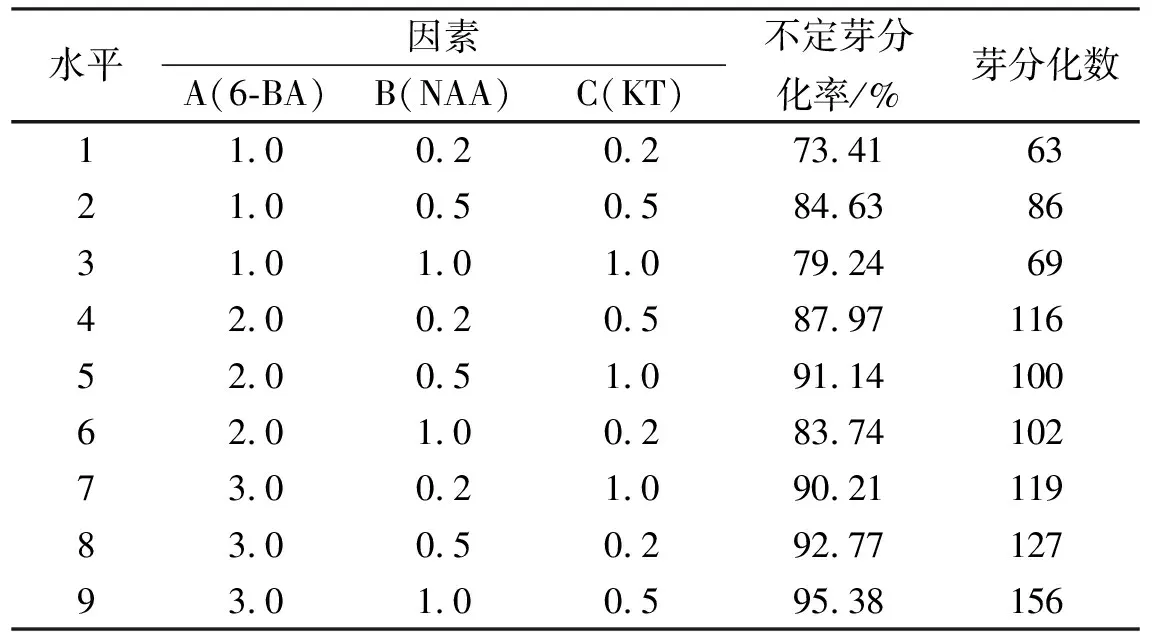
表2 正交试验结果
表2为正交试验各处理的不定芽分化数量及分化率统计结果。
2.1 激素处理对不定芽分化率的影响
由表3可以看出,添加6-BA、NAA及KT均对不定芽分化率产生了显著性影响。由表4可知,按因素列来看,A3、B2、C2分别是各因素中影响最大的水平;由极值R可知,3个因素间存在主次关系,表现为A>C>B;所以,诱导不定芽分化的最优组合为A3B2C2。
2.2 激素处理对芽分化数的影响
由表5可知,添加6-BA、KT对不定芽分化数产生了显著性影响,而NAA对试验结果影响不显著。从表6中的因素列来看,A3、B3、C2分别是各因素中影响最大的水平,且由极值R可知,3个因素间存在主次关系,表现为A>C>B。所以,对诱导芽分化数最优的组合为A3B3C2,但考虑到NAA对试验结果影响不显著,因此从经济角度考虑,诱导芽分化数的最优组合为A3B1C2。
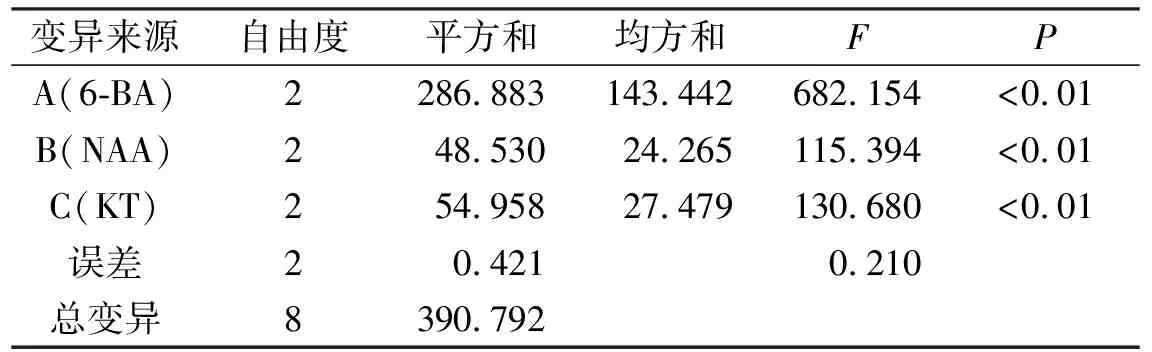
表3 不定芽分化率方差分析
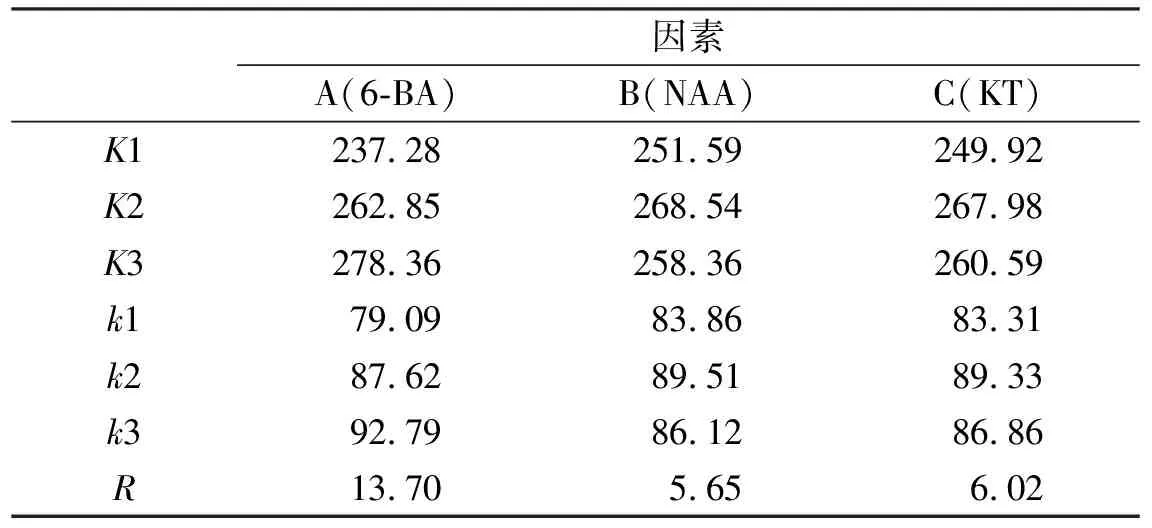
表4 不定芽分化率统计
注:K1、K2、K3表示各因素水平下的和,k1、k2、k3表示各因素水平下的平均数,R为极值。表6同。
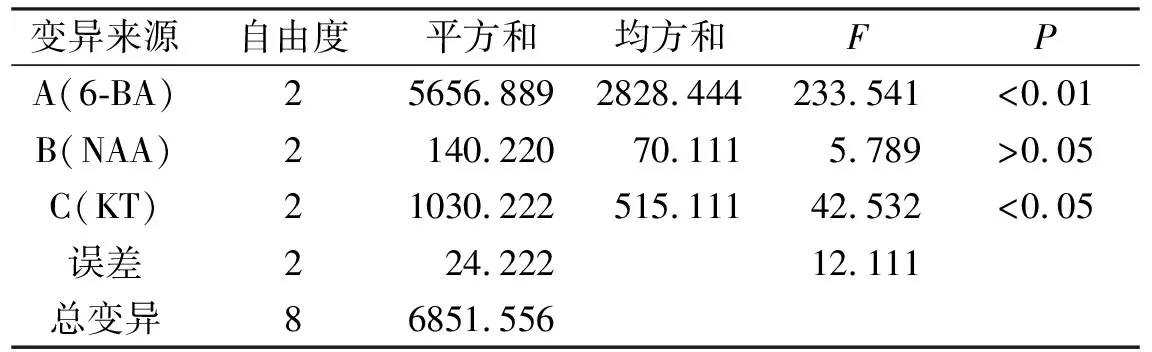
表5 芽分化数方差分析
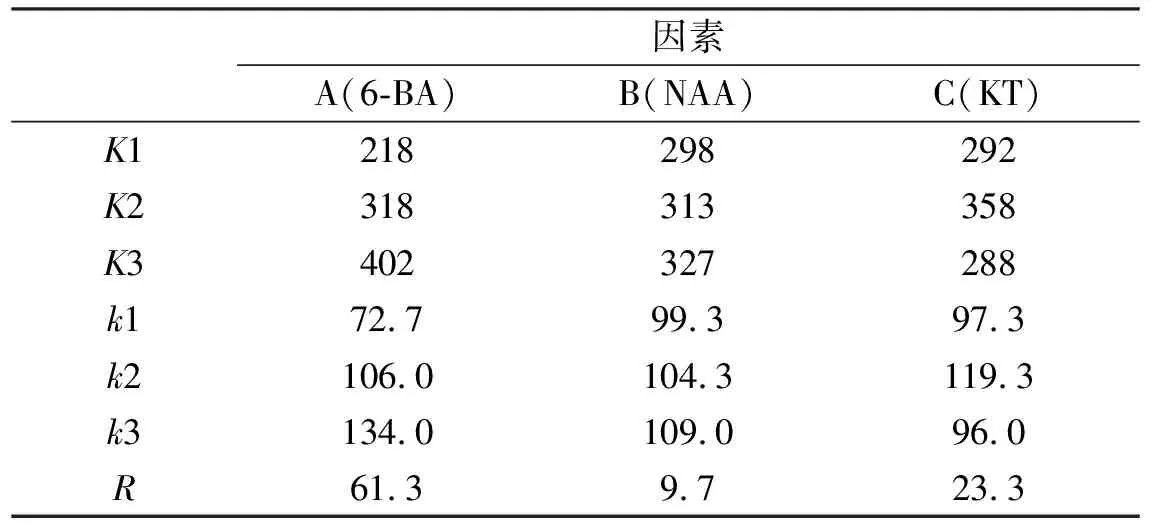
表6 芽分化数统计
3 讨论与结论
利用组织培养的方法对花魔芋及白魔芋等进行扩繁,已进行了很多年,取得了很多的研究成果,也基本上解决了花魔芋及白魔芋等在组织培养过程中出现的一系列问题。但杂交魔芋在芽分化及成苗这一阶段,出现了芽分化慢、分化不一致及分化的芽数少等问题,这在很大程度上制约了杂交魔芋扩繁及后期研究工作的进展。现有的一些研究提供了一定的解决方案,但也存在一定程度上的差异。如胡建斌[9]研究发现,中等浓度(1.0~2.0 mg/L)的细胞分裂素(BA、KT、ZT和TDZ)与低浓度(0.1~1.0mg/L)的NAA配合均能促使Ⅲ型愈伤组织再生植株。
刘贵周等[10]也发现,2.0mg/L BA+1.0mg/L IAA为不定芽分化的最适培养基,在不定芽诱导和生长上,BA与IAA的组合较与NAA的组合好。而以魔芋新品种“楚魔花1号”为研究对象,以块茎为外植体,发现不定芽诱导的最适培养基为MS+0.01mg/L NAA+2.0mg/L 6-BA,诱导率为96.15%[11]。笔者发现,针对花魔芋愈伤诱导及芽分化的研究结果,虽存在一定的差异,但总体表现为诱导愈伤增殖的激素配比为1~3mg/L6-BA(KT)+0.1~1.0mg/LNAA(IAA),这为花魔芋的组织培养扩繁提供了有力的试验数据支撑。再以西盟魔芋芽鞘为外植体,发现不同浓度激素配比适宜芽分化和增殖的培养基为MS+6-BA 1.2 mg/L+NAA 0.2mg/L[12]。黄远新等[13]以不同类型的白魔芋Md和Ms与花魔芋CMH和CCDY这4种材料的块茎为外植体,发现适合不定芽分化及快繁的培养基激素配比,花魔芋为6-BA1.0mg/L+NAA0.5mg/L,白魔芋为6-BA2.0mg/L+NAA0.5mg/L。黄丹枫等[14]研究结果表明,魔芋愈伤组织的不定芽发生对培养基中CTK种类有很强的选择性,适宜的分化培养基为MS+NAA0.5mg/L+6-BA2.0~4.0mg/L。 笔者发现不同地域、不同品种的魔芋对培养基中激素的要求存在较大的差异,最普遍使用的为6-BA1.0~4.0mg/L+NAA0.1~1.0mg/L。鲁红学等[15]研究认为愈伤组织芽分化最适培养基是MS+6-BA1.0mg/L+NAA0.5mg/L+KT2.0mg/L,分化率为73.81%,该研究结果与本研究存在一定的差异,这可能与所使用的品种及地域等因素的差异有关。综上所述,前人对不同魔芋的组织培养均做了大量研究,结果虽存在一定程度的差异,但总体在一个范围内浮动,这为后来者的研究提供了充分的数据基础。本研究在前人的基础上,综合不同激素配比的作用设计正交试验,促进了杂交魔芋愈伤及芽的分化,取得了较好的结果。
[]
[1]刘佩瑛.魔芋学[M].北京:中国农业出版社,2004:8~11.
[2]蔡阳光,张文慧,陈国爱,等.不同激素对杂交魔芋愈伤诱导及植株再生的影响[J].热带农业科学,2017,37(10):1~5,11.
[3]陈永刚,黄重.花魔芋组培快繁过程中不同愈伤继代次数对芽分化能力的影响[J].陕西农业科学,2016,62(12):17~18,32.
[4]陈国爱.花魔芋根状茎组培配方优化研究[J].蔬菜,2016,(11):19~21.
[5]段龙飞,郭邦利,陈国爱,等.花魔芋实生种子组织培养研究初探[J].山西农业大学学报(自然科学版),2016,36(9):639~643.
[6]孙枝柳,李川,崔鸣,等.魔芋苞片组织培养技术研究[J].陕西农业科学,2017,63(5):40~44.
[7]蒋晓云,陈燕萍,常梅仙,等.红魔芋块茎组培培养基筛选试验[J].云南农业科技,2012,(6):22~23.
[8]潘登浪,曾宪海,邹积鑫,等.海南野生疣柄魔芋组培快繁技术[J].热带农业科学,2014,34(10):67~70.
[9]胡建斌.魔芋离体形态发生机制及其繁殖技术[D].武汉:华中农业大学,2006.
[10]刘贵周,谢世清,赵庆云,等.优质魔芋组织培养快繁技术研究[J].云南农业大学学报,2005,(6):47~51.
[11]周涛.“楚魔花1号”组织培养快繁体系的建立[D].成都:四川农业大学,2016.
[12]吴金平,宋志红,刁英,等.西盟魔芋组织培养初步研究[J].河南农业科学,2007,(11):98~99,114.
[13]黄远新,何凤发,张盛林.魔芋组织培养与快繁技术研究[J].西南农业大学学报(自然科学版),2003,(4):309~312.
[14]黄丹枫,陆文初.细胞分裂素与魔芋组织培养器官发生研究[J].西南农业大学报,1993,(6):52~56.
[15]鲁红学,胡桂香,周燚,等.花魔芋组织培养初步研究[J].长江大学学报(自科科学版)农学卷,2005,(5):52~54,111.

