RNA干扰沉默SOX9对肾细胞癌786⁃O细胞体外增殖、凋亡及裸鼠成瘤能力的影响
楚广民 张建波 孙淼淼
肾细胞癌是泌尿系统中仅次于膀胱肿瘤的最常见的恶性肿瘤之一,约占肾脏恶性肿瘤的85%[1]。肾癌对于传统药物和放射治疗不敏感,预后相对较差,所以寻找新的治疗方法显得尤为重要。SOX9(sex determining region Y⁃box 9)属于SRY(sex determination region of Y chromosome)相关基因家族,目前为止共发现20多个SOX基因家族,其共同特点是各个基因都含有一个保守的HMG⁃box DNA 结合域[2]。有研究表明,SOX9基因的表达异常与结直肠癌、肺癌及胰腺癌等多种肿瘤进展相关[3⁃5]。目前干扰SOX9基因表达对肾癌细胞增殖、凋亡及裸鼠成瘤的影响仍有待进一步研究。本研究采用小干扰RNA(small interfer⁃ing RNA,siRNA)技术沉默下调肾细胞癌786⁃O细胞中SOX9基因的表达,检测其对786⁃O细胞增殖、凋亡及裸鼠成瘤的影响,为肾细胞癌的临床治疗提供一定的参考。
1 材料与方法
1.1 材料
肾细胞癌786⁃O细胞株购自ATCC(American Type Culture Collection)。细胞培养基为RPIM⁃1640(美国Hyclone公司),其中添加10%胎牛血清、青霉素100 IU/mL及链霉素100 IU/mL。所用实验动物均为BALB/c雌性裸鼠,4~6周龄,购于北京维通利华实验动物技术有限公司。
1.2 主要仪器和试剂
Multiskan FC酶标仪购自美国Thermo公司,cx41荧光显微镜购自日本Olympus公司。Hoechst 33342细胞凋亡试剂盒购于北京联科生物科技有限公司,CCK⁃8试剂盒购于日本东仁化工公司,免疫组织化学抗体Ki⁃67购自美国Santa cruz公司。
1.3 实验与方法
1.3.1 siRNA细胞转染及qPCR
SOX9siRNA 有效序列为:上游:5′⁃AG⁃CAAGTCCGCGAGCCAGTAC⁃3′,下游:5′⁃GGT⁃GTGCCTTCTGTGCTGCAC⁃3′;对照组序列为:上游:5′⁃UCCACUGTCACUGGUCCGATT⁃3′,下游:5′⁃CGUGACAGUGCCGAGAAT⁃3′。具体转染方法如下:细胞生长融合度为70%~80%时,按操作说明书,分别将INTERFERINGTM转染试剂(Poly⁃plus Transfection公司,法国)和SOX9 siRNA或阴性对照序列(50 nmol/L的终浓度)加入786⁃O细胞培养液中,将细胞继续置于细胞孵化箱中转染。48 h后,收集细胞用于后续功能检测。取转染后的细胞,用Trizol法提取总RNA。按cDNA反转录酶试剂盒(北京达科为生物技术有限公司)说明书进行操作,将2 μg Total RNA反转录为cDNA,以此为模板进行扩增。SOX9序列:上游:5′⁃CAGAAGTACTGGGAAAGTCGT⁃3′,下游:5′⁃CC⁃GGTACTTGTAGTTGGGGTAGT⁃3′。内参GAP⁃DH序列:上游:5′⁃AGCCTCAAGATCATCAG⁃CAAT⁃3′,下游:5′⁃TGTGGTCATGAGTCCTTC⁃CACG⁃3′。反应体系总体积 20 μL,其中模板 cD⁃NA为1.5 μL,上、下游引物分别为1 μL,SYBR混合物 10 μL,无菌蒸馏水 6.5 μL。反应条件:95℃预变性3 min,95℃变性10 s,60℃退火30 s,70℃延伸30 s,共30个循环。以GAPDH作为内参,用2⁃△△Ct法进行数据分析。引物由上海生工生物工程股份有限公司合成。
1.3.2 CCK⁃8法检测细胞活性
将各组786⁃O细胞制成细胞混悬液,以3×104个/孔的密度种于96孔板中,于细胞孵箱中分别孵育0、24、48、72 h。用100 μL的无血清细胞培养基与10 μL的CCK⁃8试剂混匀并加入各孔之中,于37℃细胞培养箱继续孵育1 h。最后将96孔板置于酶标仪下,于450 nm激发光下测定光密度(opti⁃cal density,OD)值。每次实验重复3次,每组3个复孔。
1.3.3 Hoechst 33342细胞荧光染色
转染48 h后,将各组786⁃O细胞制备成1×105个/mL浓度细胞混悬液。取2 mL细胞混悬液加入6孔板(底部置入1张清洁载玻片)中,将6孔板置入细胞培养箱。48 h后将爬满细胞的玻片用PBS清洗3次,然后用4%多聚甲醛固定1 h。再次将玻片用PBS清洗3遍。然后将玻片浸泡在装有Hoechst33342染液的染色缸中10 min。荧光显微镜(×100)下,随机选取5个视野计数。活细胞呈弥散均匀荧光,凋亡细胞核或细胞质内可见浓染致密的颗粒块状荧光,3个或3个以上的DNA荧光碎片被认为是凋亡细胞[6]。
1.3.4 裸鼠成瘤实验
取经过siRNA转染后各组细胞2×106个重悬于100 μL PBS,分别皮下接种于裸鼠右前肢腋下。每隔5天,用游标卡尺测量肿瘤长(L)和宽(W),瘤体体积计算公式为LW2/2(mm3)。初始每组11只裸鼠,第7天时,SOX9沉默组有一只裸鼠因注射部位感染而死亡,对照组有一只裸鼠从始至终未长出肿瘤。第20天时处死裸鼠,仔细分离瘤体并称重。瘤体组织用于后续免疫组化实验。
1.3.5 免疫组织化学染色
新鲜的肿瘤组织从裸鼠体内分离后立即用4%多聚甲醛溶液行标本固定。然后经酒精梯度脱水,二甲苯透明,石蜡包埋,用切片机切成厚约4 μm的组织薄片。经二甲苯及梯度酒精处理予以脱蜡至水化。滴加Ki⁃67抗体孵育过夜,二抗孵育1 h。行二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精染色后中性树脂封片。在普通显微镜下,随机取5个40倍高清视野计数总的细胞数目及Ki⁃67阳性细胞数目,其中细胞核为棕褐色即视为 Ki⁃67 染色阳性。Ki⁃67 阳性细胞比例=Ki⁃67 阳性细胞数目/总细胞数目×100%。
1.3.6 平板克隆形成实验
将转染了siRNA的786⁃O细胞制成单细胞混悬液,以1 000个/孔的密度接种于普通6孔板。将六孔板置于细胞孵箱中,每两天更换一次新鲜培养基。14天之后,将细胞用4%多聚甲醛固定,0.5%结晶紫染色。普通显微镜(×100)下随机取5个视野,并计数大于100个细胞的细胞集落数。实验重复3次,每组3个复孔。
1.4 数据统计学处理
所有数据处理均采用SPSS 13.0软件。计量资料表达形式为均数±标准差(±s),两组间的比较采用student⁃t检验,P<0.05为差异有统计学意义。
2 结果
2.1 沉默SOX9基因的表达影响786⁃O细胞的活性
转染48 h后,相对于对照组而言,沉默组中SOX9mRNA的表达水平显著降低,干扰效率为83.8%(图1A)。同时转染48 h及72 h后,SOX9沉默组的细胞活性相对于对照组显著降低(P<0.05)(图1B)。

图1 干扰沉默SOX9基因对786⁃O细胞活性的影响Figure 1 Effects of SOX9 siRNA on cell viability of 786⁃O cells
2.2 沉默SOX9基因的表达抑制786⁃O细胞的增殖,促进细胞凋亡
平板克隆形成实验结果显示,肾癌786⁃O细胞转染SOX9siRNA后,SOX9沉默组的细胞集落数为(140.0±11.52)个,显著低于对照组的细胞集落数(323.3±14.51)个(P<0.05)(图2A和图2B)。Hoechst 33342细胞荧光染色结果显示,SOX9沉默组细胞凋亡比例为(27.7±3.25)%,显著高于对照组细胞凋亡比例(6.0±0.94)%(P<0.05)(图3A和图3B)。
2.3 沉默SOX9基因的表达抑制786⁃O细胞裸鼠成瘤能力。
将SOX9siRNA转染后的786⁃O细胞及其对照组细胞分别接种到BALB/c裸鼠体内,观察其成瘤能力。在第20天实验结束时,SOX9沉默组平均瘤体体积为(315.44±63.73)mm3,明显小于对照组平均瘤体体积(595.2±50.52)mm3(图 4A)。同时SOX9沉默组平均瘤体重量为(0.43±0.23)g,显著低于对照组的平均瘤体重量(0.89±0.16)g(P<0.05)(图 4B)。Ki⁃67 免疫组织化学染色结果如图5所示,SOX沉默组Ki⁃67阳性的细胞比例为(13.3±2.66)%,显著低于对照组肿瘤组织中Ki⁃67阳性的细胞比例(56.3±3.21)%(P<0.05)。

图2 干扰沉默SOX9基因对786⁃O细胞增殖的影响Figure 2 Effects of SOX9 siRNA on 786⁃O cells proliferation

图3 沉默SOX9基因对786⁃O细胞凋亡的影响Figure 3 Effects of SOX9 siRNA on 786⁃O cells apoptosis
3 讨论
肾细胞癌是泌尿系统常见的恶性肿瘤,手术切除结合分子靶向药物是其主要的治疗方法。但是肾细胞癌的发生发展是一个多因素、多基因参与的过程,部分肾癌患者对现有的分子靶向药物治疗并不敏感。所以寻找新的分子靶点,对于肾癌的治疗具有重要的意义。
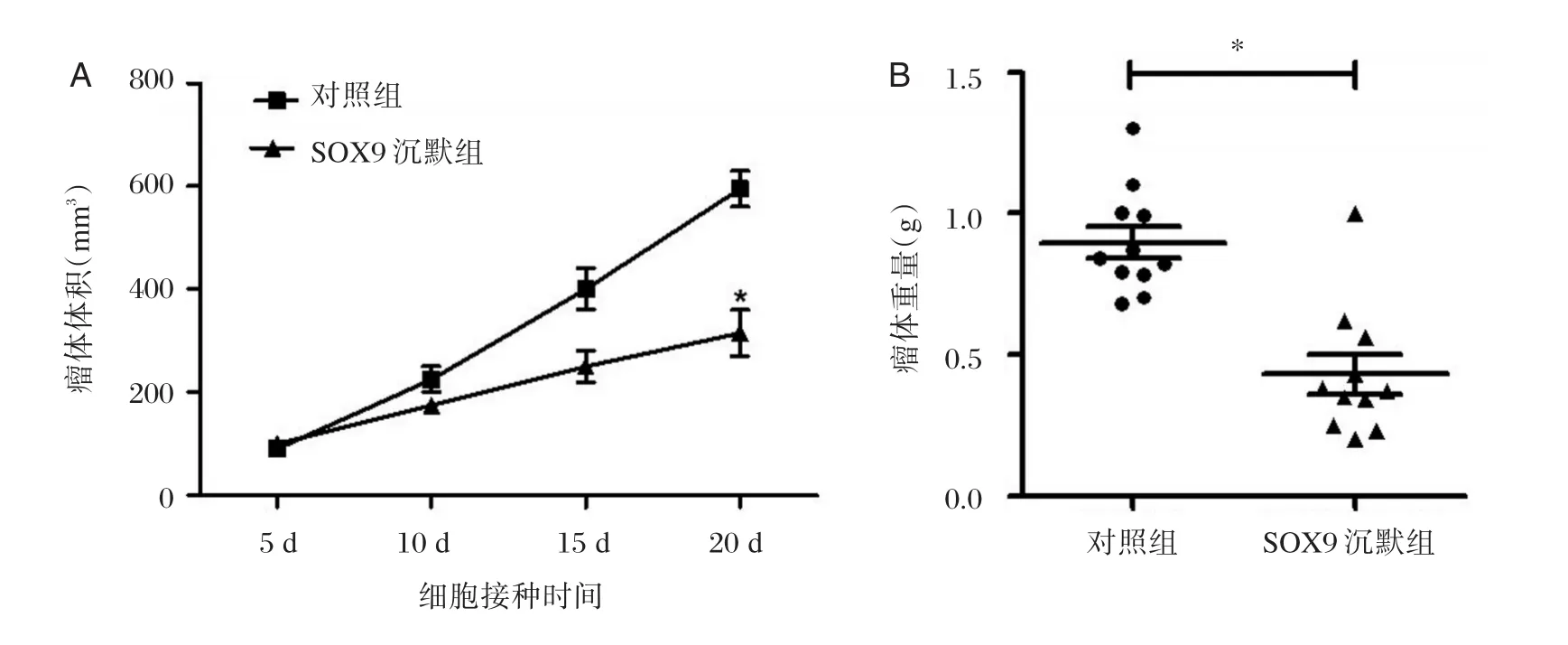
图4 干扰沉默SOX9基因对786⁃O细胞裸鼠成瘤能力的影响Figure 4 Effects of SOX9 siRNA on 786⁃O cells tumorigenesis in nude mice
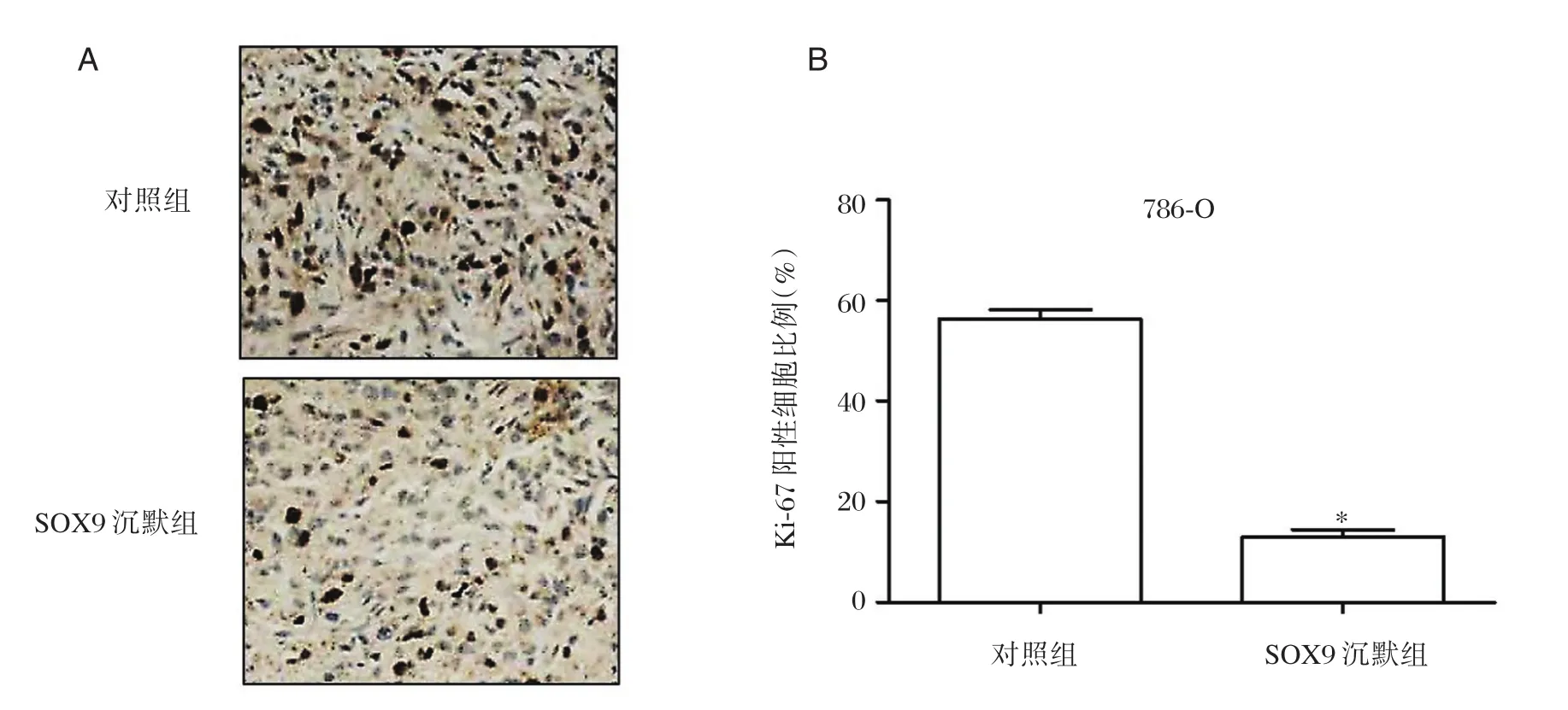
图5 干扰沉默SOX9基因对786⁃O细胞Ki⁃67蛋白表达的影响Figure 5 Effects of SOX9 siRNA on Ki⁃67 protein expression in 786⁃O cells
SOX基因超家族参与人体众多重要的生理过程,如决定性别、调节胚胎神经系统发育、参与软骨形成、晶状体的发育、血细胞生成等等[7⁃8]。近年来相关研究表明,SOX基因家族与人类肿瘤关系密切,如SOX2基因通过调节PTEN的表达,抑制胃癌细胞的增殖和转移[9]。SOX6基因在肝癌组织中表达明显降低,且低表达SOX6基因的患者预后较差[10]。口腔鳞状细胞癌患者的SOX7低表达与其淋巴结转移、肿瘤高分级分期密切相关,抑制SOX7的表达能够降低口腔鳞状上皮癌细胞增殖及侵袭能力[11]。SOX9基因表达异常升高可导致结直肠癌的发生[3],且在肺癌和胰腺癌组织中表达丰富,参与调节其相应肿瘤细胞的转移[4⁃5],此外也与乳腺癌的预后密切相关[12]。SOX9表达增强能够促进脑胶质瘤细胞的转移[13],而沉默SOX9基因的表达能抑制宫颈癌细胞的增殖[14]。此外,在前列腺癌中SOX9发挥抑癌基因的作用,低表达SOX9基因与ERG阳性的前列腺癌复发、转移密切关联[15]。有报道称SOX9在相应的肾细胞癌组织中呈高表达,与其预后密切相关[16]。但涉及SOX9基因的表达对肾细胞癌细胞功能的相关影响仍未见报道。
为探究SOX9对肾细胞癌786⁃O细胞增殖的影响,本研究采用CCK⁃8检测siRNA干扰沉默SOX9基因表达对细胞活性的影响。实验结果表明,沉默SOX9表达后786⁃O细胞活性显著下降。同时,相应的平板克隆形成实验和Hoechst 33342细胞荧光染色结果进一步显示,干扰沉默SOX9能显著抑制786⁃O细胞的增殖,促进其凋亡增加。早期研究表明,在体外敲除SOX9基因能够显著抑制甲状腺癌、直肠癌及胃癌等细胞的增殖[3,17⁃18],促进脊索神经瘤细胞凋亡[19];此外,敲除骨肉瘤细胞系SOX9基因的表达既能导致细胞增殖被抑制,同时也能促进其细胞凋亡[20]。本研究结果与上述文献报道结果基本吻合。
此外,为进一步了解沉默SOX9基因对体内肾癌细胞增殖的影响,本研究将细胞接种于裸鼠体内观察肿瘤体积及重量的变化。结果表明,SOX9沉默组肿瘤体积与肿瘤重量均低于对照组。Ki⁃67是一种与细胞周期相关的蛋白质,其功能与有丝分裂密切相关,在细胞增殖中不可缺少,该蛋白高表达反应细胞增殖能力强,是一个常用的细胞增殖抗原[21]。数据显示,沉默SOX9基因后,增殖抗原Ki⁃67的表达显著被抑制。提示沉默SOX9基因同样能够抑制体内肾细胞癌786⁃O细胞的增殖,与其体外实验结果一致。
综合上述研究结果,干扰沉默SOX9的表达能够显著抑制肾细胞癌786⁃O细胞的增殖,并促进该细胞凋亡。同时证明在体外及动物体内靶向抑制SOX9基因表达能够有效地杀伤肾细胞癌相关细胞系,进一步为肾细胞癌的临床治疗提供参考。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics[J].CA Cancer J Clin,2017,67(1):7⁃30.
[2]Zhao L,Koopman P.SRY protein function in sex de⁃termination:thinking outside the box[J].Chromo⁃some Res,2012,20(1):153⁃162.
[3]Qian Y,Xia S,Feng Z.Sox9 mediated transcriptional activation of FOXK2 is critical for colorectal cancer cells proliferation[J].Biochem Biophys Res Com⁃mun,2017,483(1):475⁃481.
[4]Capaccione KM,Hong X,Morgan KM,et al.Sox9 mediates Notch1⁃induced mesenchymal features in lung adenocarcinoma[J].Oncotarget,2014,5(11):3636⁃3650.
[5]Camaj P,Jäckel C,Krebs S,et al.Hypoxia⁃indepen⁃dent gene expression mediated by SOX9 promotes ag⁃gressive pancreatic tumor biology [J].Mol Cancer Res,2014,12(3):421⁃432.
[6]Crowley LC,Marfell BJ,Waterhouse NJ.Analyzing cell death by nuclear staining with Hoechst 33342[J].Cold Spring Harb Protoc,2016,2016(9):pdb.prot087205.
[7]Fu L,Shi YB.The Sox transcriptional factors:Func⁃tions during intestinal development in vertebrates[J].Semin Cell Dev Biol,2017,63:58⁃67.
[8]Yin C.Molecular mechanisms of Sox transcription fac⁃tors during the development of liver,bile duct,and pancreas[J].Semin Cell Dev Biol,2017,63:68⁃78.
[9]Wang S,Tie J,Wang R,et al.SOX2,a predictor of survival in gastric cancer,inhibits cell proliferation and metastasis by regulating PTEN[J].Cancer Lett,2015,358(2):210⁃219.
[10]Guo X,Yang M,Gu H,et al.Decreased expression of SOX6 confers a poor prognosis in hepatocellular Carcinoma[J].Cancer Epidemiol,2013,37(5):732⁃736.
[11]Oh KY,Hong KO,Huh YS,et al.Decreased expres⁃sion of SOX7 induces cell proliferation and invasion and correlates with poor prognosis in oral squamous cell carcinoma[J].J Oral Pathol Med,2017,46(9):752⁃758.
[12]Riemenschnitter C,Teleki I,Tischler V,et al.Stabili⁃ty and prognostic value of Slug,Sox9 and Sox10 ex⁃pression in breast cancers treated with neoadjuvant che⁃motherapy[J].Springerplus,2013,2:695.
[13]Liu H,Liu Z,Jiang B,et al.SOX9 overexpression promotes glioma metastasis via Wnt/β⁃Catenin Signal⁃ing[J].Cell Biochem Biophys,2015,73(1):205⁃212.
[14]Wang HY,Lian P,Zheng PS.SOX9,a potential tu⁃morsuppressorin cervicalcancer,transactivates p21WAF1/CIP1 and suppresses cervical tumor growth[J].Oncotarget,2015,6(24):20711⁃20722.
[15]Burdelski C,Bujupi E,Tsourlakis MC,et al.Loss of SOX9 expression is associated with PSA recurrence in ERG⁃positive and PTEN deleted prostate cancers[J].PLoS One,2015,10(6):e0128525.
[16]Wan YP,Xi M,He HC,et al.Expression and clini⁃cal significance of SOX9 in renal cell carcinoma,blad⁃der cancer and penile cancer[J].Oncol Res Treat,2017,40(1⁃2):15⁃20.
[17]Huang J,Guo L.Knockdown of SOX9 inhibits the proliferation,invasion,and EMT in thyroid cancer cells[J].Oncol Res,2017,25(2):167⁃176.
[18]Santos JC,Carrasco⁃Garcia E,Garcia⁃Puga M,et al.SOX9 elevation acts with canonical WNT signaling to drive gastric cancer progression [J].Cancer Res,2016,76(22):6735⁃6746.
[19]Chen H,Garbutt CC,Spentzos D,et al.Expression and therapeutic potential of SOX9 in chordoma[J].Clin Cancer Res,2017,23(17):5176⁃51866.
[20]Qi J,Yang Y,Hao P,et al.Transcription factor SOX9 promotes osteosarcoma cell growth by repress⁃ing claudin⁃8 expression[J].Tohoku J Exp Med,2017,241(1):55⁃63.
[21]Kim SH,Park WS,Park EY,et al.The prognostic value of BAP1,PBRM1,pS6,PTEN,TGase2,PD⁃L1,CA9,PSMA,and Ki⁃67 tissue markers in local⁃ized renal cell carcinoma:A retrospective study of tis⁃sue microarraysusing immunohistochemistry [J].PLoS One,2017,12(6):e0179610.

