G6PD活性、UGT1A1、SLCO1B1、ABCC2基因多态性和新生儿高胆红素血症的关系研究
肖奇志 郭洪创 李恋湘 王昭晴 李磊 邝文英 周玉球
葡萄糖⁃6⁃磷酸脱氢酶(glucose⁃6⁃phosphate de⁃hydrogenase,G6PD)缺乏症是一种常见的遗传性疾病,该病是一种公认的导致新生儿高胆红素血症发生的风险因素[1],约30%永久性神经系统损伤的黄疸新生儿为 G6PD 缺乏[2⁃3]。UGT1A1基因编码的尿苷二磷酸葡萄糖醛酸基转移酶1A1(UDP⁃glucuronosyl transferase 1A1,UGT1A1),肝细胞溶质载体有机阴离子转运蛋白家族成员1B 1(solute carrier organic anion transporter family member 1 B1,SLCO1B1)基因编码的有机阴离子转运多肽C(organic anion transporter polypeptide C,OATP⁃C)和ATP结合盒子亚家族C成员2(ATP⁃binding cas⁃sette subfamily C member 2 gene,ABCC2)基因编码的多药耐受相关蛋白 2(multidrug⁃resistance pro⁃tein 2,MRP2)是胆红素排泄通路上的重要蛋白。未结合胆红素主要是由红细胞破碎产生,然后由肝细胞膜上的有机阴离子转运多肽C将未结合胆红素从血液系统转运至肝细胞内,在肝细胞内的滑面内质网上,尿苷二磷酸葡萄糖醛酸基转移酶1A1催化未结合胆红素与葡萄糖醛酸结合形成水溶性、不能透过半透膜的结合胆红素,结合胆红素通过多药耐受相关蛋白2转运到胆管,再经胆汁排至肠道内[4]。未结合胆红素为脂溶性,可穿过新生儿不完整的血脑屏障和细胞膜,引起细胞和脑组织损伤,导致急性和慢性胆红素脑病,即核黄疸,严重者病死率高,存活者多留有后遗症,高达42.2%[5]。G6PD缺乏症的患者频繁发生溶血,导致胆红素的生成过多,尿苷二磷酸葡萄糖醛酸基转移酶1A1、有机阴离子转运多肽C和多药耐受相关蛋白2负责胆红素的转运和排泄。因此,G6PD酶活性缺乏,尿苷二磷酸葡萄糖醛酸基转移酶1A1、有机阴离子转运多肽C和多药耐受相关蛋白2功能的缺陷都会影响胆红素的产生和排泄,与新生儿胆红素水平升高密切相关。
已有报道表明,UGT1A1基因启动子区A(TA)6TAA⁃A(TA)7TAA(rs8175347)变异位点通过影响UGT1A1基因启动子区TATA盒,影响UGT1A1基因的表达,进而增加新生儿核黄疸的发生率[6]。同样,UGT1A1基因1号外显子的211G>A错义突变(UGT1A1*6,rs4148323)在一个大规模的全基因组关联研究分析中发现与血清胆红素浓度密切相关[7]。因此,影响UGT1A1,SLCO1B1和ABCC2基因功能的单核苷酸多态性(single nucleo⁃tide polymorphism,SNPs)位点均可能影响对应蛋白的功能进而影响新生儿外周血胆红素的转运与排泄。除了上述2个变异位点以外,UGT1A1基因⁃3279T>G(rs4124874),SLCO1B1的⁃11187G>A(rs4149015) ,388A>G (rs2306283) ,521T>C(rs4149056)和ABCC2基因的⁃24C>T(rs717620),1249G>A(rs2273697)也被报道影响对应蛋白的功能[8⁃12],可能成为新生儿高胆红素血症的风险因素。
为此,本研究通过分析胆红素浓度峰值与候选基因功能性SNPs之间的相关性,探讨上述8个SNPs位点是否会影响中国人新生儿高胆红素水平以及是否与G6PD缺乏症对外周血胆红素水平具有积累和协同作用,是否会增加G6PD缺乏症新生儿高胆红素血症的发病风险,本研究结果将为新生儿高胆红素血症的防控奠定理论基础。
1 对象与方法
1.1 研究对象
珠海市妇幼保健院出生后15天以内的足月新生儿,共收集457例,其中男性329例,女性128例。所有病例中高胆红素血症病例(高胆红素组)共计285例,胆红素正常病例(胆红素正常组)共计172例,高胆红素组体重范围为2 600~3 900 g,平均体重为3 254 g,男女比例为2.5:1;胆红素正常组体重范围为2 550~3 850 g,平均体重为3 140 g,男女比例为2.2:1;高胆红素组中G6PD活性缺乏共计203例,G6PD活性正常共计82例;胆红素正常组中G6PD活性缺乏共计76例,G6PD活性正常共计96例。两组病例中均排除其它因素影响血清总胆红素的个体,如早产儿、窒息、败血症、乙肝大三阳、胆管阻塞、ABO和Rh血型不合导致的溶血、携带其它血红蛋白病(如地中海贫血)、严重脱水、严重血管外溶血(如头颅血肿、皮下血肿、肺等部位大出血)、极低体重出生儿等,所有病例的脐带血标本被收集。
1.2 方法
1.2.1 G6PD缺乏症病例的诊断
①G6PD/6PGD比值法,G6PD/6PGD<1.5为G6PD活性缺乏,G6PD/6PGD>1.5为G6PD活性正常;②荧光斑点法,根据荧光斑点强弱判断为G6PD活性重度缺乏,中度缺乏和G6PD活性正常;③采用厦门致善生物科技有限公司的探针熔解曲线G6PD基因突变检测试剂盒检测到G6PD基因突变[13]。
1.2.2 病理性黄疸的诊断
测量新生儿从出生后第1天到第7天的皮测胆红素值(JM⁃103,KONICA MINOLTA,日本)和血清总胆红素值(钒酸盐氧化法,上海科华生物股份有限公司),以最高的那一次数值为峰值。血清总胆红素峰值大于221 μmol/L为病理性黄疸,血清总胆红素峰值小于221 μmol/L为胆红素数值正常个体[14]。
1.2.3 基因组DNA提取
抽取新生儿脐带血1 mL,采用DNA提取试剂盒(厦门致善生物科技有限公司)提取基因组DNA,-20℃保存。
1.2.4 SNPs分型
待分析的SNPs位点有8个,分别为UGT1A1基因 A(TA)6TAA⁃A(TA)7TAA(rs8175347)、⁃3279T>G(rs4124874)和211G>A(rs4148323);SL⁃CO1B1基因的⁃11187G>A(rs4149015)、388A>G(rs2306283)和 521T>C(rs4149056);ABCC2基因的⁃24C>T(rs717620)和 1249G>A(rs2273697)。本次设计引物采用软件Oligo 6.31(Molecular Biol⁃ogy Insights,Inc.CO,美国)和 Primer premier 5.0设计上下游引物,PCR扩增以后通过DNA测序获得该位点的SNPs分型结果。
1.3 统计学方法
G6PD缺乏组与G6PD正常组之间的计量资料均数比较采用两样本的t检验分析,样本性别和基因型的构成比较采用χ2检验,各个SNPs位点与血清胆红素分析的不同遗传模型方式采用R软件的SNPassoc软件包进行分析[15],新生儿携带不同风险因素发生高胆红素血症的优势比(ORs)和95%的置信区间用卡方检验分析。样本间的显著性采用双侧检验,显著性检验水准为P<0.05。所有统计图表和数据均用R 3.4.1软件制作和分析。
2 结果
2.1 G6PD缺乏组和G6PD正常组基本资料对比
G6PD缺乏组和G6PD正常组基本资料对比结果见表1。其中G6PD缺乏组外周血清胆红素浓度峰值为(276.55±94.92)μmol/L,显著高于G6PD正常组外周血清胆红素浓度峰值(220.12±89.39)μmol/L(P<0.001)。除了UGT1A1基因启动子区A(TA)6TAA⁃A(TA)7TAA 以外,G6PD 缺乏组与G6PD正常组在男女比例,UGT1A1、SLCO1B1和ABCC2基因其余7个SNPs基因型之间的分布上差异无统计学意义。
2.2 8个SNPs对新生儿血清胆红素水平的影响
分别应用显性遗传模型、隐性遗传模型和加性遗传模型分析上述8个SNPs对新生儿血清胆红素峰值浓度的影响。结果发现UGT1A1211G>A在3种遗传模式下均显著影响新生儿外周血胆红素水平(P<0.05),SLCO1B1⁃11187G>A在显性遗传模型下显著影响新生儿外周血胆红素水平(P=0.039)。其余6个SNPs位点在3种遗传模型下均对新生儿血清胆红素水平没有显著性影响,见表2。
2.3 新生儿高胆红素血症风险因素的积累效应
在上面研究中发现G6PD活性、UGT1A1211G>A和SLCO1B1⁃11187G>A在显性遗传模型下均可以显著影响新生儿高胆红素峰值水平。由此根据携带3个风险因素的差异把样本分为8组,根据新生儿高胆红素血症峰值的阈值221 μmol/L把所有新生儿分为高胆红素血症组和非高胆红素血症组。其中不携带3个风险因素的第1组(G6PD正常,211GG,⁃11187GG)发生新生儿高胆红素血症的风险值定义为1,分别应用卡方检验比较其它各组与第1组的相对风险,得出其它各组的相对风险值以及95%的置信区间。从表3中可以看到随着风险因素携带数量的增多,新生儿发生高胆红素血症的风险逐渐增加,携带3个风险因素的第8组发生新生儿高胆红素血症的可能性为第1组的8.78倍(95%的置信区间:2.72~28.39)。从图1中也可以看出,随着携带风险因素的增加,箱体总体上移,第7组与第8组75%的病例胆红素峰值均已超过221 μmol/L(图1中红线)。
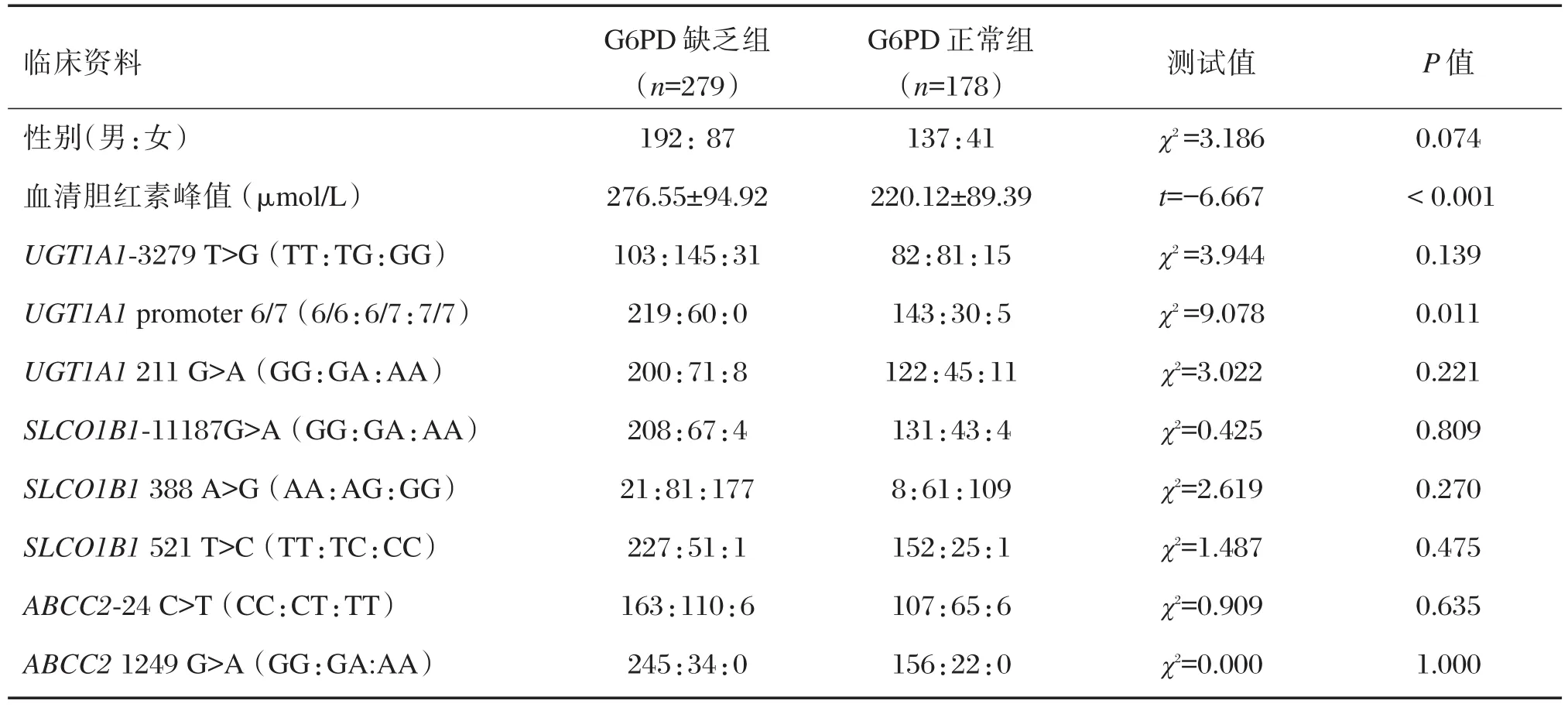
表1 G6PD缺乏组与G6PD正常组的基本资料比较Table 1 Comparison of clinical characteristics of G6PD deficient group and G6PD normal group
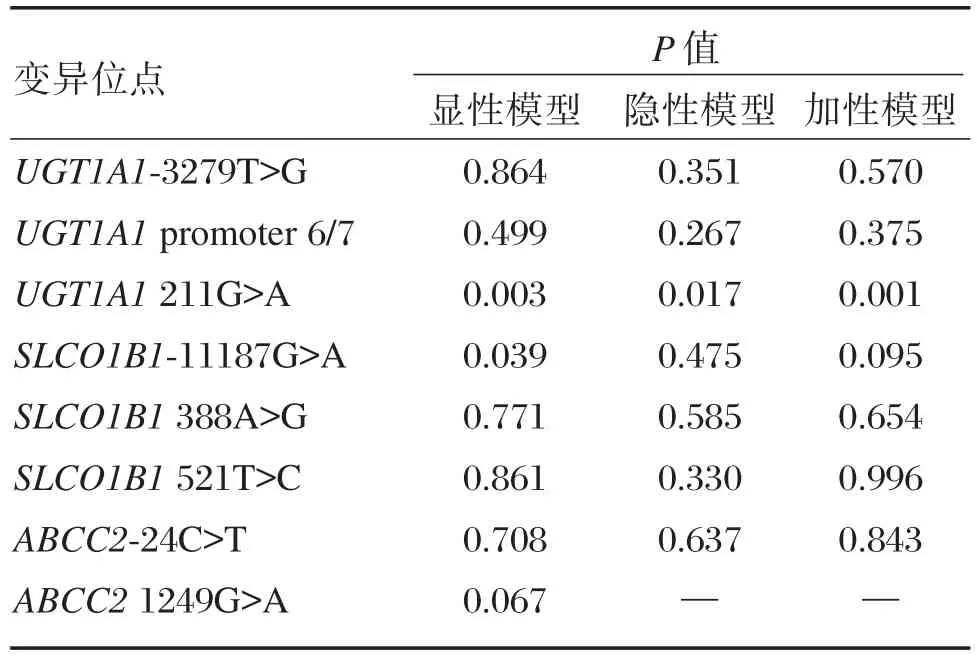
表2 不同遗传模型下8个SNPs对新生儿血清胆红素浓度的影响Table 2 The impact of 8 SNPs on neonatal serum bilirubin concentration using the different genetic models
3 讨论
新生儿外周血胆红素浓度水平取决于红细胞在体内的破坏速度与机体对胆红素的处理两方面,也就是血清总胆红素浓度由胆红素的产生、结合和排泄过程动态决定。新生儿G6PD活性缺乏可以导致红细胞溶血进而增加胆红素的产生,本研究中G6PD缺乏组新生儿高胆红素血症峰值显著高于G6PD正常组(P<0.001),这再次证明了G6PD活性缺乏是新生儿高胆红素血症的风险因素。而胆红素代谢通路上相关基因的SNPs位点可能影响胆红素的结合和排泄进而与新生儿高胆红素血症密切相关,单个基因多态性的研究国内外均有报道[4,6,9]。研究表明UGT1A1、SLCO1B1和ABCC2启动子区和编码区的遗传变异位点可能导致蛋白含量下降或者功能丧失,进而增加新生儿高胆红素血症的风险,特别是UGT1A1启动子区A(TA)6TAA⁃A(TA)7TAA、⁃3279T>G 和编码区211G>A是新生儿高胆红素血症的风险因素[6⁃8,16]。在本研究中,UGT1A1基因 211 G>A 在不同的遗传模型下均显著影响新生儿外周血胆红素峰值,这与其他研究结果[16]相似,进一步证实了该位点为新生儿高胆红素血症的风险位点。然而,本研究中UGT1A1启动子区 A(TA)6TAA⁃A(TA)7TAA和⁃3279 T>G在3种遗传模型下与新生儿外周血胆红素峰值浓度均无显著相关性,这两个位点是否为新生儿高胆红素血症的风险位点仍有待进一步证实。

表3 3个风险因素的不同组合发生新生儿高胆红素血症的相对风险值以及95%置信区间Table 3 The odds ratios and their 95%confidence intervals for each group carrying the different risk factors

图1 携带不同风险因素组合的各组新生儿血清总胆红素浓度峰值的比较Figure 1 Comparison of peak serum bilirubin concentrations for each group carrying the different risk factors
Niemi等[17]报 道SLCO1B1的 ⁃11187G>A、388A>G和521T>C影响OATP⁃C功能。在本研究中,只有SLCO1B1的⁃11187G>A在显性模型下显著影响新生儿外周血胆红素峰值浓度(P=0.039),Choi等[18]报道SLCO1B1基因⁃11187 G>A 可以影响辛伐他汀在体内的药物代谢动力学参数,这在一定程度上证实了SLCO1B1的⁃11187G>A位点可能影响有机阴离子转运多肽C蛋白功能,而本研究发现的SLCO1B1基因⁃11187G>A与新生儿外周血胆红素峰值浓度相关目前未见报道。本研究中SLCO1B1基因 388A>G和521T>C在3种遗传模型下均与新生儿外周血胆红素峰值浓度无显著相关。此外,尽管有报道显示ABCC2基因的⁃24C>T和1249 G>A可能影响多药耐受相关蛋白2的功能[12],但本研究中未能证实这2个位点与新生儿高胆红素血症的相关性。因此,SLCO1B1基因388A>G、521T>C 和ABCC2基 因 的 ⁃24C>T、1249G>A是否会影响新生儿外周血胆红素峰值浓度仍有待进一步的研究。
在新生儿高胆红素血症的风险因素分析中,单个风险因素往往在胆红素代谢过程中的作用较小,而多个风险因素的积累则可能对结果产生较大的影响。因此,本研究通过单因素分析确认的新生儿高胆红素血症的风险因素:G6PD活性缺乏、UGT1A1211G>A和SLCO1B1⁃11187G>A进行不同因素的组合,分析携带不同风险因素个体发生新生儿高胆红素血症的风险。从表3可以看出,G6PD活性缺乏、UGT1A1211G>A和SLCO1B1⁃11187G>A三者中携带风险因素越多,发生新生儿高胆红素血症的风险越大,其中携带3个风险因素的病例血清高胆红素血症发生风险是不携带任何风险因素病例的8.78倍。可以看出,随着携带风险因素的数量增多,新生儿血清胆红素峰值浓度箱丝图整体上移,其中第7组与第8组75%以上的个体均发生了新生儿高胆红素血症。这些结果表明,G6PD活性缺乏、UGT1A1211G>A和SL⁃CO1B1⁃11187G>A对新生儿外周血胆红素峰值浓度存在积累效应,其积累效应产生的生物学基础为G6PD活性缺乏导致新生儿溶血增加,胆红素的生成增多,而UGT1A1211G>A和SLCO1B1⁃11187G>A影响尿苷二磷酸葡萄糖醛酸基转移酶1A1和有机阴离子转运多肽C的功能,导致胆红素的转运和代谢障碍,也增加了外周血胆红素峰值的浓度,若几个因素同时存在,则其作用将累积,导致新生儿外周血胆红素峰值浓度的进一步增高,发生高胆红素血症的风险也进一步加大。另外,不同G6PD基因突变类型是否与胆红素峰值升高的程度有相关性,需要在后续的工作中扩大研究标本的数量进一步研究。
新生儿高胆红素血症在G6PD正常新生儿中发生概率约为7.8%,在G6PD缺乏症的患儿中发生率约为15.6%[19],可见无论在G6PD正常的新生儿还是G6PD缺乏的新生儿中新生儿高胆红素血症均较为普遍。本研究仅分析了9个可能的风险因素与新生儿高胆红素血症的关系,发现SL⁃CO1B1基因⁃11187 G>A位点为新生儿高胆红素血症的风险因素。此外,发现G6PD缺乏、UGT1A1211 G>A和SLCO1B1⁃11187G>A 3种风险因素对新生儿外周血胆红素峰值浓度具有积累效应。然而,在临床上还是存在无上述3种风险因素的新生儿高胆红素血症发生,是否存在其它分子病理机制,目前机理不明。考虑到新生儿高胆红素血症发生的普遍性,检测新生儿G6PD活性和UGT1A1211 G>A、SLCO1B1⁃11187G>A位点的基因型对临床上预防新生儿高胆红素血症的发生发展,降低新生儿核黄疸的发病率,提高我国人口素质具有重要意义。
参考文献
[1]中国新生儿胆红素脑病研究协作组.中国新生儿胆红素脑病的多中心流行病学调查研究[J].中华儿科杂志,2012,50(5):331⁃335.
[2]Mitra S,Rennie J.Neonatal jaundice:aetiology,diag⁃nosis and treatment[J].Br J Hosp Med,2017,78(12):699⁃704.
[3]Beutler E.Glucose⁃6 ⁃phosphate dehydrogenase defi⁃ciency:a historical perspective[J].Blood,2008,111(1):16⁃24.
[4]Mu SC,Chen YL,Tsai LY,et al.Prolonged hyper⁃bilirubinemia in a neonate with a novel mutation in the UDP⁃glucuronosyltransferase 1A1 Gene[J].Neonatol⁃ogy,2016,109(3):235⁃238.
[5]赵丹丹,黄迪,高翔羽.经皮胆红素测定在新生儿黄疸中的应用[J].中华儿科杂志,2017,55(1):74⁃77.
[6]Pasha YZ,Kacho MA,Niaki HA,et al.The associa⁃tion between prolonged jaundice and TATA box dinu⁃cleotide repeats in gilbert's syndrome[J].J Clin Diagn Res,2017,11(9):GC05⁃GC07.
[7]Kang TW,Kim HJ,Ju H,et al.Genome⁃wide associ⁃ation of serum bilirubin levels in Korean population[J].Hum Mol Genet,2010,19(18):3672⁃3678.
[8]Dai X,Wu C,He Y,et al.A genome⁃wide associa⁃tion study for serum bilirubin levels and gene⁃environ⁃ment interaction in a Chinese population[J].Genet Ep⁃idemiol,2013,37(3):293⁃300.
[9]Büyükkale G,Turker G,Kasap M,et al.Neonatal hy⁃perbilirubinemia and organic anion transporting poly⁃peptide⁃2 gene mutations[J].Am J Perinatol,2011,28(8):619⁃626.
[10]刘玲,蒋榆辉,和灿琳,等.影响胆红素代谢的基因多态性研究[J].中国新生儿科杂志,2016,31(1):32⁃35.
[11]Haenisch S,Zimmermann U,Dazert E,et al.Influ⁃ence of polymorphisms of ABCB1 and ABCC2 on mRNA and protein expression in normal and cancerous kidney cortex[J].Pharmacogenomics J,2007,7(1):56⁃65.
[12]May K,Wegner D,Caliebe A,et al.Influence of ge⁃netic polymorphisms on intestinal expression and rifam⁃picin⁃type induction of ABCC2 and on bioavailability of talinolol[J].Pharmacogenet Genomics,2008,18(4):357⁃365.
[13]严提珍,钟青燕,唐宁,等.多色探针荧光PCR熔解曲线法在G6PD基因突变检测中的临床应用评价[J].中华医学遗传学杂志,2014,31(2):156⁃162.
[14]刘义,杜立中,刘悠南,等.新生儿黄疸的历史回顾及问题[J].中华儿科杂志,2009,47(1):30⁃32.
[15]González JR,Armengol L,Solé X,et al.SNPassoc:an R package to perform whole genome association studies[J].Bioinformatics,2007,23(5):644⁃645.
[16]Yang H,Wang Q,Zheng L,et al.Clinical signifi⁃cance of UGT1A1 genetic analysis in Chinese neonates with severe hyperbilirubinemia[J].Pediatr Neonatol,2016,57(4):310⁃317.
[17]Niemi M,Schaeffeler E,Lang T,et al.High plasma pravastatin concentrations are associated with single nu⁃cleotide polymorphisms and haplotypes of organic an⁃ion transporting polypeptide⁃C(OATP⁃C,SLCO1B1)[J].Pharmacogenetics,2004,14(7):429⁃440.
[18]Choi HY,Bae KS,Cho SH,et al.Impact of CYP2D6, CYP3A5, CYP2C19, CYP2A6, SL⁃CO1B1,ABCB1,and ABCG2 gene polymorphisms on the pharmacokinetics of simvastatin and simvastatin acid[J].Pharmacogenet Genomics,2015,25(12):595⁃608.
[19]Huang MJ,Kua KE,Teng HC,et al.Risk factors for severe hyperbilirubinemia in neonates[J].Pediatr Res,2004,56(5):682⁃689.

