甘蔗叶多糖对心肌梗死大鼠心肌细胞凋亡的抑制作用及其机制
刘丹,林锟,侯小涛,秦超,何涛
(1 广西医科大学第一附属医院,南宁530021;2广西中医药大学药学院)
冠状动脉闭塞后,该血管供血的区域血流被阻断,局部心肌由于急性缺血、缺氧,造成该区域心肌细胞坏死与凋亡,其中心肌细胞凋亡是心肌梗死后心肌细胞丢失的主要形式之一[1],尤其是位于梗死边缘区的心肌细胞。细胞凋亡的发生发展受多种基因的调控及蛋白信号通路的介导,目前已知BCL-2与BAX是BCL2家族调控凋亡过程最重要的一对基因,Caspase-3在细胞凋亡调控中亦有不可替代的作用。此外,PI3K/AKT信号转导通路对细胞接受各种病理或生理刺激后是生存还是死亡具有决定性的作用,该通路激活后可抑制细胞凋亡的发生,增强心肌细胞的存活力[2]。本课题组前期实验结果发现,甘蔗叶多糖能缩小大鼠心肌梗死的面积,增加梗死边缘区的微血管密度,促进梗死边缘区血管的生成[3]。为进一步阐明甘蔗叶多糖对大鼠心肌梗死后心肌的保护作用, 2016年10月~2017年8月本实验通过结扎大鼠冠状动脉左前降支建立心肌梗死模型,观察心肌梗死后心肌细胞的凋亡改变,检测凋亡相关基因及蛋白的表达,从而探讨其可能的调控机制,旨在为甘蔗叶多糖的临床应用提供实验依据。
1 材料与方法
1.1 材料 雄性健康8周龄SD大鼠,体质量(230±20)g,由广西医科大学动物实验中心提供。主要试剂:甘蔗叶多糖(广西中医药大学侯小涛老师课题组提供);TUNEL凋亡检测试剂盒 (Roche,1684817 );DAPI染液(博奥森公司,C-0033);抗荧光衰减封片剂(索莱宝公司,S2100);4%多聚甲醛(索莱宝公司,P1110);逆转录试剂盒(大连宝生物工程有限公司,RR036A);荧光定量试剂盒(大连宝生物工程有限公司,RR820A);AKT(美国CST公司);P-AKT(美国CST公司,Thr308);PI3K(美国CST公司);p-PI3K(英国Abcam公司,ab182651),二抗:HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG(英国Abcam公司)。主要仪器:动物呼吸机(ALC-V9 ,上海奥尔特生物科技有限公司);心电图机(FCP-2155,日本福田公司);切片机(德国LEICA公司);数显电热培养箱(上海博讯实业有限公司医疗设备厂,HPX-9082 MBE);OLYMPUS光学显微镜;OLYMPUS BX53正置荧光显微镜。
1.2 大鼠心肌梗死模型建立、分组及给药 按照参考文献[4]的方法结扎冠状动脉左前降支建立大鼠心肌梗死模型。结扎前后分别记录肢导联心电图,造模成功的标准:结扎大鼠冠状动脉左前降支后肢导联ST段抬高。术后24 h将造模成功的30只大鼠随机分为模型对照组(MI组)15只和甘蔗叶多糖处理组(SLP组)15只,另外设假手术组(Sham组) 10只,Sham组只穿线未予结扎。建模后第1天开始各组分别进行灌胃处理,SLP组灌入浓度为4 mg/mL甘蔗叶多糖溶液,剂量为1 mL/100 g大鼠体质量,MI组及Sham组灌入相同剂量的生理盐水,灌胃4周后处死大鼠。
1.3 心肌梗死边缘区细胞凋亡检测 取大鼠心肌梗死边缘区组织,经4%多聚甲醛固定,石蜡包埋切片,采用TUNEL法检测心肌梗死边缘区细胞凋亡。正置荧光显微镜下观察,绿色荧光代表凋亡的细胞,蓝色荧光代表正常的细胞核,每张切片在10×20倍视野下随机选取3~5个视野,采用Image-pro plus 6.0软件计算每张切片凋亡指数。凋亡率=(凋亡细胞数/正常细胞核数+凋亡细胞数)×100%。
1.4 组织病理学观察 取大鼠心肌梗死边缘区组织,经4%多聚甲醛固定后,石蜡包埋制成切片,HE染色,光学显微镜下进行组织病理学观察。
1.5 大鼠心肌梗死边缘区组织BCL-2、BAX、Caspase-3 mRNA表达检测 采用实时荧光定量PCR法。取50 mg梗死边缘区心肌组织,剪碎、超声匀浆后采用TRIzol法提取RNA,经PrimeScriptTM RT Master试剂盒反转录成cDNA,TaKaRa SYBR ExScript RT-PCR Kit进行qPCR反应,引物序列:GAPDH上游引物序列5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物序列5′-GACTCATCGTACTCCTGCTTGCTG-3′;BCL-2上游引物序列5′-GGTGGACAACATCGCTCTG-3′,下游引物序列5′-AGACAGCCAGGAGAAATCAAAC-3′;BAX上游引物序列5′-TTGCTACAGGGTTTCATCCAG-3′, 下游引物序列5′-ATGTTGTTGTCCAGTTCATCG-3′;Caspase-3上游引物序列5′-GCACTGGAATGTCAGCTCGCAA-3′,下游引物序列5′-GCCACCTTCCGGTTAACACGAG-3′。GAPDH为相对定量参照物,2-ΔΔCT计算各基因相对表达量。
1.6 大鼠心肌梗死边缘区组织p-AKT/AKT、p-PI3K/ PI3K蛋白表达检测 采用Western blotting法。取50 mg梗死边缘区心肌组织,剪碎后经超声匀浆破碎后提取蛋白。经电泳、转膜、孵育一抗(GAPDH、p-AKT、AKT、p-PI3K、PI3K 均1∶1 000)、二抗(1∶5 000)、ECL化学发光底物显色后,使用FliorChem HD2 成像系统观察,DRAFT-alphaview计算图像条带灰度值,计算p-AKT/AKT、p-PI3K/ PI3K。
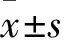
2 结果
2.1 心肌梗死模型建立情况 术后对大鼠进行肢导联心电图检查,结果显示:结扎冠状动脉左前降支后大鼠肢导联ST段呈弓背向上抬高,造模后4周可见肢导联陈旧性病理性Q波,呈现心肌梗死后典型的心电图改变,说明心肌梗死造模成功。
2.2 各组组织病理学观察比较 Sham组心肌细胞排列整齐,细胞界限清晰,显示为正常心肌细胞形态。心肌梗死后,在MI组中观察到心肌细胞排列紊乱,细胞间隙不清,细胞核大而深染,周围可见炎性细胞浸润,心肌纤维增粗、变长。而甘蔗叶多糖处理后,SLP组中观察到梗死区心肌细胞排列比较整齐,炎性细胞浸润较MI组减少,细胞间隙较MI组清晰,可见少量心肌细胞肥大增生。见图1。
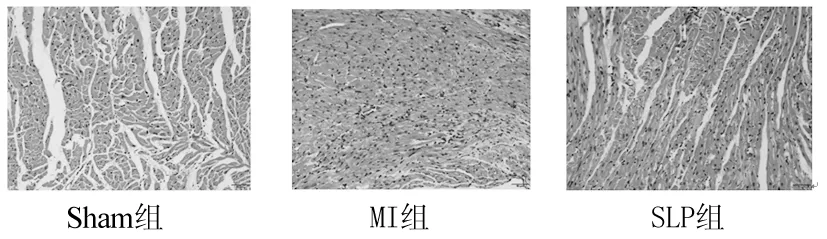
图1 各组大鼠心肌梗死边缘区组织HE染色结果比较(×200)
2.3 各组心肌细胞凋亡比较 Sham组无心肌细胞凋亡现象,均为蓝色正常心肌细胞胞核,未见绿色凋亡细胞; MI组和SLP组均有心肌细胞凋亡,而SLP组凋亡细胞较MI组明显减少。TUNEL测心肌细胞凋亡结果显示,Sham组、MI组、SLP组的凋亡率分别为0.017%±0.007%、0.307%±0.048%、0.109%±0.034%,各组间心肌细胞凋亡指数差异均有统计学意义(P均<0.05);与Sham组比较,MI组和SLP组心肌细胞凋亡指数升高,而SLP组相对MI组心肌细胞凋亡指数降低(P均<0.05)。
2.4 各组大鼠心肌梗死边缘区组织BCL-2、BAX、Caspase-3 mRNA表达比较 在各组大鼠心肌梗死边缘区组织中BAX、BCL-2、Caspase-3 mRNA均表达,与Sham组比较,MI组中BAX、BCL-2、Caspase-3 mRNA表达升高,差异均有统计学意义(P均<0.05)。与MI组比较,SLP组中BCL-2 mRNA表达升高,BAX、Caspase-3 mRNA表达降低,差异均有统计学意义(P均<0.05)。见表1。
表1 各组大鼠心肌梗死边缘区组织BCL-2、BAX 、Caspase-3 mRNA表达比较
2.5 各组大鼠心肌梗死边缘区组织p-AKT/AKT、p-PI3K/ PI3K蛋白表达比较 在各组大鼠心肌梗死边缘区组织中p-AKT、AKT、p-PI3K、PI3K蛋白均表达,与Sham组比较,MI组中p-AKT/AKT、p-PI3K/ PI3K蛋白表达降低,差异均有统计学意义(P均<0.05)。与MI组比较,SLP组中p-AKT/AKT、p-PI3K/ PI3K表达升高,差异均有统计学意义(P均<0.05)。见表2。
表2 各组大鼠心肌梗死边缘区组织p-AKT/AKT、p-PI3K/ PI3K蛋白表达比较
3 讨论
近年来研究表明,心肌梗死后心肌细胞凋亡是心肌梗死后心力衰竭、心室重构等心血管疾病发生发展的重要细胞学基础[1,5],如何有效的减少心肌梗死后心肌细胞凋亡是我们临床研究的一个重要方向。从植物中提取的多糖是一类具有广泛生物学活性的大分子物质,已有研究发现某些植物多糖对心肌梗死后的心肌具有保护作用,朱天民等[6]研究发现植物多糖如红豆杉多糖可抑制缺血再灌注损伤导致的心肌细胞凋亡。本实验成功建立心肌梗死模型后,TUNEL结果发现甘蔗叶多糖能明显减少大鼠心肌梗死后梗死边缘区心肌细胞的凋亡,提示甘蔗叶多糖能增强心肌梗死后心肌细胞的存活力,减少心肌梗死后心肌细胞丢失,从而保护因缺血、缺氧而受损的心肌。
细胞凋亡涉及一系列基因与蛋白的激活、表达以及调控,其中BCL-2家族与Caspase家族目前最受关注。在BCL-2家族中BCL-2与BAX是一对功能相互对立调控凋亡的基因,BCL-2是第一个被确认能够抗细胞凋亡的原癌基因,其基因产物主要定位于线粒体膜、核膜、内质网膜上,其抗凋亡的主要机制是通过抑制线粒体释放促凋亡的蛋白,如细胞色素C,抑制凋亡蛋白酶的激活,维持细胞内钙稳态,进而抑制凋亡的发生[7]。 BAX是BCL-2的同源基因,属于促凋亡的原癌基因,其编码的蛋白质主要位于细胞质,可通过释放细胞色素C等促凋亡因子,破坏线粒体外膜,进而促进细胞凋亡的发生[8]。BCL-2与BAX共同决定细胞受诱导刺激后是凋亡还是存活的状态[9]。此外,凋亡发生的标志酶Caspase-3在细胞凋亡过程中也起到了关键性的作用,是凋亡过程中关键的凋亡执行蛋白酶,同时也是死亡受体凋亡途径和线粒体凋亡途径下游的共同效应部分,在凋亡过程中占据极其重要的地位[7,10]。本实验结果显示甘蔗叶多糖能增加BCL-2的表达,减少BCL-2、Caspase-3的表达,提示甘蔗叶多糖减少心肌梗死后细胞凋亡可能与促进抑凋亡基因BCL-2的表达,抑制促凋亡基因BAX、Caspase-3的表达有关。
有研究发现PI3K/AKT信号转导通路是细胞内重要的生存通路,在调节细胞的凋亡、存活、增殖等活动中发挥重要的生物学功能,可从多种水平抑制细胞凋亡的发生[11,12]。并有研究证实PI3K磷酸化后可激活下游的靶分子AKT 发生磷酸化,可调节BCL-2家族成员的活性,增强了抑凋亡基因BCL-2的活性[13],同时该通路也可抑制细胞色素C从线粒体释放,抑制Caspase-3的激活,进而抑制细胞凋亡发生[14]。本实验结果显示甘蔗叶多糖能使p-AKT/AKT、p-PI3K/PI3K的表达均增加,这进一步表明甘蔗叶多糖减少心肌梗死后心肌细胞凋亡,亦可能与上调p-AKT/AKT、p-PI3K/PI3K蛋白的表达有关。
综上所述,甘蔗叶多糖能有效的减少心肌细胞凋亡,保护因缺血、缺氧而受损的心肌增加心肌细胞的存活力,其机制可能与增加抑凋亡基因BCL-2的表达,减少BAX、Caspase3促凋亡基因的表达,上调p-AKT/AKT、p-PI3K/PI3K蛋白的表达有关。
参考文献:
[1] Teringova E, Tousek P. Apoptosis in ischemic heart disease[J]. J Transl Med, 2017,15(1): 87.
[2] Ke Z, Wang G, Yang L, et al. Crude terpene glycoside component from Radix paeoniae rubra protects against isoproterenol-induced myocardial ischemic injury via activation of the PI3K/AKT/mTOR signaling pathway[J]. J Ethnopharmacol , 2017,206:160-169.
[3] 何涛,胡姗,侯小涛,等.甘蔗叶多糖对大鼠心肌梗死心电图及微血管生成的影响[J].广西医科大学学报, 2016, 33(2):229-231.
[4] 阮红,何涛,秦超,等.制备大鼠心肌梗死模型中不同人工通气法比较[J].广西医科大学学报,2011, 28(6):823-825.
[5] Garg S, Narula J, Chandrashekhar Y. Apoptosis and heart failure: clinical relevance and therapeutic target[J]. J Mol Cell Cardiol, 2005, 38(1): 73-79.
[6] 朱天民,朱慧民,李辉.红豆杉多糖对Beagle犬心肌缺血再灌注模型心肌细胞凋亡及单核细胞趋化蛋白-1与NO表达的影响[J].中草药,2010,41(5):778-781.
[7] Sun C, Liu H, Guo J, et al. MicroRNA-98 negatively regulates myocardial infarction-induced apoptosis by down-regulating F a s and caspase-3[J]. Sci Reps, 2017, 7(1): 7460.
[8] Walensky LD. BCL-2 in the crosshairs: tipping the balance of life and death[J]. Cell Death Differ, 2006, 13(8): 1339-1350.
[9] Wang Y, Zhang H, Chai F, et al. The effects of escitalopram on myocardial apoptosis and the expression of B ax and Bcl-2 during myocardial ischemia/reperfusion in a model of rats with depression[J]. BMC Psychiatry, 2014, 14: 349.
[10] Zhao H, Xu M, Chu G. Association between myocardial cell apoptosis and calpain-1/caspase-3 expression in rats with hypoxic-ischemic brain damage[J]. Mol Med Rep, 2017, 15(5): 2727-2731.
[11] Song G, Ouyang G, Bao S. The activation of A k t/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59-71.
[12] Mocanu MM, Yellon DM. PTEN, the Achilles′ heel of myocardial ischemia/reperfusion injury [J].Brit J Pharmacol , 2007, 150(7): 833-838.
[13] Limaye V, Li X, Hahn C, et al. Sphingosine kinase-1 enhances endothelial cell survival through a PECAM-1-dependent activation of PI-3K/Akt and regulation of Bcl-2 family members[J]. Blood, 2005, 105(8): 3169-3177.
[14] Liu S, Ai Q, Feng K, et al. The cardioprotective effect of dihydromyricetin prevents ischemia-reperfusion-induced apoptosis in vivo and in vitro via the PI3K/Akt and HIF-1alpha signaling pathways[J]. Apoptosis, 2016, 21(12):1366-1385.

