流体剪切应力对氧化型低密度脂蛋白诱导血管内皮细胞损伤及黏着斑重塑的影响
钟挺挺,李燕玲,何小洪,董吁钢,马虹,郑振声,张焰
(1中山大学附属第一医院,广州510080;2深圳市孙逸仙心血管医院;3中山大学附属第三医院)
动脉粥样硬化(AS)是危害人类身体健康的重大疾病,AS性心脑血管疾病已经成为世界各国人群病死的重要原因,国内患病率也在逐年攀升。AS始于血管内皮损伤导致的功能障碍,脂质沉积是引起上述病变的重要诱因[1,2]。研究发现,AS病灶好发于血管分叉开口处、弯曲处,其局部流体剪切应力较低且方向紊乱,而相对少见于直行血管,其局部流体剪切应力较高且方向一致。剪切应力影响血管内皮细胞表型[3,4],但在高脂环境下血管内皮细胞黏着斑的变化、对流体剪切应力的反应及其作用机制尚未完全阐明。2013年10月~2017年12月本研究拟探讨流体剪切应力对氧化型低密度脂蛋白(ox-LDL)导致的血管内皮细胞损伤和黏着斑重塑的影响。
1 材料与方法
1.1 试剂与仪器 ox-LDL(广州奕元生物科技公司),Integrin β1Antibody(美国Abcam公司),FAK Antibody(美国Cell Signal Technology公司),Paxillin Antibody(美国Cell Signal Technology公司),Phalloidin(美国Sigma公司),相差显微镜(Eclipse TS100,日本Nikon公司),平行板流动腔Parallel-Plate Flow Chamber(德国ibidi公司),激光扫描共聚焦显微镜(LSM 780,德国ZEISS公司)等。
1.2 人脐静脉内皮细胞(HUVECs) 提取与培养 HUVECs由新鲜脐带提取,主要步骤如下:37 ℃水浴锅复温Ⅱ型胶原酶溶液、PBS,用20 mL注射器吸取PBS反复冲洗脐静脉腔直至流出液变为澄清,吸取Ⅱ型胶原酶溶液充盈脐静脉腔,两端夹闭,37 ℃恒温孵育15 min,揉搓以使脐静脉内皮松解,将腔内消化液移入离心管,1 000 r/min离心5 min,弃去上清,加入5 mL SFM培养基重悬细胞,移入37 ℃ 5% CO2恒温培养箱中培养[5]。
1.3 细胞干预及分组 将传代培养4~5代的HUVECs接种于平行板流动腔,培养48 h获得致密贴合的单细胞层。将ox-LDL溶于SFM培养基,终浓度100 μg/mL,灌入平行板流动腔,使用蠕动泵驱动管路液体流动。参照文献[6]的方法构建5、25 dyne/cm2流体剪切应力,计算公式τ=6 μQ/a2b,其中μ为流体黏度(dynos/cm2) ,Q为流量(mL/s),a为流体腔高度(cm),b为流体腔宽度(cm),干预时长为4 h。细胞随机分为4组:静态组、静态加ox-LDL干预组、5 dyne/cm2流体剪切应力加ox-LDL干预组、25 dyne/cm2流体剪切应力加ox-LDL干预组。静态组细胞种于平行板流动腔内但不予流体剪切应力及ox-LDL干预[7]。
1.4 细胞形态观察及留存率检测 收集各组干预后的细胞,温PBS清洗后4%多聚甲醛固定15 min,相差显微镜成像,观察细胞形态,随机选取5个不重复区摄片,Image J软件计算细胞数,分析附着于基质的细胞留存率[8]。
1.5 细胞内整合素-β1(Integrin-β1)、黏着斑激酶(FAK)、桩蛋白(Paxillin)表达检测 采用免疫荧光法。收集干预后的内皮细胞,温PBS清洗后4%多聚甲醛固定15 min,0.1% Triton-X-100通透30 min,1% FBS封闭抗原表位,分别加入1∶1 000稀释的Integrin-β1、FAK、Paxillin一抗,4 ℃过夜孵育,加入1∶500稀释的荧光二抗,37 ℃孵育1 h,加入1∶10稀释的DAPI,常温孵育15 min。激光扫描共聚焦显微镜随机选取5个不重复区摄片,用Image J软件分析各视野绿色荧光强度。
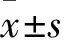
2 结果
2.1 各组细胞形态学改变及留存率比较 静态组相差显微镜成像显示内皮细胞扁平,长圆形“鹅卵石”样,排列紧密但没有固定的方向,内皮细胞单层覆盖均匀完整;静态加ox-LDL干预组内皮细胞失去了典型的形态,胞膜皱缩,胞体变小,圆隆,排列紊乱,表面附着有多个细胞碎片,约20%胞体脱落, 内皮细胞单层完整性受损;5 dyne/cm2流体剪切应力加ox-LDL干预组细胞形态已比静态加ox-LDL干预组有所改善,脱落有所减少,但排列仍较紊乱;25 dyne/cm2流体剪切应力加ox-LDL干预组细胞呈长纺锤状,倾向于顺着流动方向排列,细胞排列紧密,脱落较少,细胞与基质之间的黏附较为牢固。25 dyne/cm2流体剪切应力加ox-LDL干预组细胞留存率为95.15%±16.20 %,高于静态加ox-LDL组(80.95%±14.72 %)、5 dyne/cm2流体剪切应力加ox-LDL干预组(88.86%±14.23 %)(P均<0.05)。静态加ox-LDL组细胞留存率与5 dyne/cm2流体剪切应力加ox-LDL干预组比较差异无统计学意义(P>0.05)。
2.2 各组Integrin-β1、FAK、Paxillin表达比较 静态加ox-LDL干预组、5 dyne/cm2流体剪切应力加ox-LDL干预组、25 dyne/cm2流体剪切应力加ox-LDL干预组Integrin-β1、FAK、Paxillin的荧光强度均高于静态组(P均<0.05);5 dyne/cm2流体剪切应力加ox-LDL干预组Integrin-β1、FAK、Paxillin荧光强度低于静态加ox-LDL干预组(P<0.05);25dyne/cm2流体剪切应力加ox-LDL干预组Integrin-β1、FAK、Paxillin荧光强度低于静态加ox-LDL干预组及5 dyne/cm2流体剪切应力加ox-LDL干预组(P均<0.05),见表1。
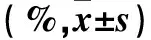
表1 各组Integrin-β1、FAK、Paxillin荧光强度比较
3 讨论
血管内皮是由单层内皮细胞和基底膜构成的一层半选择性通透屏障,是分隔血浆与组织液维持跨内皮蛋白浓度梯度的重要结构,能够通过自分泌、内分泌和旁分泌等途径分泌多种活性物质参与血管功能的调节,对于组织的氧供与代谢废物的转运具有重要的意义[9,10]。内皮细胞层的完整性取决于内皮细胞与相邻细胞之间的连接以及内皮与其下方细胞外基质的连接,内皮与基底膜间的连接主要为黏着斑,内皮细胞之间的连接主要为紧密连接、黏附连接和缝隙连接。血管内皮细胞内部为微管、微丝和中间纤维组成的细胞骨架结构,在维持细胞形态的同时参与生命活动[11]。研究结果显示,机械应力刺激首先激活细胞膜上的感受器,引起细胞膜上相应受体蛋白活化,包括敏感性离子通道、细胞间黏附复合物、G-蛋白偶联受体、黏着斑等,从而导致胞内一系列信号蛋白的活性发生改变,最终调节基因表达和蛋白质的合成。
细胞膜上的黏着斑是力学信号传导的重要枢纽,主要构成成分为Integrin、FAK、Paxillin、纽蛋白等。黏着斑膜外与细胞外基质连接,膜内与细胞骨架直接相连,机械应力即可通过黏着斑传递给细胞骨架结构继而传递到远端细胞膜、细胞内基质、内质网及细胞核,由此引发细胞内一系列生化级联反应,最终诱导分化、增殖及凋亡等生物学效应[12]。
Integrin由跨膜蛋白α、β两个亚基构成,其胞外结构域与配基结合而激活,继而募集多个 FAK 分子到黏着斑处,使得 FAK 酪氨酸磷酸化而被激活。FAK是由1 028个氨基酸构成的非受体型酪氨酸激酶,参与调控多条细胞信号转导通路,是胞内外信号转导的中枢分子,通过调节MAPK、PI3K、p53等信号通路调控细胞的生长、代谢等。Paxillin是一种细胞骨架上的信号转导蛋白,是黏着斑蛋白vinculin的结合蛋白。近来的研究发现,虽然本身可能不具有酶活性,但因为其分子中含有多种结构域,能够和一系列的信号蛋白和结构蛋白结合,在Integrin介导的信号转导通路中起着信号传递“中转站”的作用[13]。
机体内的细胞不仅可以感知外环境各种化学因素的刺激,其自身也处在各种机械环境中,当血液在流动的过程中,对血管壁细胞会产生力的作用,主要包括血管内表面的剪切应力,血管扩张形成的周向应力以及对管壁的压应力。剪切应力是指血液在流动过程中与血管内壁产生的摩擦力,其大小与血流速度、血液黏滞度和血管内径密切相关。其中,血液中各质点流动方向与血管长轴平行一致的称为层流,各质点流动方向与血管长轴不一致的称为湍流,前者见于大血管直行部位,流体剪切应力较高(>15 dyne/cm2)且方向一致,后者见于血管分叉、弯曲、扩张等部位,局部流体剪切应力较低(<4 dyne/cm2)且方向紊乱。在体内血管内皮细胞时刻处于剪切应力的作用之下,对剪切应力的变化非常敏感,剪切应力影响血管内皮细胞形态和功能[14,15]。
在AS的众多危险因素中,ox-LDL被公认为是导致内皮细胞活化及血管内皮功能障碍的最主要致病因素。在本研究中,内皮细胞经ox-LDL刺激后,胞膜皱缩,胞体脱落,细胞附着于基质的留存率显著下降,内皮细胞单层完整性受损,同时黏着斑的主要成分Integrin、FAK、Paxillin表达显著上调,提示黏着斑在这种促AS状态下发生了重塑,但这种过度的重塑不足以代偿细胞的损伤,黏着斑的功能失常,难以维持细胞与基质间的黏附。经流体剪切应力干预后,上述改变得到不同程度的逆转,内皮细胞形态正常化,并且倾向于顺着流体的流动方向排列,胞体脱落减少,内皮细胞单层完整性受损现象明显改善,同时Integrin、FAK、Paxillin的蛋白表达水平下调,提示ox-LDL诱导的黏着斑过度重塑弱化,黏着斑趋向于恢复正常形态和功能,细胞与细胞外基质的黏附更为牢固,对于内皮稳态的维持具有积极意义。
综上所述,ox-LDL可导致血管内皮细胞损伤、脱落和黏着斑重塑,而生理范围内较高水平的层流剪切应力能够有效地减轻黏着斑过度重塑,促进血管内皮细胞附着于基质,减轻血管内皮细胞损伤。
参考文献:
[1] 中国成人血脂异常防治指南修订联合委员会.中国成人血脂异常防治指南(2016年修订版)[J].中国循环杂志, 2016, 31(10):7-28.
[2]康攀攀,姚树桐,周健,等.内质网应激在脂蛋白修饰致动脉粥样硬化中作用机制的研究进展[J].山东医药, 2017, 57(48):107-110.
[3] Malek AM, Alper SL, Izumo S. Hemodynamic shear stress and its role in atherosclerosis[J]. JAMA, 1999,282(21):2035-2042.
[4] Zhang Y, He X, Liu D, et al. Enhanced external counterpulsation attenuates atherosclerosis progression through modulation of proinflammatory signal pathway[J]. Arterioscler Thromb Vasc Biol, 2010, 30(4):773-780.
[5] Baudin B, Bruneel A, Bosselut N, et al. A protocol for isolation and culture of human umbilical vein endothelial cells[J]. Nat Protoc, 2007,2(3):481-485.
[6] Fedorchak GR, Kaminski A, Lammerding J. Cellular Mechanosensing: Getting to the nucleus of it all[J]. Prog Biophys Mol Biol, 2014,115(2-3):76-92.
[7] 李燕玲,何小洪,张焰,等.层流剪切应力对高脂环境下白细胞-内皮细胞黏附的影响及其机制[J].山东医药, 2016,56(16):15-18.
[8] Liu H, Gong X, Jing X, et al. Shear stress with appropriate time-step and amplification enhances endothelial cell retention on vascular grafts [J]. J Tissue Eng Regen Med, 2017,11(11):2965-2978.
[9] Baumer Y, McCurdy S, Weatherby TM, et al. Hyperlipidemia-induced cholesterol crystal production by endothelial cells promotes atherogenesis[J]. Nat Commun, 2017, 8(1): 1129.
[10] 黄文,谈红,王潞,等.氯沙坦对动脉粥样硬化兔主动脉内皮细胞凋亡的影响及机制探讨[J].山东医药,2017, 57(14):50-52.
[11] Yuan SY, Shen Q, Rigor RR, et al. Neutrophil transmigration, focal adhesion kinase and endothelial barrier function[J]. Microvasc Res,2012,83(1):82-88.
[12] Israeli-Rosenberg S, Manso AM, Okada H, et al. Integrins and integrin-associated proteins in the cardiac myocyte [J]. Circ Res, 2014,114(3):572-586.
[13]Dorland YL, Huveneers S. Cell-cell junctional mechanotransduction in endothelial remodeling [J]. Cell Mol Life Sci, 2017, 74(2):279-292.
[14] Wang KC, Nguyen P, Weiss A, et al. MicroRNA-23b regulates cyclin-dependent kinase-activating kinase complex through cyclin H repression to modulate endothelial transcription and growth under flow [J] . Arterioscler Thromb Vasc Biol, 2014,34(7):1437-1445.
[15] 张焰,马虹,郑振声.血管内皮细胞的剪切应力信号转导机制与动脉粥样硬化[J].中国动脉硬化杂志,2005,13(4): 513-516.

