类风湿关节炎患者心外膜脂肪组织厚度与心房功能的相关性
张艳,高硕辰,冯宁,杜方雪,杨颍,高香玲
(1郑州大学第一附属医院,郑州450052;2商丘市第一人民医院)
类风湿关节炎(RA),是一种慢性系统性炎症性疾病,发病率为0.5%~1%[1],以慢性侵袭性滑膜炎为特征,外周关节最先受累,关节外受累也很常见。流行病学资料表明RA是心血管疾病的一项独立危险因素[2,3]。既往研究表明无明确心血管疾病的RA患者已普遍存在左室舒缩功能障碍、右室舒张功能障碍、心房功能障碍[4~7]。心外膜脂肪组织(EAT)存在于心脏周围,位于心肌和脏层心包之间[8]。经胸超声心动图是一种可靠的测量EAT厚度的方法[9,10]。已有研究证实在RA患者中,超声测量的EAT与亚临床左室收缩功能障碍、左室舒张功能障碍[11,12]有关,但RA患者EAT增厚是否与心房功能障碍有关未见报道。本研究旨在探讨超声测量RA患者的EAT厚度及其与心房功能的相关性。
1 资料与方法
1.1 临床资料 选取2016年12月~2017年3月郑州大学第一附属医院就诊的RA患者44例(RA组),其中男10例、女34例,年龄(52.8±13.5)岁,体质量指数(BMI)(23.8±0.8)kg/m2,腰臀比(WHR)0.80±0.11。入选标准:年龄≥18岁,满足1987年美国风湿病学会诊断标准。排除标准:急性病、各种心血管疾病、慢性阻塞性肺疾病、其他系统性疾病、肝肾衰竭、糖尿病、妊娠、甲状腺功能异常、起搏器置入术后与超声图像差的患者。另选取健康成年人30例作为对照组,其中男6例、女24例,年龄(50.5±9.9)岁,BMI(25.0±0.6)kg/m2,WHR 0.78±0.16。两组性别、年龄、BMI、WHR比较差异无统计学意义(P均>0.05)。
1.2 检查方法及观察指标 心脏超声检查采用PHILIPS IE33 超声诊断仪,探头频率1~5 MHz,配有组织多普勒成像(TDI)软件。受检者超声检查前休息15 min,检查时左侧卧位,连接同步心电图。由一位经验丰富的超声医师测量并记录数据,同步记录心电图。测量心房各壁心电图P波起点到TDI曲线心房收缩期A峰起始点的时间间期(电-机械收缩时间),计算心房内、心房间电-机械收缩时间差,并测量心房收缩期各房壁运动峰值速度(PV)[7];EAT是心肌与脏层心包之间的低-无回声区,于标准的胸骨旁左室长轴切面,房室沟位置,垂直于右室游离壁,测量收缩期EAT(EATs)与舒张期EAT(EATd)厚度。以上所有指标均测量3个心动周期,取平均值。
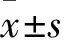
2 结果
2.1 两组EATs与EATd厚度比较 RA组EATs与EATd均较对照组增厚,差异均有统计学意义(P均<0.05)。见表1。

表1 两组EATs与EATd厚度比较
注:与对照组比较,*P<0.05。
2.2 两组心房收缩期各房壁PV比较 两组左房后间壁、前间壁及下壁PV比较差异均无统计学意义(P均>0.05);RA组左房侧壁、后壁、前壁及右房侧壁PV均低于对照组,差异均有统计学意义(P均<0.05)。见表2。

表2 两组心房收缩期各房壁PV比较
注:与对照组比较,*P<0.05。
2.3 两组心房各房壁电-机械收缩时间差比较 RA组左房侧壁与后间壁、左房前间壁与后壁电-机械收缩时间差均大于对照组,差异均有统计学意义(P均<0.05);左房后间壁与右房侧壁、左房前壁与下壁时间差RA组较对照组均有增大趋势,但差异均无统计学意义(P均>0.05)。见表3。

表3 两组心房各房壁电-机械收缩时间差比较
注:与对照组比较,*P<0.05。
2.4 EATs、EATd厚度与心功能的关系 RA组EATs厚度与左房侧壁、前壁PV呈负相关(r分别为-0.376,-0.461;P均<0.05);EATs厚度与左房侧壁与后间壁时间、左房前间壁与后壁电-机械收缩时间差及WHR均呈正相关(r分别为0.640、0.775、0.393,P均<0.05);EATd厚度与左房侧壁与后间壁、左房前间壁与后壁电-机械收缩时间差及WHR均呈正相关(r分别为0.625、0.669、0.334,P均<0.05)。
3 讨论
RA心脏损害多为隐匿性,出现临床症状者不足5%,但病死率较高[13]。EAT作为一种代谢活跃的内脏脂肪组织,可以释放多种生物活性物质,这些物质可以调节血管平滑肌收缩;而EAT的位置与血管外膜及血管床毗邻,故其具有的旁分泌效应在心血管疾病的发病机制中起关键作用[14,15]。既往研究也已经证实,EAT与心血管代谢风险增加及冠状动脉疾病的发生有关[10]。心房功能是心脏功能的重要组成部分,舒张晚期心房主动收缩将血泵入心室,即心房具有助力泵功能,采用房壁PV、电-机械收缩耦联评估。
本研究结果显示,RA患者EATs、EATd均较对照组增厚,与既往研究[12]结果一致,可能与基因、信号传导通路等分子水平改变有关,有待进一步研究证实。
本研究中,TDI与心电图结合所测量的各房壁运动指标与健康人比较,电-机械收缩时间无显著差异,但部分心房壁PV降低,部分房壁运动不同步,PV差异有统计学意义者均为游离壁,可能与间隔壁运动所受影响因素较多有关,且RA组左房侧壁与后间壁、左房前间壁与后壁运动不同步较为显著,可能与间隔壁运动改变不明显而游离壁有显著改变有关。因此,本研究提示RA患者即使无明确心血管疾病,依然可能存在心房功能障碍,对RA患者应尽早进行临床干预,预防心血管不良事件的发生,延长患者生存时间。
另外,本研究结果显示EATs厚度与左房侧壁、前壁PV呈负相关,EATs、EATd厚度均和左房侧壁与后间壁、左房前间壁与后壁电-机械收缩时间差呈正相关,提示EATs越厚,左房前壁及侧壁运动速度可能越低,房壁运动可能越不协调,则心房泵功能越低。同时发现RA患者EATs、EATd厚度均与WHR呈正相关,患者WHR越大,腹部脂肪越多,越趋于中心性肥胖,EAT可能越厚,心房泵功能及房壁运动协调性可能越差。
综上所述,RA患者EATs、EATd均增厚, EATs厚度与左房侧壁、前壁PV呈负相关,EATs、EATd厚度与左房侧壁与后间壁、左房前间壁与后壁电-机械收缩时间差呈正相关。本研究提示无明确心血管疾病的RA患者仍存在一定的心房功能障碍及房壁运动不同步,超声诊断技术测量的EAT越厚提示患者可能存在更严重的心房损害。
参考文献:
[1] Gabriel SE. The epidemiology of rheumatoid arthritis[J].Rheum Dis Clin North Am, 2001,27(2):269-281.
[2] Meune C, Touze E, Trinquart L, et al. Trendsin cardiovascular mortality in patients with rheumatoidarthritis over 50 years: a systematic review and meta-analysis ofcohortstudies[J]. Rheumatology, 2009,48(10):1309-1313.
[3] Avina-Zubieta JA, Choi HK, Sadatsafavi M, et al. Risk of cardiovascular mortalityin patients with rheumatoid arthritis: a meta-analysisof observational studies[J]. Arthritis Rheum, 2008,59(12):1690.
[4] Baktir AO, Sarli B, Cebicci MA, et al. Preclinical impairment of myocardial function in rheumatoid arthritispatients. Detection of myocardial strain by speckle tracking echocardiography[J]. Herz, 2015,40(4):669-674.
[5] Cioffi G, Viapiana O, Ognibeni F, et al. Prognostic role of subclinical left ventricular systolic dysfunction evaluated by speckle-tracking echocardiography in rheumatoid arthritis[J]. J Am Soc Echocardiogr, 2017,30(6):602-611.
[6] Seyfeli E, Guler H, Akoglu S, et al. Right ventricular diastolic abnormalities in rheumatoid arthritis and its relationship with left ventricular and pulmonary involvement. A tissue Doppler echocardiographic study[J]. Int J Cardiovasc Imaging, 2006,22(6):745-754.
[7] Acar G, Sayarlio lu M, Ak ay A, et al. Evaluation of atrial electromechanical delay and left atrial mechanical functions in patients with rheumatoid arthritis[J]. Turk Kardiyol Dern Ars, 2009,37(7):447-453.
[8] Iacobellis G, Corradi D, Sharma AM. Epicardial adiposetissue:anatomic, biomolecular and clinical relationships with the heart[J]. Nat Clin Pract Cardiovasc Med, 2005,2(10):536-543.
[9] Iacobellis G, Ribaudo MC, Assael F, et al. Echocardiographic epicardial adipose tissue is related to anthropometric and clinical parameters of metabolic syndrome: a new indicator of cardiovascular risk[J]. J Clin Endocrinol Metab, 2003,88(11):5163-5168.
[10] Iacobellis G, Assael F, Ribaudo MC, et al. Epicardial fat from echocardiography:a new method for visceral adipose tissue prediction[J]. Obes Res, 2003,11(2):304-310.
[11] Ng AC, Goo SY, Roche N, et al. Epicardial adipose tissue volume and left ventricular myocardial function using 3-dimensional speckle tracking echocardiography[J]. Can J Cardiol, 2016,32(12):1485-1492.
[12] Fatma E, Bunyamin K, Savas S, et al. Epicardial fat thickness in patients with rheumatoid arthritis[J]. Afr Health Sci, 2015,15(2):489-495.
[13] Sihvonen S, Korpela M, Laippala P, et al. Death rates and causes of death in patients with rheumatoid arthritis:A population-based study[J].Scand J Rheumatol, 2004,33(4):221-227.
[14] Szasz T, Webb RC. Perivascular adipose tissue:more than just structural support[J]. Clin Sci (Lond), 2012,122 (1):1-12.
[15] Bachar GN, Dicker D, Kornowski R, et al. Epicardialadipose tissue as a predictor of coronary arterydisease in asymptomatic subjects[J]. Am J Cardiol, 2012,110 (4):534 -538.

