乌司他丁联合甲基泼尼松龙对老年大面积烧伤患者血清IL-6、PCT及TPO水平的影响
闵维雄(武汉市第三医院,武汉430061)
大面积烧伤的治疗十分棘手,尤其是对于老年患者,因各器官的机能减退,大面积烧伤后可导致强烈的创伤和刺激,出现休克、感染等,不利于患者预后。大面积烧伤后,白细胞介素-6(IL-6)、IL-8、肿瘤坏死因子α(TNF-α)等炎性介质水平可在短时间内明显上升,经级联反应与“瀑布效应”不断扩增,与白细胞、内皮细胞黏附分子相互作用引发广泛的血管内皮炎症。广谱蛋白酶抑制剂乌司他丁具有抗炎、改善凝血以及抗休克等作用[1],近年来在大面积烧伤领域的应用越来越多,但在高龄患者的应用中常需减量,使得疗效难以满足临床要求。糖皮质激素是临床常用的抗炎药物,具有较理想的抗休克作用,但同时也具有抑制免疫、诱发细菌感染等负面作用。近年来,部分研究尝试将小剂量或短疗程地塞米松应用于中重度烧伤患者,获得了较好的预后效果[2]。但目前,尚无甲基泼尼松龙在该领域的报道。2013年1月~2016年6月,我们对老年大面积烧伤患者采用乌司他丁联合甲基泼尼松龙治疗,观察对患者血清降钙素原(PCT)、IL-6及血小板生成素(TPO)的影响,为临床提供参考。现报告如下。
1 资料与方法
1.1 临床资料 选择我院收治的烧伤患者124例,男90例、女34例,年龄62~83(67.23±7.02)岁。烧伤至入院时间(5.82±4.81)h。烧伤部位包括头面颈部13例、躯干前后18例、双上肢26例、双下肢61例、会阴6例。烧伤程度包括浅度46例、中度32例、深度27例、重度19例。烧伤面积(67.61±14.58)%。烧伤类型包括热液伤33例、火焰伤85例、电热伤6例,伴有吸入伤86例。休克轻度72例、中度32例、重度20例。纳入标准:①年龄>60岁;②烧伤总面积>50%或三度烧伤面积>30%;③预期生存期10 d以上者;④对本研究知情同意。排除标准:①合并严重心、脑、肝、肺、肾及血液、内分泌、自身免疫系统严重疾病及肿瘤;②烧伤前1月内有手术、感染、骨折病史等;③烧伤至入院时间>48 h;④临床资料不全。依据随机数字法分为3组,分别为乌司他丁组41例、甲基泼尼松龙组39例和乌司他丁联合甲基泼尼松龙组(联合组)44例。各组性别、年龄、烧伤至入院时间、烧伤面积、烧伤类型比例、吸入伤比例、休克程度比较差异均无统计学意义(P均>0.05)。
1.2 治疗方法 各组患者均给予彻底清创,常规抗休克、抗感染、营养支持治疗,维持水、电解质及酸碱平衡,伤后3~5 d进行皮肤移植。乌司他丁组在常规治疗的基础上给予注射用乌司他丁100 kU/次,1次/8 h,加入100 mL生理盐水静脉输注。甲基泼尼松龙组在常规治疗的基础上,给予注射用甲基泼尼松龙40 mg/次,1次/8 h,加入100 mL 5%葡萄糖中静脉输注。联合组在常规治疗的基础上给予乌司他丁和甲基泼尼松龙,两药用法分别同乌司他丁组和甲基泼尼松龙组。3组均连续治疗11 d。
1.3 血清PCT、IL-6及TPO水平检测 治疗前及治疗第1、3、7、11天时,抽取各组患者清晨空腹静脉血5 mL,离心取上清。采用快速半定量法(PCT-Q)检测血清PCT水平,试剂盒由浙江爱康生物科技有限公司生产;采用酶联免疫吸附法检测血清IL-6水平,试剂盒由北京晶美生物技术有限公司生产;采用酶联免疫双夹心抗体法检测血清TPO水平,试剂盒由上海纪宁实业有限公司生产。
1.4 多脏器功能障碍综合征(MODS)、死亡、脓毒血症发生情况观察 对各组患者进行为期半年的随访,观察半年内MODS、病死率、脓毒血症发生情况。MODS诊断标准:两个或两个以上器官出现序贯性功能衰竭。脓毒血症诊断标准为符合以下中的两项指标:体温<36 ℃或>38 ℃;心率>90次/min;白细胞计数<4×109/L或>12×109/L,或不成熟中性粒细胞>10%;PCO2<4.25 kPa或呼吸>20次/min。
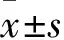
2 结果
2.1 各组血清PCT水平比较 各组治疗后血清PCT水平与治疗前比较差异无统计学意义,各组治疗后同时点血清PCT水平比较差异无统计学意义(P均>0.05)。见表1。
2.2 各组血清IL-6水平比较 各组治疗前血清IL-6水平差异无统计学意义(P>0.05)。治疗第1、3、7、11天时,乌司他丁组与甲基泼尼松龙组血清IL-6水平差异均无统计学意义(P均>0.05),联合组血清IL-6水平均低于乌司他丁组、甲基泼尼松龙组(P均<0.05)。见表1。
2.3 各组血清TPO水平比较 治疗后第3、7、11天时,联合组血清TPO水平均低于乌司他丁组,治疗第7、11天时联合组血清TPO水平均低于甲基泼尼松龙组(P均<0.05)。见表1。
2.4 各组MODS发生率、脓毒血症发生率、病死率及平均住院时间比较 乌司他丁组发生MODS 4例、脓毒血症7例、死亡4例,甲基泼尼松龙组分别为5、8、6例,联合组分别为2、6、3例。三组MODS发生率、脓毒血症发生率、病死率差异无统计学意义(P均>0.05)。
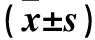
表1 各组不同时点血清IL-6、PCT、TPO水平比较
注:与乌司他丁组比较,△P<0.05;与甲基泼尼松龙组比较,▲P<0.05。
3 讨论
大面积烧伤主要指烧伤面积在50%以上,或者三度以上烧伤面积超过30%。在烧伤修复后,患者的创面会有瘢痕逐渐形成,以至于关节发生挛缩僵硬,导致相关功能逐渐丧失,再加之创面过程中距离疼痛感会在很大程度上降低患者生活质量。除此之外,由于老年患者机体功能逐渐衰退,会严重影响患者心理承受力。而大面积烧伤后疼痛、组织损伤、体液急速丢失都会导致应激反应和炎症反应,当它们保持在一定水平时属于机体对创伤的正常反应,有助于创伤恢复[4]。但当它们剧烈而失控时,除可直接损伤组织外,还会发生炎症级联反应形成“炎症瀑布”,影响细胞正常功能,造成组织缺氧、水肿及代谢障碍,加重组织损伤、坏死,甚至损伤各脏器功能[5](如肺衰竭、心衰竭、肾衰竭),严重者可致死。此外,剧烈的炎症反应还可激活凝血机制,导致血小板黏附、聚集[6],甚至导致弥漫性血管内凝血(DIC)而危及患者生命。IL-6、PCT、TPO是与大面积烧伤后炎症反应十分密切的实验室指标。
乌司他丁作为典型的蛋白酶抑制剂,能广谱阻碍各种蛋白水解酶活性,同时乌司他丁分子还具备和细胞膜受体结合、识别的位点,能对溶酶体膜和细胞膜的生理功能做出有效反应,阻碍溶酶体酶释放,降低氧自由基生成,阻碍超氧化物的产生和炎症介质的释放,从中缓解应激状态下机体组织细胞的自我伤害和消化,能缓解休克的进一步发展,阻碍休克的恶性循环。甲基泼尼松龙作为人工合成的糖皮质激素类药,具有较强的抗炎效果,能有效抑制免疫反应,有效改善神经传导功能,缓解炎性反应。乌司他丁联合甲基泼尼松龙治疗能有效缓解大面积烧伤患者炎症反应,改善患者预后。本研究发现,各组MODS发生率、脓毒血症发生率、病死率差异无统计学意义,提示乌司他丁和甲基泼尼松均能有效改善患者预后。
IL-6是反映机体炎症反应存在及其程度的敏感指标,其属于促炎性细胞因子,与炎症反应程度正相关[3]。本研究结果显示,治疗后联合组血清IL-6水平均低于乌司他丁组、甲基泼尼松龙组,提示乌司他丁与甲基泼尼松龙联用可以更好地降低血清IL-6水平、减轻炎症反应。
PCT是反映机体细菌感染及其感染程度的敏感性指标,当存在细菌感染时快速、大幅上升,而无细菌感染时变化不明显[8]。大面积烧伤后皮肤屏障受损、应激反应和炎症反应造成免疫功能障碍均会导致机体抗细菌侵袭、定植能力显著下降而继发细菌感染[9]。细菌感染可直接受损组织,也可诱发应激反应、炎症反应加剧而导致免疫功能进一步受到抑制,容易导致感染失控形成脓毒血症,细菌随血液在机体各处定植或细菌毒素大量释放,是导致感染性休克、DIC以及MODS的主要危险因素[10],危及患者生命。研究显示,大面积烧伤患者如无明显继发性细菌感染,则PCT水平同健康人群,而当发生细菌感染时其水平呈数倍至数十倍的快速增加,且其增加水平同感染程度呈正相关[11]。本研究结果显示,各组PCT水平在治疗后各时间段无明显差异,提示在合理给药的情况下甲基泼尼松龙单独应用以及与乌司他丁联合应用均不增加继发细菌感染的风险,联合应用是安全的。
TPO是关系机体创伤后机体自我保护、修复及血小板生成、激活的敏感指标。机体创伤后存在多种自我保护机制,TPO水平升高后的生物效应被认为是其中一种,例如急性脑梗死、缺血缺氧性脑损伤、缺血再灌注后以及烧伤后TPO水平的增加[12~14],且这种增加被认为与应激反应和炎症因子(IL-6即被认为可刺激TPO水平升高)的刺激有关,而与当时血小板计数是否处于低水平并无明显关系[15]。现有研究[16]认为,TPO增加的保护作用表现为三个方面:①对机体的直接保护作用,主要在心肌、神经系统以及呼吸系统等;②动员骨髓干细胞参与创伤组织的修复与再生,如骨髓成纤维细胞的生长、结缔组织的生成等;③刺激血小板生成并将其激活,参与凝血止血以及创伤部位血管新生、合成胶原等。但对大面积烧伤患者而言,TPO水平并非越高越好,研究认为,高水平TPO是大面积烧伤1周左右血小板数量急剧增加的住院因素,此时TPO刺激血小板增活化则易形成微小血栓导致微循环障碍,影响创伤部位及各脏器供血供氧以及其他代谢活动,直接影响创伤部位的修复过程,甚至加重病情,可能参与了MODS的发生[17]。可见大面积烧伤时调控TPO处于“合理水平”亦十分重要。本研究结果显示,治疗第3、7、11天时,联合组血清TPO水平均低于乌司他丁组,治疗第7、11天时联合组血清TPO水平均低于甲基泼尼松龙组,提示联合治疗能有效修复患者机体功能,促使患者血小板的形成,缓解患者病情。
综上所述,乌司他丁联合甲基泼尼松龙治疗老年大面积烧伤可明显抑制患者炎症反应,有利于组织修复,优于单用乌司他丁或甲基泼尼松龙。
:
[1] 孙勇,王良喜,周宜芳,等.谷氨酰胺联合乌司他丁对严重烧伤患者炎症反应的影响[J].中华烧伤杂志,2013,29(4):349-354.
[2]王国才,程秀萍.短程大剂量地塞米松辅助治疗对重度烧伤合并急性呼吸窘迫综合征心肺功能的影响[J].中国药业,2013,22(22):32-33.
[3] Beffa DC, Fischman AJ, Fagan SP, et al. Simvastatin treatment improves survival in a murine model of burn sepsis:role of interleukin 6[J]. Burns, 2011,37(2):222-226.
[4] Chen MM, Bird MD, Zahs A, et al. Pulmonary inflammation after ethanol exposure and burn injury is attenuated in the absence of IL-6[J]. Alcohol, 2013,47(3):223-229.
[5] Sakimoto T, Sugaya S, Ishimori A, et al. Anti-inflammatory effect of IL-6 receptor blockade in corneal alkali burn[J].Experim Eye Res, 2012,97(1):98-104.
[6] Kim HS, Kim JH, Yim H, et al. Changes in the levels of interleukins 6,8,and 10, tumor necrosis factor alpha,and granulocyte-colony stimulating factor in Korean burn patients: relation to burn size and postburn time[J]. Ann Lab Med, 2012,32(5):339-344.
[7] Palumbo AA, Forte GI, Pileri D, et al. Analysis of IL-6,IL-10 and IL-17 genetic polymorphisms as risk factors for sepsis development in burned patients[J]. Burns, 2012,38(2):208-213.
[8] Lavrentieva A, Papadopoulou S, Kioumis J, et al. PCT as a diagnostic and prognostic tool in burn patients. Whether time course has a role in monitoring sepsis treatment[J]. Burns, 2012,38(3):356-363.
[9] Mann EA, Wood GL, Wade CE. Use of procalcitonin for the detection of sepsis in the critically ill burn patient:a systematic review of the literature[J]. Burns, 2011,37(4):549-558.
[10] Lavrentieva A, Kontakiotis T, Bitzani M. Enteral nutrition intolerance in critically ill septic burn patients[J].J Burn Care Res, 2014,35(4):313-318.
[11] 黄建宏,林心,欧兴义,等.血浆降钙素原对严重烧伤患者并发感染的预测价值研究[J].中国全科医学,2005,8(8):618-619.
[12] 郑艳辉,叶华光,李伟,等.依达拉奉对大面积急性脑梗死患者血清AGEs、Aβ、TPO、FFA、HSP70及脑血流的影响[J].海南医学院学报,2014,20(6):753-756.
[13] Zhou J, Li J, Rosenbaum DM, et al. Thrombopoietin protects the brain and improves sensorimotor functions:reduction of stroke-induced MMP-9 upregulation and blood-brain barrier injury[J]. J Cerebral Blood Flow Met,2011,31(3):924-933.
[14] Wentz J, Oldson D, Stricklin D. Modeling the thrombopoietic effects of burn[J]. Letter Biomathem, 2014,1(1):111-126.
[15] Salam E, Hehirli A, Lzdamar EN, et al. Captopril protects against burn-induced cardiopulmonary injury in rats[J]. Ulus Travma Acil Cerrahi Derg, 2014,20(3):151-160.
[16] 彭强,邓超干,陈家林,等.急性创伤病人血小板生成素水平改变及其对成纤维细胞体外生长的影响[J].中国急救医学,2006,26(4):266-268.
[17] 郑德义,赵桂香,程代薇,等.烧伤患者血清TPO变化及其临床意义[J].贵州医药,2012,36(6):486-488.

