Cx32和p-AKT蛋白在胃癌组织中的表达变化及其临床意义
程玉,薛晶,次云哲
(承德医学院,河北承德067000)
胃癌在所有常见癌症中发病率排名第4,且病死率排名第2[1],阐明其发生、发展的分子机制并有效指导临床治疗显得尤为急迫。近年来,信号传导异常改变成为胃癌发病机制的研究热点。相邻细胞间进行直接信息交流的惟一通道为细胞间隙连接,间隙连接蛋白32(Cx32)是构成胃黏膜间隙连接通道主要的结构和功能蛋白[2]。磷酸化蛋白激酶B(p-AKT)能调控许多与细胞代谢、凋亡、增殖和分化有关的蛋白,从而抑制细胞的凋亡,并促进肿瘤细胞的生长[3]。但是,这种细胞间信号传导与细胞内信号通路的相互影响,国内外研究很少。本研究拟通过检测正常胃黏膜与胃癌组织中Cx32与p-AKT的表达差异,探讨二者的相互关系,为阐述胃癌的发生、发展机制提供新思路。
1 资料与方法
1.1 临床资料 收集承德医学院附属医院2012年7月~ 2014年2月收治的胃癌初诊患者60例,男45例、女15例,中位年龄56岁;肿瘤组织高、中分化24例,低分化26例;TNM分期:Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期32例;侵犯浆膜48例,淋巴结转移35例;术前均未行放、化疗。患者均行胃癌切除术,均经术后病理学检查证实为胃腺癌,相应癌旁组织均未见累及,另取30例正常胃黏膜(据癌灶边缘10 cm以上)作为对照。所有标本离体后分为两份,一份离体后立即置于液氮中保存(用于Western blotting检测),另一份置于10%甲醛溶液中固定(用于免疫组化检测)。
1.2 Cx32与p-AKT检测方法
1.2.1 免疫组化Elivision法 将取材后的标本常规石蜡包埋,脱蜡脱水,连续4 μm切片。严格按照说明书步骤进行实验操作,最后封片观察。同时设立阴性及阳性对照。Cx32与p-AKT阳性染色细胞均呈棕黄色,用IPP图像分析软件分析免疫组化图片。选取图片上阳性染色的区域(AOI),测定该区域的光密度(OD)值;选取并测量有效统计区域的面积,计算选择区域内的光密度平均值(IOD),计算同一类型标本切片各照片的平均值及标准差。
1.2.2 Western blotting法 称取适量组织(50~100 mg)并剪碎,加入约600 μL RIPA蛋白裂解液和5 μL PMSF蛋白保护液,BCA法测定蛋白浓度。灌制5%的浓缩胶和12%的分离胶,每泳道加总蛋白量80 μg进行电泳分离;在稳流状态低温下,将蛋白转至聚乙烯二氟(PVDF)膜上。常温封闭3 h,分别加入兔抗人Cx32(Bioword Technology公司)及p-AKT(Abcom公司)单克隆抗体(1∶10 000稀释)和小鼠抗人β-actin单克隆抗体(1∶1 000稀释),4 ℃孵育过夜。TBST洗膜后加入HRP标记的山羊抗兔二抗(1∶10 000稀释)和HRP标记的山羊抗鼠二抗(1∶3 000稀释),室温孵育1 h,洗膜、显影、定影。Cx32及p-AKT的相对表达量用Cx32/β-actin和p-AKT/β-actin灰度值表示,灰度采用IPP图像分析软件分析。
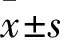
2 结果
2.1 免疫组化检测结果
2.1.1 Cx32和p-AKT在正常胃黏膜及胃癌组织中的表达及二者的相关性 Cx32在正常胃黏膜组织中阳性表达蛋白主要定位于细胞膜,而在癌组织中主要表达于细胞质。p-AKT阳性染色主要定位于细胞质。与正常胃黏膜组织比较,胃癌组织中Cx32表达降低、p-AKT表达增高(P均<0.05),且二者的表达呈负相关(r=-0.297,P<0.05 )。见表1。
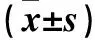
表1 胃癌组织与正常胃黏膜组织中Cx32和p-AKT免疫组化检测结果
2.1.2 Cx32和p-AKT表达与胃癌临床病理参数的关系 见表2。
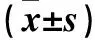
表2 Cx32和p-AKT表达(免疫组化)与胃癌临床病理参数的关系
2.2 Western blotting检测结果
2.2.1 Cx32和 p-AKT在正常胃黏膜及胃癌组织中的表达及二者的相关性 与正常胃黏膜组织比较,胃癌组织中Cx32表达降低、p-AKT表达增高(P均<0.05),且二者的表达呈负相关(r=-0.431,P<0.05 )。见表3。
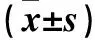
表3 胃癌组织与正常胃黏膜组织中Cx32和p-AKT的Western blotting检测结果
2.2.2 Cx32和p-AKT表达与胃癌临床病理参数的关系 见表4。
3 讨论
由间隙连接蛋白β1基因编码的Cx32,大量表达于哺乳动物的胃黏膜上皮;成熟黏膜内的Cx32似乎能形成生物学的关键路径,可增强细胞间电或者是新陈代谢的合作功能[4]。新近有研究[5,6]发现,Cx32参与了宫颈癌细胞的抗凋亡作用及肝癌细胞的上皮-间质转化过程。本研究结果显示,Cx32在正常胃黏膜组织中阳性表达蛋白主要定位于细胞膜,而在癌组织中表达下调,且主要表达于细胞质,细胞膜极少表达,从而间接证实了细胞癌变过程中存在间隙连接通讯功能障碍。本研究还发现,高、中分化胃癌组织中Cx32表达均高于低分化胃癌组织,TNM Ⅰ~Ⅱ期胃癌组织Cx32表达高于Ⅲ~Ⅳ期,有淋巴结转移的胃癌组织中Cx32表达低于无淋巴结转移者。所以我们推测,Cx32可能参与了胃癌的发生,并影响了胃癌的生物学行为。Cx32 表达水平下降和间隙连接细胞间通讯功能异常,可能参与了胃癌恶性程度的进展和肿瘤细胞的侵袭转移。
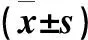
表4 Cx32和p-AKT表达(Western blotting)与胃癌临床病理参数的关系
AKT信号传导通路能通过促进肿瘤细胞的增殖、抑制细胞凋亡、促进血管形成、增强肿瘤细胞侵袭力等,促进肿瘤演进过程[7]。p-AKT可促进不同肿瘤细胞的浸润和转移能力。例如:p-AKT通过增强基质金属蛋白酶2活性,从而促进小鼠乳腺癌上皮细胞的浸润[8];鳞状细胞癌中,活化的p-AKT能促进上皮-间质转化[9]。本研究发现,p-AKT在胃癌中的表达明显高于正常胃组织,其表达与胃癌患者的性别、年龄无关,随着胃癌分化程度的降低而增高,随着胃癌TNM分期的增高而增高,且侵犯浆膜及有淋巴结转移者表达增高。这些现象提示,p-AKT在胃癌组织中表达增高,其高表达可能与胃癌发生、发展及浸润、转移有关系。
本研究还发现,胃癌组织Cx32的表达降低而p-AKT表达增高,并且Cx32与p-AKT的表达呈负相关。这种现象可能是通过p-AKT自身磷酸化或者是通过对多种信号传导分子的激活,从而启动Cx32的磷酸化,最终破坏了细胞间隙连接通讯,细胞之间相互控制能力减弱,细胞能够过分地克隆、生长[10]。Zhao等[11]研究发现,Cx32可通过p53及AKT信号通路调控肝癌细胞的转移和增殖。但是,Cx32能否通过AKT信号通路影响胃癌的生物学功能,国内外尚未见报道。
总之,本研究发现Cx32和p-AKT的表达与胃癌的发生、发展相关,二者在胃癌中的表达呈负相关,推测二者在胃癌生物学行为中可能具有相互抑制作用。但是本研究样本量较少,并且只是停留在组织层面。本课题组将进一步进行细胞及动物试验,更深层次地探讨二者在胃癌发生发展过程中的相互关系,为胃癌发病机制的研究提供新思路。
:
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistic, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Jee H, Lee SH, Park JW, et al. Connexin32 inhibits gastric carcinogenesis through cell cycle arrest and altered expression of p21Cip1 and p27Kip1[J]. BMB Reports, 2013,46(1):25-30.
[3] Carmona FJ, Montemurro F, Kannan S, et al. P-AKT signaling in ERBB2-amplified breast cancer[J]. Pharmacol Ther, 2016,158(2):63-70.
[4] Liu XM, Xu CX, Zhang LF, et al. PBX1 attributes as a determinant of connexin 32 downregulation in Helicobacter pylori-related gastriccarcinogenesis[J]. World J Gastroenterol, 2017,23(29):5345-5355.
[5] Zhao Y, Lai Y, Ge H, et al. Non-junctional Cx32 mediates anti-apoptotic and pro-tumor effects via epidermal growth factor receptor in human cervical cancer cells[J]. Cell Death Dis, 2017,8(5):e2773.
[6] Yang Y, Zhang N, Zhu J, et al. Downregulated connexin32 promotes EMT through the Wnt/β-catenin pathway by targeting Snail expression in hepatocellular carcinoma[J]. Int J Oncol, 2017,50(6):1977-1988.
[7] Zinda MJ, Johnson MA, Paul JD, et al. P-AKT-1,-2,and-3 are expressed in bothnormaland tumor tissues of the lung, breast, prostate, and colon[J]. Clin Cancer Res, 2001,7(8):2475-2479.
[8] Grille SJ, Bellacosa A, Upson J, et al. The protein kinase p-AKT induces epithelial mesenchymal transition and promotes enhanced motility and invasiveness of squamous cell carcinoma lines[J]. Cancer Res, 2003,63(9): 2172-2178.
[9] Solan JL, Lampe PD. Connexin43 phosphorylation: structural changes and biological effects[J]. Biochem J, 2009,419:261-272.
[10] Zhang A. Connexin43 expression is associated with increased malignancy in prostate cancer cell lines and functions to promote migration[J]. Oncotarget, 2015,6(13):11640-11651.
[11] Zhao B, Zhao W, Wang Y, et al. Connexin32 regulates hepatoma cell metastasis and proliferation via the p53 and Akt pathways[J]. Oncotarget, 2015,6(12):10116-10133.

