核苷类似物拉米夫定与恩替卡韦对大鼠慢加急性肝衰竭的影响
顾宇峰,谭晓慧,朱雪娟,汤伟,张彬,汪晓莺,朱轶晴
(1南通大学附属医院,江苏南通226001;2南通大学医学院)
慢加急性肝衰竭(ACLF)是指在慢性肝病基础上,短期内发生急性或亚急性肝功能失代偿的临床症候群[1,2]。近年研究发现,在ACLF的免疫病理机制中,肿瘤坏死因子α(TNF-α)和白细胞介素17(IL-17)等炎性因子可能发挥了较为重要的作用。一项1 977例肝衰竭研究证明,ACLF仍是我国肝衰竭中最常见的类型,其中HBV相关ACLF约占90.29%[3]。目前,ACLF仍以内科综合治疗为主,必要时辅以人工肝支持或行肝移植术。自2006年版《肝衰竭诊疗指南》提出:对HBV-DNA阳性的肝衰竭患者,在知情同意的基础上可尽早酌情使用核苷类似物如拉米夫定、阿德福韦酯、恩替卡韦等[4]。近年来,核苷类似物拉米夫定、恩替卡韦被广泛用于HBV相关ACLF的治疗,并取得较好的效果[5~10]。然而,在临床上,我们时有遇到一些HBV相关ACLF患者,在加用恩替卡韦或拉米夫定治疗后,病情不仅未能得到良好控制反而进一步加重的情况,其原因尚未明确。2013年3月~2014年3月,我们构建大鼠ACLF模型,观察核苷类似物恩替卡韦和拉米夫定对ACLF的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠40只,雄性,体质量180~200 g,由南通大学实验动物中心提供。生产许可证号:SC×K(苏)2008-0010;使用许可证号:SC×K(苏)2007-0021。
1.1.2 药物与试剂 拉米夫定(葛兰素史克制药有限公司,批号12090858),每日临用前以灭菌生理盐水配制成浓度为21 mg/mL的溶液。恩替卡韦(中美上海施贵宝制药有限公司,批号1210668),每日临用前以灭菌生理盐水配制成浓度为0.105 mg/mL的溶液。四氯化碳(CCl4,上海润捷化学试剂有限公司,批号20110601),将其与橄榄油(上海嘉里食品有限公司)按体积比混合配制成40% CCl4溶液。细菌脂多糖(LPS)购自美国Sigma公司,批号L4516;D-氨基半乳糖(D-Gal)购自美国Sigma公司,批号G0500;猪血清购自广州蕊特生物科技有限公司,批号111220。IL-17、TNF-α ELISA试剂盒均购自美国eBiosience公司,批号分别为69595004、69816030;HE染色试剂盒购自德国默克公司,批号G1120。
1.2 实验方法
1.2.1 实验动物分组 将40只SD大鼠先随机分为两组,其中对照组8只、实验组32只。待实验组慢性肝损伤模型建成后,将其再随机分为模型组8只、拉米夫定组12只、恩替卡韦组12只。
1.2.2 大鼠ACLF模型制备 参照谭晓慧等[11]的方法,除对照组外,实验组均腹腔注射40% CCl41 mL/kg(2次/周)及猪血清0.5 mL(1次/周),持续4周,以诱导慢性肝损伤;对照组腹腔注射相同体积生理盐水。慢性肝损伤模型建成后,实验组大鼠均给予D-Gal 0.3 g/kg及LPS 30 μg/kg腹腔内注射1次,以诱导ACLF;对照组腹腔注射相同体积的生理盐水。
1.2.3 药物干预 于联合注射D-Gal及LPS 6 h后,拉米夫定组及恩替卡韦组大鼠分别给予拉米夫定10 mg/kg(相当于成人60 kg体质量服用100 mg)或恩替卡韦 0.05 mg/kg(相当于成人60 kg体质量服用0.5 mg)灌胃,1次/d,连续3 d;对照组及模型组大鼠给予相同体积生理盐水灌胃,1次/d,连续3 d。
1.2.4 肝功能和血清TNF-α、IL-17检测 分别于慢性肝损伤造模4周和诱导ACLF后24、72 h各采血1次,采血前24 h禁食不禁水。大鼠眼球后眦静脉丛取血,静置30 min后以3 000 r/min离心20 min,分离血清,立刻检测肝功能指标(ALT、AST、TBIL)。末次血清分为2份,分别检测肝功能指标和TNF-α、IL-17。血清TNF-α、IL-17检测采用双抗体夹心ELISA法,按试剂盒说明操作。以标准品测试后求得回归方程分别为y(TNF-α)=647.11x2+1 487.61x-71.838、y(IL-17)=-65.862x2+179.85x-5.984 6,将各血清标本的OD值代入此回归方程计算出其相应浓度。
1.2.5 肝组织病理检查 于腹腔注射D-Gal+LPS 72 h(末次取血)后,处死各组动物。取相同部位肝脏组织约1 cm×1 cm,置于10%甲醛溶液中固定24 h;常规石蜡包埋,以切片机切成4 μm切片。采用HE染色和Masson染色,光学显微镜下观察并拍摄照片。
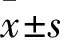
2 结果
2.1 各组大鼠一般情况 对照组大鼠活动正常,反应灵敏,毛发有光泽,饮食、大小便均正常,体质量持续增加,无死亡现象。实验组大鼠随着CCl4及猪血清给药时间的延长,活动逐渐减少,精神萎靡,毛发疏松无光泽,进食量减少,常排不成形大便,体质量增长缓慢。在给予D-Gal、LPS急性攻击后24~48 h内,拉米夫定组死亡2只,模型组及恩替卡韦组无动物死亡。
2.2 各组大鼠慢性肝损伤时的肝功能指标比较 CCl4及猪血清注射4周后,实验组及其他各干预组血清AST、ALT、TBIL均高于对照组(P均<0.05),而模型组、拉米夫定组、恩替卡韦组3组间血清AST、ALT、TBIL水平差异无统计学意义(P均>0.05)。见表1。
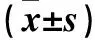
表1 慢性肝损伤造模4周时各组大鼠肝功能指标比较
注:与对照组比较,*P<0.05。
2.3 各组大鼠诱导ACLF后24、72 h肝功能指标比较 在诱导ACLF后24 h,拉米夫定组中8只(67%)、恩替卡韦组中7只(58%)大鼠血清AST、ALT、TBIL均超过模型组均值。拉米夫定组和恩替卡韦组血清AST、ALT、TBIL均高于模型组(P均<0.05),拉米夫定组血清AST、ALT、TBIL均高于恩替卡韦组,但差异无统计学意义。在诱导ACLF后72 h,模型组、拉米夫定组、恩替卡韦组血清AST、ALT、TBIL较24 h时均下降(P均<0.01);但拉米夫定组血清ALT、TBIL均仍高于模型组(P均<0.05),拉米夫定组血清AST虽高于模型组但差异无统计学意义;恩替卡韦组血清AST、ALT、TBIL虽均高于模型组但差异均无统计学意义,其血清AST、ALT、TBIL虽均低于拉米夫定组但差异无统计学意义。见表2。
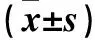
表2 诱导ACLF后24、72 h各组大鼠肝功能指标比较
注:与对照组同时点比较,*P<0.05,#P<0.01;与模型组同时点比较,△P<0.05,▲P<0.01;与同组诱导ACLF后24 h比较,○P<0.01。
2.4 各组大鼠诱导ACLF后72 h血清TNF-α和IL-17水平比较 诱导ACLF后72 h,模型组、拉米夫定组、恩替卡韦组大鼠血清TNF-α、IL-17均高于对照组,但此两种因子水平在四组大鼠间的差异均无统计学意义(FTNF-α=1.131,P=0.357;FIL-17=0.608,P=0.617)。见表3。

表3 诱导ACLF后72 h各组大鼠血清TNF-α和IL-17水平比较
2.5 各组大鼠肝脏病理检查情况 ①HE染色:正常组可见肝小叶结构完整,肝细胞形态正常、排列有序,呈条索状围绕中央静脉,汇管区无炎细胞浸润,胆小管细胞无肿胀。模型组可见肝小叶结构破坏,假小叶形成,肝细胞排列紊乱,空泡化,肝细胞局灶性坏死,肝窦扩张,汇管区有炎细胞浸润。 拉米夫定组、恩替卡韦组所见与模型组大致相仿,但肝细胞局灶性坏死较模型组多见,且可看到片状坏死;拉米夫定组较恩替卡韦组重。②Masson染色:正常组血管周围偶见少量细短蓝色纤维。模型组、拉米夫定组和恩替卡韦组肝脏组织中纤维明显增多,可见相互连接形成的纤维间隔。
3 讨论
HBV相关ACLF是慢性乙型肝炎或乙肝肝硬化患者因某种原因诱发严重急性肝损伤而导致的急性或亚急性肝衰竭,其病情演变过程如其他原因所致的肝衰竭一样可分为重症倾向期、上升期、平台期和恢复期[12,13]。HBV相关ACLF的发病机制不仅与体内的HBV复制状况有关,更与机体免疫系统对HBV的清除有关。体内的HBV载量升高或基因变异可诱发机体强烈的免疫清除,使大量HBV感染的肝细胞损伤,这往往只是ACLF的始动因素[14,15];而HBV免疫清除过程中产生的炎症反应,则可能是引起肝组织进一步大量损伤,乃至肝衰竭发生的关键原因。
在本研究中,我们以CCl4联合猪血清诱导大鼠产生慢性肝损伤,再给予D-Gal、LPS联合攻击以诱导ACLF,并对拉米夫定组和恩替卡韦组大鼠在联合攻击后分别按成人剂量给予拉米夫定或恩替卡韦灌胃。在实验过程中,我们观察到给予D-Gal、LPS联合攻击24 h后,各处理组大鼠肝功能指标均较攻击前大幅度升高,且拉米夫定组和恩替卡韦组肝功能损伤较未服用核苷类似物的模型组更高,但恩替卡韦组肝功能指标低于拉米夫定组;联合攻击24~48 h,拉米夫定组中有2只死亡;联合攻击72 h后,模型组、拉米夫定组和恩替卡韦组肝功能指标均较攻击24 h时下降,但拉米夫定组和恩替卡韦组仍明显高于模型组。这一结果提示,在ACLF发生的急性发作期或肝功能指标上升期,给予核苷类似物拉米夫定或恩替卡韦服用,均有可能加重肝组织损伤,且以拉米夫定稍重;但当病程进入平台期后,继续服用此两种核苷类似物则对肝组织损伤的修复无明显影响。
临床观察发现,多数发生肝脏重度炎症或重型肝炎患者血清TNF-α水平增高[16,17]。实验研究表明,TNF-α不仅能介导内毒素或LPS对肝细胞的损伤,而且对肝细胞具有直接的损伤作用。肝脏发生炎症病变时,肝组织Kupffer细胞内核转录因子κB被激活,诱导包括TNF-α在内的多种炎症因子表达,TNF-α可直接诱导肝实质细胞凋亡、坏死,其表达水平与炎症病变程度呈正相关;而且,对实验动物给予抗 TNF受体1中和抗体,可以明显减轻肝损伤[18~20]。
IL-17是近年来新发现的一种具有促炎症作用的细胞因子,主要由Th17细胞产生,其受体(IL-17R)在体内广泛表达尤其是在粒细胞、单核-吞噬细胞系统;当IL-17与IL-17R结合后可激活细胞,导致趋化因子、集落刺激因子和黏附分子的表达或释放,招募和激活炎症细胞尤其是嗜中性粒细胞,介导或加强炎症反应,从而促进病原体的清除和自身免疫病理损害[21]。有实验研究报告,予以IL-17中和抗体可以明显降低自身免疫性肝炎模型小鼠血清ALT水平,且肝组织炎症病变减轻[22]。在临床上观察到,慢性乙型肝炎发作时,血清IL-17水平与ALT、TBIL、凝血酶原时间呈正相关,HBV相关ACLF患者血清IL-17水平高于失代偿性乙肝肝硬化患者;HBV相关ACLF患者Th17细胞及血清IL-17水平升高,且血清IL-17水平与终末肝病模型(MELD)评分呈正相关,预后不佳者血清IL-17水平高于预后好转者[23~25]。这些研究结果提示,在ACLF的发病机制中,炎症反应是导致肝组织严重损伤和肝功能衰竭的关键原因。
为了解核苷类似物加重肝损伤的机制,我们检测了诱导ACLF后72 h各组动物的血清TNF-α及IL-17水平。结果显示,拉米夫定组和恩替卡韦组血清TNF-α、IL-17水平高于模型组,但3组间差异并不具有统计学意义。对此结果,可作两方面分析:其一,检测标本留取时间太迟(给予D-Gal和LPS急性攻击后72 h),实验动物的肝损伤已较急性攻击后24 h明显改善,但此时两个核苷类似物治疗组血清TNF-α、IL-17水平尤其是拉米夫定组TNF-α水平仍较高,提示核苷类似物可能加重了D-Gal和LPS急性攻击后产生的炎症反应。其二,与本实验动物样本数量较少有关。
张鹤等[26]对53例HBV相关ACLF患者血清HBV-DNA载量变化与疾病预后之间的关系进行了回顾分析,认为发病前及治疗初期单一时间点HBV-DNA与预后关系不大;HBV-DNA升高或降低>2 log在存活组所占比率明显低于死亡组,HBV-DNA维持不变或变化<2 log存活组则明显高于死亡组,统计学分析表明上述改变模式在2组间的差异有统计学意义。此结果提示,在HBV相关ACLF发病初期,对HBV强烈的免疫清除很可能伴随较为剧烈的肝脏炎症损伤甚至预后不佳。结合本研究结果,我们认为对慢性乙型肝炎严重发作或HBV相关ACLF发病初期、病情迅速进展的患者,应首先给予抗炎保肝治疗以期尽快抑制或减轻肝脏的炎症病变,1周左右后再加用核苷类似物抑制HBV复制、减轻后继对HBV免疫清除而引起的肝损伤,如此或许更有利于患者的康复。
:
[1] Lee WM, Stravitz RT, Larson AM. Introduction to the revised American association for the study of liver diseases position paper on acute liver failure 2011[J]. Hepatology,2012,55(3):965-967.
[2] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2012年版)[J].中华肝脏病杂志,2013,2l(3):177-183.
[3] 刘晓燕,胡瑾华,王慧芬,等.1 977例急性、亚急性、慢加急性肝衰竭患者的病因与转归分析[J].中华肝脏病杂志,2008,16(10):772-775.
[4] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南[J].中华内科杂志,2006,45(12):1053-1056.
[5] 高莉,石小枫.乙型肝炎相关慢加急性肝衰竭抗病毒治疗的研究进展[J].重庆医学,2016,45(7):980-982.
[6] Chen CH, Lin CL, Hu TH, et al. Entecavir vs. lamivudine in chronic hepatitis B patients with severe acute exacerbation and hepatic decompensation[J]. J Hepatol,2014,60(6):127-134.
[7] 丁艾昆,郭利伟,董格峰.拉米夫定与恩替卡韦治疗乙肝病毒相关的慢加急性肝衰竭近期疗效比较[J].山东医药,2015,55(18):77-78.
[8] 黄明寿,陈郁梅,陈穗.核苷类似物抗病毒治疗对乙型慢加急性肝衰竭患者短期生存率的影响[J].中国社区医师,2011,13(12):41-42.
[9] 陈至明,杨文龙,熊墨龙,等.乙型肝炎相关慢加急性肝衰竭抗病毒治疗118例临床观察[J].临床合理用药,2015,8(6):11-13.
[10] 陈立,郑彩霞,林明华.早期的病毒学应答对乙型肝炎相关慢加急性肝衰竭抗病毒治疗转归的影响[J].中华肝脏病杂志,2011,19(10):734-737.
[11] 谭晓慧,薛璐瑜,周跃,等.大鼠慢加急性肝功能衰竭模型的制备[J].肝脏,2013,18(12):820-822.
[12] Zheng YB, Huang ZL, Wu ZB, et al. Dynamic changes of clinical features that predict the prognosis of acute-on-chronic hepatitis B liver failure:a retrospective cohort study[J]. Int J Med Sci,2013,10(12):1658-1664.
[13] 黄湛镰,高志良.肝衰竭的三重打击及治疗策略[J].内科急危重症杂志,2014,20(3):154-156.
[14] Xu Z, Ren X, Liu Y, et al. Association of hepatitis B virus mutations in basal core promoter and precore regions with severity of liver disease: an investigation of 793 Chinese patients with mild and severe chronic hepatitis B and acute-on-chronic liver failure[J]. J Gastroenterol,2011,46(3):391-400.
[15] Yang L, Ma S, Hu X, et al. Presence of valine at position 27 of the hepatitis B virus core gene is associated with severe liver inflammation in Chinese patients[J]. J Med Virol,2011,83(2):218-224.
[16] 韩利岩,郭朝阳,范玉琛,等.慢加急性肝衰竭患者外周血肿瘤坏死因子α基因启动子甲基化状态的研究[J].中华实验和临床病毒学杂志,2011,25(5):368-370.
[17] 杜思霖,章幼奕.肝衰竭患者血清TNF-α检测的临床意义[J].现代医药卫生,2010,26(4):522-523.
[18] Lacuna L, Mari M. Reactive oxygen species mediate liver injury through parenchymal nuclear factor-κB inactivation in prolonged ischemia/ reperfusion[J]. Am J Pathol,2009,174(5):1776-1785.
[19] 甄真,宋慧娟,李武军,等. NF-κB和TNF-α暴发性肝衰竭肝组织中的表达及其意义[J].中国组织化学与细胞化学杂志,2008,17(1): 45-49.
[20] 周清平,谢玉桃,谭德明.TNF-TNFR1与急性肝衰竭小鼠肝损伤的关系[J].胃肠病学和肝病学杂志,2007,16(6):552-554.
[21] Kolls JK, Linden A. Interleukin-17 family members and inflammation [J]. Immunity,2004,21(4):467-472.
[22] 余海静,黄加权,刘阳.白介素-17在自身免疫性肝炎中的作用及其机制研究[J].中西医结合肝病杂志,2014,24(1): 47-49.
[23] 孙强,汤伟,汪晓莺.慢性乙型肝炎患者外周血Th17细胞的表达及临床意义[J].重庆医学,2012,41(7):658-660.
[24] 邹关银, 章幼奕,周辉娟,等.血清Th17、IL-17与HBV相关性慢加亚急性、慢性肝衰竭的相关性[J].江苏医药,2013,39(13):1520-1524.
[25] 张耿林,谢冬英,林炳亮,等.乙肝相关慢加急性肝衰竭患者Th17细胞水平及其临床意义[J].热带医学杂志,2011,11(5):573-576.
[26] 张鹤,杨玲,曾文铤,等.慢加急性肝衰竭患者 HBV-DNA变化模式与其预后的关系[J].中外医疗,2012,31(13):22-23.

