宫颈癌患者人乳头状瘤病毒感染与阴道细菌感染的相关性*
郭冰杰 杨彩梅
(北京中医医院顺义医院妇产科,北京 101300)
宫颈癌是女性最常见的恶性肿瘤之一,在女性中的发病率仅低于乳腺癌,严重威胁着广大妇女的生命[1-2]。流行病学调查显示全世界每年宫颈癌新发病例约有 50万人,我国示每年新发宫颈癌14万病例左右[3]。人乳头状瘤病毒(human papilloma virus,HPV)是乳多空病毒科乳头瘤病毒属,具双链闭环DNA基因组,其长度为7200~8000bp,为无包膜的小分子(55nm)DNA肿瘤病毒[4-5]。HPV感染是宫颈癌发生的主要原因,其中高危型HVP主要为HPV16、18、31、33、35、39、45、51、52,不过多数HPV感染都是暂时的,只有少部分HPV感染发生可发展为宫颈癌前病变或宫颈癌,也表明还有因素的参与协同促进宫颈癌发生发展[6-8]。宫颈癌患者多合并有阴道感染,使得阴道分泌物有特殊腥臭气味,影响患者的身心健康[9]。特别是条件致病菌便会在阴道内大量繁殖,可改变阴道的微环境,继而诱发出现阴道的菌群紊乱,不过是否有增加HPV感染与宫颈致癌的风险还不得而知[10-11]。本文将宫颈癌患者及同期慢性宫颈炎患者的阴道分泌物细菌培养结果及HPV感染情况进行回顾性分析,了解宫颈癌患者中HPV感染和阴道细菌感染的情况,分析其可能的协同作用。现报告如下。
1 资料与方法
1.1 研究对象 2014年2月~2017年1月选择在我院诊治的宫颈癌患者150例作为观察组,同期选择非宫颈癌的慢性宫颈炎患者150例作为对照组。纳入标准:研究得到医院伦理委员会的批准;已婚,均有性生活史;年龄20~90岁;观察组与对照组均经病理检查证实诊断明确;没有合并其他恶性肿瘤的患者。排除标准:曾经放疗或行新辅助化疗后的患者;无性生活史的患者;合并有其他妇科及系统的恶性肿瘤患者;既往被诊断过宫颈病变,并接受治疗的患者。两组的年龄、孕次、产次、体重指数等对比无明显差异(P>0.05),见表1。

表1 两组患者一般资料对比Table 1 The general data of two groups
1.2 方法
1.2.1 标本采集 ①阴道分泌物培养采集:在月经结束后第5~7d,采用碘伏常规消毒外阴后,暴露子宫颈部,用无菌长柄棉签采集阴道内中上1/3 内侧壁粘膜,取出标本后置于无菌试管中,送检验科细菌室进行细菌培养鉴定分析。②宫颈HPV采集方法:暴露宫颈部,选择专用小刷子置于子宫颈口与粘膜交界处,顺时针旋转 5 圈,停留 10 s,取出后将小刷子置于无菌试管中,送检验科细菌室进行宫颈HPV分析。
1.2.2 检测方法 ①细菌分离培养与鉴定:将细菌标本接种于麦康凯培养平板、巧克力平板、血琼脂平板等,标本接种后培养 18-24h,观察菌落形态,采用全自动微生物鉴定仪 VITEK2 compact进行鉴定。②HPV-DNA检测:采用美国高危HPV-DNA检测试剂盒进行检测,其为一种非放射性相对快速而且能同时检测13种高危亚型HPV方法,检测结果 RLU/CO>1.0pg/ml为HPV阳性,HPV 阴性为检测结果 RLU/CO<1.0pg/ml。
1.3 统计学分析 将所有资料数据输入 Microsoft Excel 工作表中,应用SPSS20.00软件进行分析,计数数据采用百分比、率表示,计量数据选择均数±标准差表示,对比方法为t检验与卡方分析,相关性分析采用直线相关分析,检验水准ɑ=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 阴道细菌感染情况对比 观察组中检出阴道细菌78例,检出率为52.0%,其中革兰阴性菌60例,革兰阳性菌18例,具体病原菌分布及构成比(见表2)。对照组中检出阴道细菌70例,检出率为46.7%,其中革兰阴性菌55例,革兰阳性菌15例,具体病原菌分布及构成比(见表3)。两组阴道细菌感染检出率对比差异无统计学意义(2=0.087,P>0.05)。

表2 78例宫颈癌患者阴道分泌物的病原菌分布及构成比Table 2 Distribution and proportion of pathogens in vaginal secretions of cervical cancer patients

表3 70例宫颈炎患者阴道分泌物的检出分布及构成比Table 3 Detection distribution and ratio of vaginal secretions in patients with cervicitis
2.2 HPV-DNA检测结果比较 观察组中检出HPV-DNA感染90例,阳性率60.0%;对照组中检出HPV-DNA感染40例,阳性率26.7%,观察组的HPV-DNA阳性率明显高于对照组(P<0.05),见表4。
表4两组患者HPV-DNA检测结果比较
Table4ComparisonofHPV-DNAbetweenthetwogroups

组别nHPV-DNA阳性HPV-DNA阳性率(×10-2)观察组1509060.0对照组1504026.724.781P<0.05
2.3 HPV感染与阴道细菌感染的相关性 在观察组中,HPV-DNA感染状态与阴道细菌感染的结果差别无统计学意义(2=0.872,P>0.05),见表5。
表5150例宫颈癌患者HPV感染与阴道细菌感染的相关性
Table5CorrelationbetweenHPVinfectionandvaginalbacterialinfectionincervicalcancerpatients
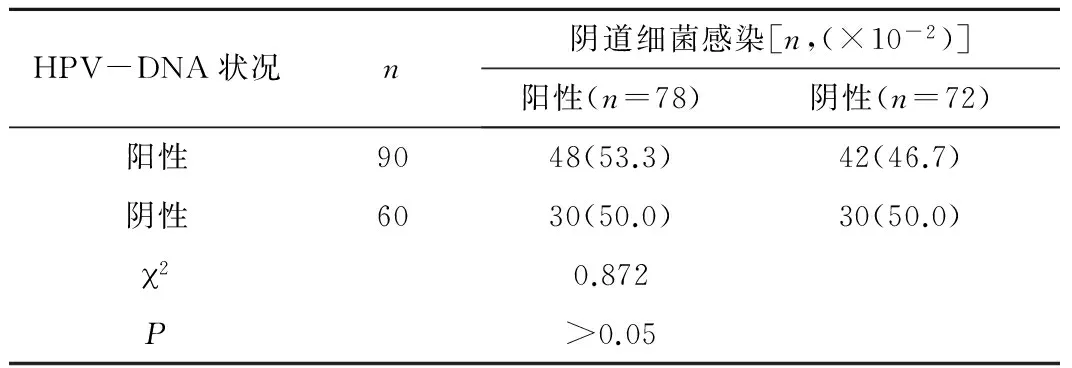
HPV-DNA状况n阴道细菌感染[n,(×10-2)]阳性(n=78)阴性(n=72)阳性9048(53.3)42(46.7)阴性6030(50.0)30(50.0)20.872P>0.05
注:直线相关分析宫颈癌患者HPV感染与阴道细菌感染无明显相关性(r=0.092,P>0.05)。
3 讨论
宫颈癌在女性生殖系统中比较常见,虽然当前其发病率与死亡率有所下降,但是依然是当前女性最主要的恶性肿瘤之一[12]。我国是宫颈癌的高发国家 之一,特别是在城市的宫颈癌发病率和死亡率远超过全国平均水平。宫颈癌发病的危险因素包括生物学因素、行为危险因素、遗传易感性等,生物学因素主要为细菌、病毒和衣原体等各种微生物的感染等[13,14]。
HPV的持续感染是宫颈癌发生的主要原因,HPV基因可分为早期区(E区),晚期区(L区)及非编码区(LCR);在所有已知HPV亚型中,约90-95%的HPV阳性肿瘤为高危[15,16]。为此通过检测HPV来筛查宫颈感染易感人群,是预防宫颈癌发生的关键[17]。本研究显示观察组中检出HPV-DNA感染90例,阳性率60.0%;对照组中检出HPV-DNA感染40例,阳性率26.7%,观察组的HPV-DNA阳性率明显高于对照组(P<0.05),也表明宫颈癌患者伴随有HPV-DNA高阳性状况。
健康女性生殖道内寄居着多种正常的微生物群落,可与机体、 环境之间构成了相互协调、制约、动态的微生态平衡体系。正常情况下在阴道菌群中,最主要的是以阳性乳酸杆菌为优势菌群的微生态系统[18]。阳性乳酸菌有利于维持阴道酸性环境,可对自身宿主起占位性保护作用,而使外袭菌无法立足;阳性乳酸菌对宿主体液免疫和机体免疫有一定的影响,有利于防御外袭菌的侵入[19]。当因各种原因破坏生殖道微生态系统的菌群动态平衡时,可使得乳酸杆菌的减少或者造成生殖道菌群菌株的变化,从而导致宫颈疾病的发生[20]。本研究显示观察组中检出阴道细菌78例,检出率为52.0%,其中革兰阴性菌60例,革兰阳性菌18例;对照组中检出阴道细菌70例,检出率为46.7%,其中革兰阴性菌55例,革兰阳性菌15例,两组阴道细菌感染检出率对比差异无统计学意义(2=0.087,P<0.05)。也表明宫颈癌患者阴道分泌物致病菌检出率较高,病原菌菌株多,革兰阴性菌相对较多。从机制上分析,宫颈癌患者由于临床症状表现为长期的不规则阴道流血,可造成免疫功能低下,导致阴道细菌感染[21,22]。
炎症触发癌症这一观点一直是医学界的焦点, 除了 HPV-DNA病毒之外,阴道细菌感染是否是其协同因素之一值得探讨[23]。特别是女性感染 HPV大多呈隐性感染,宫颈感染可发生在宫颈癌发生前及发展的早期阶段,但是是否有宫颈癌的诱发因素还不明确。研究发现宫颈癌和癌前病变中宫颈局部细胞因子存在明显变化,局部炎症在宫颈癌发生过程中存在一定作用。合并阴道细菌感染者发生宫颈癌风险增加的机制还有局部炎症可能导致局部组织化生,在肿瘤发生发展过程中发挥重要作用[24]。也有研究合并生殖道感染的患者宫颈癌发病风险显著增加,可能增加HPV感染机会和HPV病毒载量[25]。
本研究显示在观察组中,HPV-DNA感染状态与阴道细菌感染的结果差别无统计学意义(2=0.872,P>0.05),直线相关分析宫颈癌患者HPV感染与阴道细菌感染无明显相关性(r=0.092,P>0.05)。表明阴道细菌感染尚不足以作为HPV的协同因子促进宫颈癌的发生,将在下一步进行更系统和广泛的调查研究,以进一步确定生殖道中细菌感染在HPV导致的宫颈癌中的作用。
4 结论
本文资料显示,宫颈癌患者的HPV阳性率高于宫颈炎患者,且阴道分泌物中致病菌检出率较高,革兰阴性菌检出率居首位。阴道细菌感染与HPV感染协同因素促进宫颈癌的发生还有待进一步研究。
【参考文献】
[1]Kone ES, Balili AD, Paparisto PD,etal. Vaginal Infections of Albanian women Infected with HPV and their impact in intraepithelial cervical lesions evidenced by Pap test[J].J Cytol,2017,34(1):16-21.
[2]Rakhmatulina MR, Bolshenko NV. Interferon in combined therapy of human papillomavirus infections associated with sexually transmitted infections linical observation[J].Urologiia,2016,21(5):103-108.
[3]Shannon B, Yi TJ, Perusini S,etal. Association of HPV infection and clearance with cervicovaginal immunology and the vaginal microbiota[J].Mucosal Immunol,2017,10(25):114-119.
[4]关晓梅,王谨言,王艳华.阴道微生态与高危型人乳头瘤病毒感染和宫颈病变的关系研究[J].中国微生态学杂志,2017,29(3):347-350.
[5]Menon S, van den Broeck D, Rossi R,etal. Multiple HPV infections in female sex workers in Western Kenya: implications for prophylactic vaccines within this sub population[J].Infect Agent Cancer,2017,6(12):2-9.
[6]de Waure C, Quaranta G, Ianuale C,etal. Knowledge, attitudes and behaviors of the Italian population towards Neisseria meningitidis, Streptococcus pneumoniae and HPV diseases and vaccinations: A cross-sectional multicentre study[J].Public Health,2016,12(141):136-142.
[7]Menon S, Broeck DV, Rossi R,etal. Associations Between Vaginal Infections and Potential High-risk and High-risk Human Papillomavirus Genotypes in Female Sex Workers in Western Kenya[J].Clin Ther,2016,38(12):2567-2577.
[8]Tan ZH, Zhang Y, Tian Y,etal. IκB kinase b Mediating the Downregulation of p53 and p21 by Lipopolysaccharide in Human Papillomavirus 16(+) Cervical Cancer Cells[J].Chin Med J (Engl),2016,129(22):2703-2707.
[9]Esber A, Rao N, Norris A,etal. Intravaginal Practices and Prevalence of Sexual and Reproductive Tract Infections Among Women in Rural Malawi[J].Sex Transm Dis,2016,43(12):750-755.
[10] Mitra A, MacIntyre DA, Marchesi JR,etal. The vaginal microbiota, human papillomavirus infection and cervical intraepithelial neoplasia: what do we know and where are we going next[J].Microbiome,2016,4(1):58-63.
[11] Van Dyke AL, Kemp TJ, Corbel AF,etal. Lipopolysaccharide-pathway proteins are associated with gallbladder cancer among adults in Shanghai, China with mediation by systemic inflammation[J].Ann Epidemiol,2016,26(10):704-709.
[12] Zhang T, Liu H, Chen X,etal. Lipidated L2 epitope repeats fused with a single-chain antibody fragment targeting human FcγRI elicited cross-neutralizing antibodies against a broad spectrum of human papillomavirus types[J].Vaccine,2016,34(46):5531-5539.
[13] 刘雯,于瑞梅,刘晓丹,等.7857例育龄期妇女宫颈液基薄层细胞学检测结果分析[J].山东医药,2016,56(19):53-54,55.
[14] Pandolfi R, Barreira B, Moreno E,etal. Role of acid sphingomyelinase and IL-6 as mediators of endotoxin-induced pulmonary vascular dysfunction[J].Thorax,2017,72(5):460-471.
[15] 朱丽红,张宁,江滟,等. Real-time PCR分析滴虫性阴道炎患者微生物组成的变化[J]. 中国微生态学杂志,2017,29(2):207-210.
[16] Sherchand SP, Ibana JA, Zea AH,etal. The High-Risk Human Papillomavirus E6 Oncogene Exacerbates the Negative Effect of Tryptophan Starvation on the Development of Chlamydia trachomatis[J].PLoS One,2016,11(9):7789-7793.
[17] Melo A, Lagos N, Montenegro S,etal. Human papilloma virus and Chlamydia trachomatis by number of sexual partners and time of sexual activity on university students in the Region of La Araucanía, Chile[J].Rev Chilena Infectol,2016,33(3):287-292.
[18] 侯友翔,潘静,古丽娜·库尔班.宫颈癌合并生殖道感染的主要致病菌与耐药性[J].中南大学学报(医学版),2016,41(7):721-728.
[19] Remis RS, Liu J, Loutfy MR,etal. Prevalence of Sexually Transmitted Viral and Bacterial Infections in HIV-Positive and HIV-Negative Men Who Have Sex with Men in Toronto[J].PLoS One,2016,11(7):896-902.
[20] McCord J, Prewitt M, Dyakova E,etal. Reduction in Clostridium difficile infection associated with the introduction of hydrogen peroxide vapour automated room disinfection[J].J Hosp Infect,2016,94(2):185-187.
[21] 宋末兰.女性阴道细菌感染与宫颈癌前病变的关系研究[J].实用预防医学,2014,21(5):589-590.
[22] Hanson L, VandeVusse L, Jermé M,etal. Probiotics for Treatment and Prevention of Urogenital Infections in Women: A Systematic Review[J].J Midwifery Womens Health,2016,61(3):339-355.
[23] 肖金银,张文璎,金皖玲,等.5952例孕妇宫颈细胞学筛查结果分析[J].中国生育健康杂志,2015,21(5):455-457.
[24] Diana A. Review of the 2016 Swiss immunization schedule and technology update for improving vaccine management[J].Rev Med Suisse,2016,12(518):949-953.
[25] Chen Y, Liu Y, Zhang G,etal. Human papillomavirus L1 protein expressed in Escherichia coli self-assembles into virus-like particles that are highly immunogenic[J].Virus Res,2016,15(220):97-103.

