米槁对水分胁迫的生理响应
熊 雪,刘济明,文爱华,柳嘉佳,邓明明,李 佳
(贵州大学 林学院, 贵州 贵阳 550025)
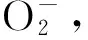
米槁(CinnamomummigaoH.W.Li)是一种贵州地道苗药,其药用价值、工业价值颇高,近年来广受民众喜爱.但米槁还未有成型人工林系统,目前主要的资源获取途径仍为野外采集,加之米槁结实有大、小年之分,产量十分不稳定,市场上对米槁的需求常年处于紧绷状态.米槁主要分布于我国西南地区,该区域干旱面积广、分布不均匀,植物种类区化大[13],所以,研究干旱胁迫对米槁幼苗生长及生理生化的影响具有重要的现实意义.关于米槁的研究起步较晚,且主要集中在成分、地理区划、栽培技术与病虫害防治等方面,近两年才涉及其生存环境及生理生化方面.笔者采用不同水分控制处理米槁幼苗,对其叶片相对含水量、渗透物质积累量、质膜透性及保护酶活性进行相关性实验,初步探索米槁幼苗生长的最适水分条件,以期为米槁培育过程中的环境选择提供一定的参考.
1 材料与方法
1.1 供试材料
笔者于2015年3月从贵州省罗甸县逢亭镇逢亭村米槁育苗基地采集一批长势一致的米槁幼苗(120 d).苗木移栽前,于贵州大学南校区苗圃,先用烘干法测定供试土壤的田间持水量以及土壤含水量,结果分别为29.8%和12.30%.移栽幼苗时控制花盆中土壤重量(10.00 kg),每盆2株.于2015年6月1日,选取长势良好、较为一致的米槁盆栽幼苗移入隔绝降水的透明大棚,作为实验材料.
1.2 实验设计
根据预实验,在自然光照下设计3个土壤水分梯度:对照水分(CK),土壤相对含水量(80 ± 5)%;中度干旱(MD),土壤相对含水量(60 ± 5)%;重度干旱(SD),土壤相对含水量(35 ± 5)%.每个处理6盆,每盆2株,共处理120 d,每隔20 d测量1次数据,每2次作为1个时期,共前、中、后3个时期,期间不施肥并随时拔除杂草.
1.3 测定指标和测量方法
在实验的每个时期,各处理分别选取3~5片成熟叶片,立即带回实验室参照邹琦[14]所用方法测定叶片相对含水量(relative water conten,简称RWC).可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[14],可溶性糖含量采用蒽酮比色法测定[14],游离脯氨酸(FAA)含量采用酸性茚三酮显色法测定[15].电导率采用电导法,用DDS-11A型电导率仪进行测定[15].丙二醛(MDA)含量采用TBA显色法进行测定[16].超氧化物歧化酶(SOD)活性用NBT光还原法测定[14];过氧化氢酶(CAT)活性采用H2O2还原法测定[14];过氧化物酶(POD)活性采用愈创木酚氧化法测定[15].
1.4 数据分析
采用SPSS 19.0及Excel 2007软件对所得数据进行处理与分析.
2 结果与分析
2.1 干旱胁迫对米槁幼苗叶片相对含水量的影响
干旱胁迫对米槁幼苗叶片RWC的影响结果列于表1.
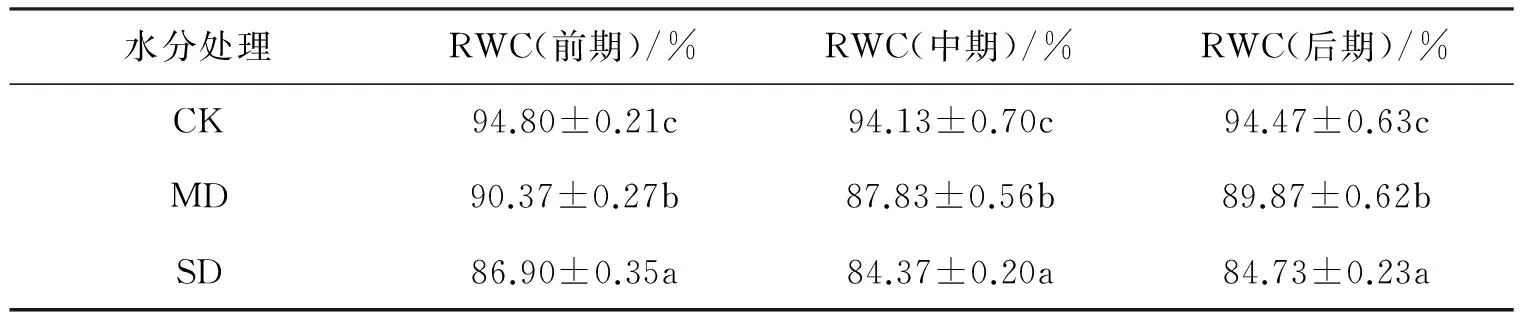
表1 干旱胁迫对米槁幼苗叶片RWC的影响
注:同一列不同字母间表示差异显著(p<0.05).
表1显示,自然光照下,随着土壤含水量的降低,米槁叶片相对含水量(RWC)呈现下降趋势,并差异显著,说明米槁幼苗对干旱胁迫的反应较为敏感.但同一水分处理持续过程中米槁叶片RWC先降低后升高,但差异不明显,最小值均出现在中期.这可能是该时期下光照较强,温度较高,植物蒸腾作用耗水量较大所致.但总体上米槁幼苗RWC均大于80%,植物体并未受到较大伤害,说明米槁对干旱胁迫抵抗力较强.
2.2 干旱胁迫对米槁幼苗叶片渗透物质积累量的影响
干旱胁迫对米槁幼苗叶片渗透物质积累量的影响结果如图1所示.
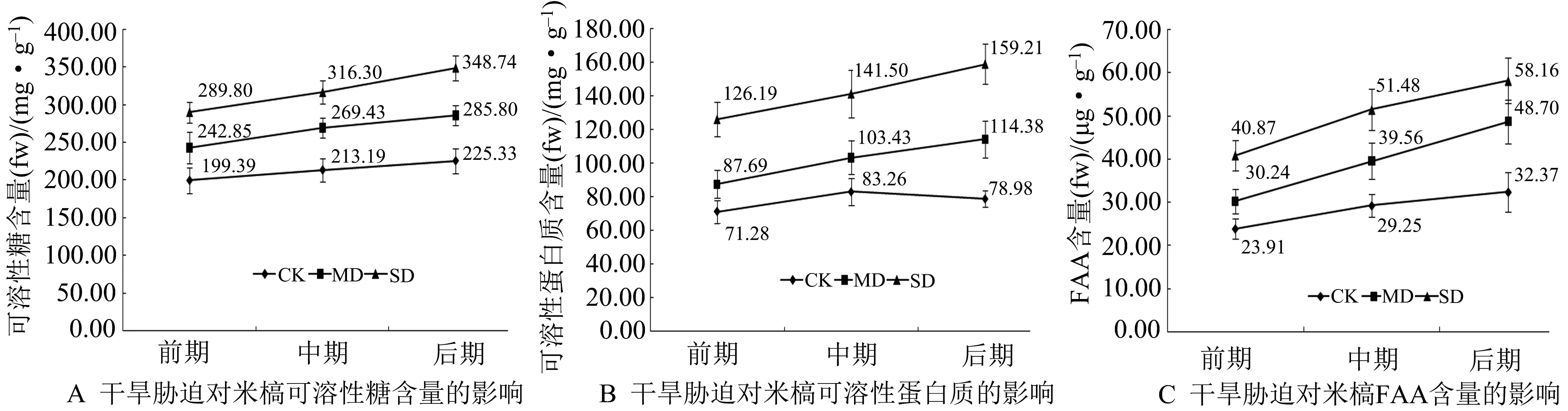
图中数据为平均值±标准误(n=3).图1 干旱胁迫对米槁幼苗叶片渗透物质积累量的影响
由图1可知,随着干旱胁迫的加剧及干旱时间的延长,米槁幼苗可溶性糖含量均逐渐增高.实验前期,各处理间可溶性糖含量差异不明显,但随着胁迫时间的推移,差异逐渐变大,最大值出现在SD处理下的后期,且比MD、CK处理下同时期的可溶性糖含量分别高出22.02%和54.77%,而该时期MD处理下可溶性糖含量比CK处理下的高出26.84%,此时期各处理组互相之间表现出显著差异性.而米槁幼苗可溶性蛋白与可溶性糖含量表现趋势略有不同,虽整体也呈现上升趋势,但在实验中期,CK处理下可溶性蛋白达到最大值,随后便呈现下降趋势,与MD、SD两处理下随着胁迫时间的延长其逐渐升高的趋势不一致,且以SD处理下米槁幼苗可溶性蛋白含量增加最快,较实验前期差异最明显,并分别与CK、MD处理下同时期的可溶性蛋白含量差异显著.此外,米槁幼苗游离脯氨酸(FAA)含量变化同可溶性糖含量变化趋势基本一致,皆随着干旱胁迫的加剧及干旱时间的延长逐渐增加,且MD处理下增长最快,含量逐渐累积,为CK处理下积累量的0.5倍以上,但各处理间差异不明显.CK、MD、SD处理下同时期的FAA含量彼此间具有一定差异.综上所述,干旱胁迫导致米槁幼苗相关可溶性糖、可溶性蛋白、FAA含量不断积累,且在各时期下均表现为:含量SD> 含量MD> 含量CK,说明干旱越剧烈,这3类渗透物质积累量越大,干旱持续时间越长,相应积累量越大.且在CK处理下的各渗透物质,积累速度皆为最慢,尤其可溶性蛋白出现先上升后下降趋势,说明CK处理下水分较为充足,米槁幼苗所受干旱影响较小.
2.3 干旱胁迫对米槁幼苗叶片细胞膜稳定性的影响
干旱胁迫对米槁叶片细胞膜稳定性的影响如图2所示.

图中数据为平均值±标准误(n=3).图2 干旱胁迫对米槁叶片细胞膜稳定性的影响
由图2可知,米槁幼苗叶片电导率及MDA含量均随着土壤含水量的降低及处理时间的延长而升高.实验过程中,MD处理下电导率、MDA含量均略大于CK处理,较小于SD处理,且各时期各处理间差异不明显.但仍可看出,重度干旱SD处理电导率及MDA含量数值远高于MD处理下,这表明干旱胁迫越严重,细胞膜所受影响越大,但总体而言干旱对米槁幼苗叶片细胞膜透性的影响较小,并未对其造成严重伤害,同时也表明米槁幼苗对土壤含水量的适应范围较广.
2.4 干旱胁迫对米槁幼苗叶片抗氧化酶活性影响
干旱胁迫对米槁幼苗叶片抗氧化酶活性的影响如图3所示.
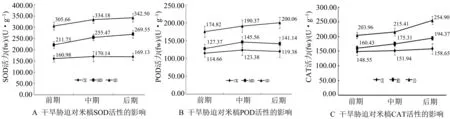
图中数据为平均值±标准误(n=3).图3 干旱胁迫对米槁幼苗叶片抗氧化酶活性的影响
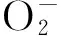
2.5 干旱胁迫下各生理生化指标的相关性分析
干旱胁迫下米槁幼苗叶片RWC与MDA含量及POD、CAT活力变化列于表2.
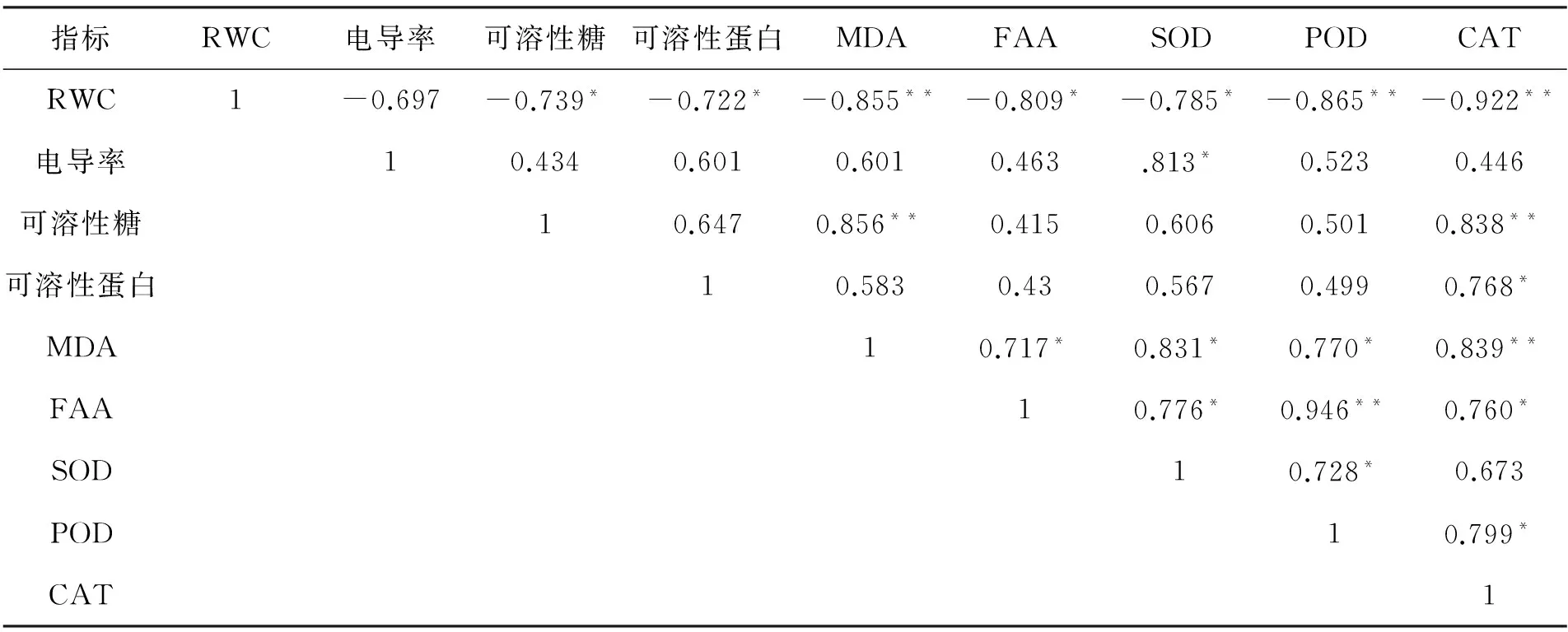
表2 干旱胁迫下米槁各生理生化指标相关性分析
注:*表示在p=0.05 水平下相关性达到显著;**表示在p=0.01 水平下相关性达到显著.
由表2可知,米槁幼苗叶片RWC与MDA含量及POD、CAT活力体现出极显著负相关,与可溶性糖、可溶性蛋白、FAA含量及SOD活力体现出负的显著性相关,而与电导率则体现出负相关性,但不显著.电导率同SOD活力具有正的显著性差异,而与MDA、渗透物质含量及POD、CAT两种保护酶活性正相关,但不显著.可溶性糖与MDA含量、CAT活性呈正的极显著相关,却与可溶性蛋白、FAA含量及SOD、POD活性呈不显著正相关.可溶性蛋白与CAT活性显著正相关,而与MDA、FAA含量及SOD、POD活性呈不显著相关.丙二醛(MDA)含量同FAA含量、SOD、POD活性具有显著正相关性,同CAT极显著正相关.FAA含量与POD活力极显著正相关,同SOD、CAT活性显著正相关.3种保护酶中,POD活力分别同SOD、CAT活力呈现正的显著性相关,SOD活力同CAT活力间具有正相关性,但不显著.
综上分析,干旱胁迫越剧烈,米槁幼苗叶片RWC越小,电导率、MDA、渗透物质含量及保护酶活性越大,机体抵抗干旱反应越强,且电导率变化较小,同各指标间的联系较差.
3 讨 论
经过120 d的水分控制处理,米槁为抵抗干旱胁迫而使体内的生理机制发生了相应变化.随着干旱胁迫时间的延长,叶片相对含水量呈先大幅下降后小幅回升趋势;随着干旱胁迫的加剧,米槁幼苗叶片相对含水量逐渐减小,造成叶片水势的改变,迫使植物从土壤中吸取更多的水分,以缓解水分不足对植株带来的负面影响[17].植物细胞遭受环境胁迫时,RWC变化范围可以从100%到50%或更低[18].而研究发现米槁幼苗RWC均在80%以上,说明干旱胁迫对米槁RWC影响不大,也说明米槁对土壤水分条件的适应范围较广.
干旱的加剧和持久引起膜透性的增加,从而引起米槁幼苗电导率升高.米槁的MDA含量也随水分的减少而逐渐升高,说明干旱条件下细胞膜已受到活性氧攻击,细胞膜脂质过氧化作用增强,但米槁叶片细胞膜仍在正常工作,说明其并未受到实质性伤害.与此同时,米槁体内的渗透调节物质和抗氧化保护酶系统会发生协同作用保持细胞膜进行正常代谢活动.实验期间,米槁叶片渗透物质随干旱胁迫的加剧逐渐升高,说明米槁通过提高自身的渗透势来维持细胞稳定性.这一发现与程小毛和罗翠芹[8]对米槁同属植物香樟的水分胁迫研究所得的渗透物质变化表现出相同的趋势,表明在受到干旱胁迫时,胁迫越严重,渗透物质积累量就越高,植物可用其抵抗干旱.安玉艳等[4]研究证明,抗氧化酶升高可以清除体内的超氧自由基,降低体内活性氧积累,有利于减轻质膜的损伤.笔者的实验中,米槁幼苗叶片抗氧化酶随着干旱胁迫的加剧和胁迫的持续,整体呈现上升趋势,也说明在干旱胁迫影响下米槁幼苗通过清除体内积累的活性氧减轻了细胞质膜所受的伤害,从而产生抵抗机制.总体而言,米槁幼苗表现出较强抗旱性,对水分条件的适应范围较广.
参考文献:
[1] GHADERI N, SIOSEMARDEH A. Response to drought stress of two strawberry cultivate (cv. Kurdistan and Selva) [J]. Horticulture Environment and Biotechnology, 2011, 52 (1): 6-12.
[2] GINDABA J, ROZANOV A, NEGASH L. Response of seedlings of twoEucalyptusand three deciduous tree species from Ethiopia to severe water stress[J]. Forest Ecology and Management, 2004, 201 (1): 119-129.
[3] 蒋理, 丁彦芬, 孟国忠. 水分胁迫下5种地被植物的抗旱生理生化指标变化[J]. 江苏林业科技, 2009, 36 (5): 6-10.
[4] 安玉艳, 梁宗锁, 郝文芳. 杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J]. 生态学报, 2011, 31 (3): 716-725.
[5] 桑子阳, 马履一, 陈发菊. 干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J]. 西北植物学报, 2011, 31 (1): 109-115.
[6] 黎燕琼, 刘兴良, 郑绍伟, 等. 岷江上游干旱河谷四种灌木的抗旱生理动态变化[J]. 生态学报, 2007, 27 (3): 870-878.
[7] YAMASAKI H, UEFUJI H, SAKIHAMA Y. Bleaching of the red anthocyan in induced by superoxide radical[J]. Arch Biochem Biophys, 1996, 332 (1): 183-186.
[8] 程小毛, 罗翠芹. 不同土壤水分处理对香樟幼苗生理特性的影响[J]. 江苏农业科学, 2013, 41 (9): 171-172.
[9] 多立安, 王晶晶, 赵树兰. 垃圾堆肥复合菌剂对干旱胁迫下草坪植物生理生态特性的影响[J]. 生态学报, 2011, 31 (16): 4717-4724.
[10] 孙天国, 沙伟, 刘岩. 复合重金属胁迫对两种藓类植物生理特性的影响[J]. 生态学报, 2010, 30 (9): 2332-2339.
[11] 萧浪涛, 王三根. 植物生理学[M]. 北京: 中国农业出版社, 2004: 334-335.
[12] JONESH G. Plants and micro-climate[M]. 2nd ed. New York: Cambridge University Press, 1992: 163-214.
[13] 刘长成, 刘玉国, 郭柯. 四种不同生活型植物幼苗对喀斯特生境干旱的生理生态适应性[J]. 植物生态学报, 2011, 35 (10): 1070-1082.
[14] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[15] 张立军, 樊金娟. 植物生理学实验教程[M]. 北京: 中国农业大学出版社, 2007.
[16] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社, 2003: 75-125.
[17] 单长卷, 田雪亮. 冬小麦水分生理特性对水分胁迫的响应[J]. 吉林农业科学, 2007, 32 (6): 16-21.
[18] LAWLOR D W, CORNICG. Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J]. Plant Cell Environ, 2002, 25: 275-294.

