贮藏方法对紫花苜蓿种子内生根瘤菌定殖的影响
苗阳阳,周 彤,师尚礼,张运婷,康文娟(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
紫花苜蓿(Medicagosativa)具有适口性好、蛋白质含量高、营养价值全面、利用年限长等特点,是世界范围内种植面积最大、应用最广的牧草[1]。根瘤菌可与其共生形成根瘤,将大气中的无机氮转化为有机氮,从而供给植物营养,形成根瘤。这一共生体系的固氮作用不仅具有巨大的经济和社会效益,同时在改良土壤肥力、提高作物和牧草质量、产量、改善生态环境等方面具有重要意义。因此,在农业生产中,人工接种根瘤菌便成为一种常见的农业措施。但苜蓿结瘤和固氮受多种内在因素(苜蓿品种、根瘤菌种类)和外在因素(接种方法、环境因素、土壤状况)影响,接种的根瘤菌难以高效地进行结瘤固氮,难以达到应有的增产效果[2-3]。因此,筛选出携带目标根瘤菌的苜蓿种子,在生产实践中就可免去接种环节,实现了优良根瘤菌菌株与优良苜蓿品种的精准高效组合,为提高苜蓿良种生产效益奠定基础。
研究表明,根瘤菌可以内生菌的形式广泛存在于玉米、水稻、烟草、苜蓿等多种植物的根、茎、叶、荚果皮和种子内[4-7]。种子内的根瘤菌具有固氮、溶解无机磷和分泌生长素的能力[8]。根瘤菌可通过植物种子传播到土壤中,种子是被子植物重要的繁殖器官,与其共生的根瘤菌是在漫长的自然选择过程中产生的协同进化产物[9]。种子内生根瘤菌在构建共生固氮体系中比土壤中其他根瘤菌具有明显的竞争优势。当种子萌发后胚根首先接触种子内部的根瘤菌即“内生根瘤菌”,然后才接触到“土著根瘤菌”。因此,保证种子内根瘤菌的活性和数量,对根瘤菌高效固氮及各种促生作用的发挥具有重大意义。
紫花苜蓿多采用种子繁殖,种子用量很大。其种子粗脂肪含量高,不饱和脂肪酸的含量相对较低,容易导致种子氧化酸败而不耐贮藏[10]。在种子保存期间,温度是保持活力和生活力的关键因素,要想获得高活力的种子,需要在种子收获、采后处理、保存、包装等各个环节进行严格的质量控制。适宜的温度还可促进种子内微生物的繁殖。温度可直接影响细菌的生理生化代谢途径[11-13],主要是通过影响微生物细胞内生物大分子的活性来影响微生物的生命活动[14]。低温会减缓或停止微生物的代谢过程,温度低于冰点时,可使原生质内的水分结冰,导致细胞死亡[15]。
虽然国内外对温度和贮藏条件对种子活力的影响已有研究,但关于不同温度下不同包装材料对种子内微生物尤其是根瘤菌的影响较少。因此,以不同接种方法收获的含目标根瘤菌的紫花苜蓿种子为试验材料,在不同温度下采用不同的包装条件贮藏,探讨利于保持种子内根瘤菌的活性和增殖的条件,明确不同贮藏方法对种子内根瘤菌定殖数量的影响,从而筛选出最适贮藏条件,为获得含有大量携带有目标根瘤菌的苜蓿种子奠定基础。
1 材料和方法
1.1 试验材料
供试苜蓿种子获得:甘肃农业大学牧草实训基地生长4年的甘农5号紫花苜蓿(Medicagosativacv.Gannong No.5) ,在结荚期以主根轻微损伤浇灌、根部直接浇灌、加入600 mg/mL苦参碱(浓度1.3%)浇灌3种根部接种方法接种两种荧光标记根瘤菌EnsifermelilotiLZgn5f (gn5f)和Ensifermeliloti12531f (12531f),同时根部浇灌无菌蒸馏水获得的种子。室内风干2个月进行贮藏。
1.2 试验方法
1.2.1 含荧光标记根瘤菌种子的贮藏 于2014年11月初进行种子贮藏。采用铝箔纸(种子用双层铝箔纸密封包装)、信封+布袋(种子装于布袋内,外加信封袋)、信封袋3种包装方式,分别在25℃、25℃硅胶干燥、-4℃和4℃下贮藏6个月。
1.2.2 种子内生根瘤菌定殖数量的测定 随机挑选各处理种子25粒,重复4次,置于50 mL无菌三角瓶内,碘伏 (有效碘浓度为2500 mg/L)浸泡3 min,无菌蒸馏水冲洗4次,每次1 min。操作均在无菌操作台内进行。表面消毒后,将最后1次消毒的种子各面在固体培养基平板上放置30 min后取出,将平板28℃条件下培养24~48 h,未长出菌落,表明已彻底消毒[5]。将消毒后的种子置于无菌研钵中,加入2 mL无菌水研磨,吸取0.2 mL研磨至1.8 mL无菌蒸馏水中,制成10- 1稀释液,再吸取该稀释液0.2 mL至1.8 mL无菌蒸馏水中,制成10-2稀释液,按照上述方法依次制成10-3和10-4浓度稀释液,每一浓度梯度3 次重复,离心(4 000 r/min,离心2 min)后分别吸取0.2 mL上清液均匀涂布于含刚果红的YMA固体培养中,28℃培养24~48 h记录每皿中单菌落数量(刚果红YMA培养基中,根瘤菌形态为含有粘质胞外多糖且不吸附色素的白色半透明菌落,形态为平坦凸起或半透明凸起,边缘光滑)[16]。挑取每皿内大小形态一致的具代表性的菌落,编号保存,进行革兰氏染色及形态学镜检[17],初鉴别确定为根瘤菌后根据何庆元等[18]的方法进行保存并回接鉴定。
1.3 数据处理
利用Excel 2007整理数据并作图,采用SPSS16.0软件进行统计和显著性分析。
2 结果与分析
2.1 不同贮藏方法对主根微破损接种gn5f和12531f获得的种子内生根瘤菌定殖数量的影响
主根微破损接种gn5f时获得的种子,信封包装贮藏在-4℃时,内生根瘤菌定殖数量最高,为25.54 cfu/粒,显著高于信封+布袋和铝箔的2种包装材料(P<0.05)。信封+布袋包装贮藏各温度下定殖的数量无显著差异(P>0.05),为1.74~5.34 cfu/粒。铝箔包装时,25℃干燥贮藏条件下定殖数量为13.28 cfu/粒,显著高于其他3种贮藏温度(P>0.05)。
主根微破损接种12531f时获得的种子,铝箔包装贮藏在-4℃时,内生根瘤菌定殖数量最高,为14.98 cfu/粒,但与另外两种包装材料无显著差异(P>0.05),其余3个温度下定殖的根瘤菌数量无显著差异(P>0.05)。以信封包装贮藏时各温度下定殖的数量无显著差异(P>0.05),为0~1.58 cfu/粒。信封+布袋包装时,在4℃干燥贮藏条件下定殖数量为5.48 cfu/粒,显著高于其他3种温度(P>0.05)。
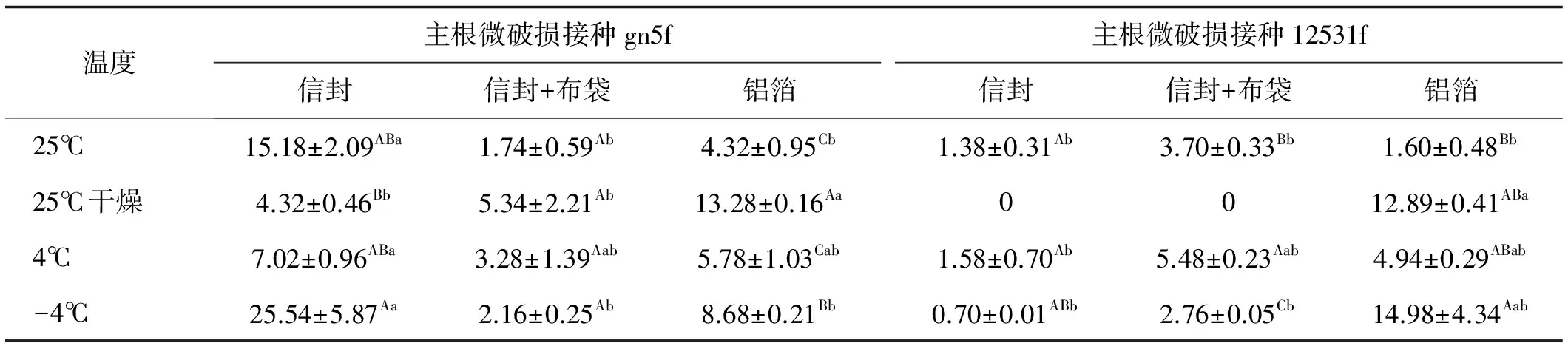
表1 不同贮藏方法处理下主根微破损接种获得的种子内生根瘤菌定殖数量Table 1 Effect of various storage methods on the colonization quantity of endogenous rhizobia in seed inoculated with taproot slightly damaging and drench treatment cfu/粒
注:数据为平均值±标准误,同列不同大写字母表示差异显著(P<0.05),同行不同小写字母表示差异显著(P<0.05),下同
2.2 不同贮藏方法对根部浇灌接种gn5f和12531f获得的种子内生根瘤菌定殖数量
根部浇灌接种gn5f时获得的种子,当以信封包装并贮藏在25℃干燥条件下时内生根瘤菌定殖数量最多,为22.08 cfu/粒,显著高于其他贮藏温度和包装材料(P<0.05)。当以信封+布袋包装贮藏于-4℃时种子内gn5f定殖数量为12.22 cfu/粒,显著高于其他3个温度下定殖的数量(P<0.05)。铝箔包装-4℃贮藏条件下gn5f定殖数量最多,为9.34 cfu/粒,但与在25℃下贮藏无显著差异 (P>0.05)(表2)。
根部浇灌接种12531f获得的种子,以信封+布袋包装并在25℃干燥条件下贮藏时内生根瘤菌定殖数量最多,为40.84 cfu/粒,显著高于其他贮藏温度和包装材料(P<0.05)。以信封和铝箔包装时,25℃干燥贮藏时种子内定殖的12531f数量显著高于其他3个温度(P<0.05),为1.28~19.64 cfu/粒(表2)。
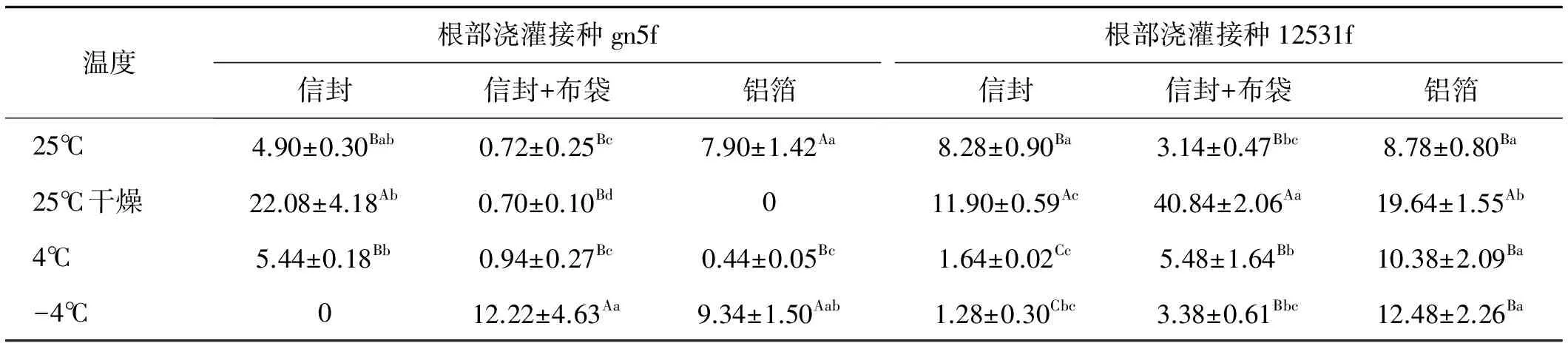
表2 不同贮藏方法处理下根部浇灌接种获得的种子内生根瘤菌定殖数量Table 2 Effect of various storage methods on the colonization quantity of endogenous rhizobia in seed inoculated with root drench treatment
2.3 不同贮藏方法对添加苦参碱根部浇灌接种gn5f和12531f获得的种子内生根瘤菌定殖数量的影响
添加苦参碱根部浇灌接种gn5f时获得的种子,以铝箔包装并贮藏在-4℃时内生根瘤菌定殖数量最多,为25.00 cfu/粒,显著高于其他贮藏温度和包装材料(P<0.05)。以信封包装时,贮藏于25℃干燥条件下时种子内gn5f定殖数量为15.40 cfu/粒,显著高于其他3个贮藏温度(P<0.05)。以信封+布袋包装贮藏于25℃干燥条件下时种子内gn5f定殖数量最多,仅为7.66 cfu/粒,且仅显著高于25℃时的定殖数量(P<0.05)(表3)。
添加苦参碱根部浇灌接种12531f时获得的种子,以铝箔包装贮藏于25℃干燥条件下时内生根瘤菌定殖数量最多,为18.08 cfu/粒,显著高于其他贮藏温度和包装材料(P<0.05)。以信封包装时种子内12531f的定殖数量在各贮藏温度间无显著差异(P>0.05),为0~4.94 cfu/粒。信封+布袋包装,4℃贮藏时种子内定殖的12531f数量显著高于其他3个温度(P<0.05),为5.34 cfu/粒。
2.4 不同贮藏方法对根部浇灌接种无菌蒸馏水获得的种子内生根瘤菌定殖数量的影响
根部浇灌接种无菌蒸馏水获得的种子,以铝箔包装并在25℃贮藏时内生根瘤菌定殖数量达最多,为10.42 cfu/粒,显著高于其他贮藏温度和包装材料(P<0.05),4℃贮藏时定殖数量次之,为6.48 cfu/粒,其余2个温度下定殖的根瘤菌数量无显著差异(P>0.05)。信封和信封+布袋在各处理温度下种子内根瘤菌的定殖数量在1.20~5.32 cfu/粒(表4)。
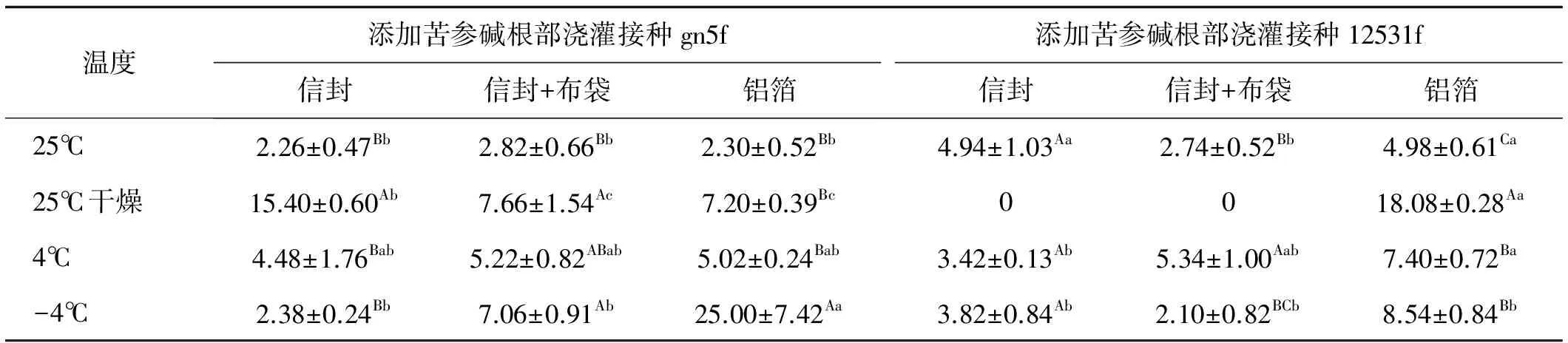
表3 不同贮藏方法处理下添加苦参碱根部浇灌接种获得的种子内生根瘤菌定殖数量Table 3 Effect of various storage methods on the colonization quantity of endogenous rhizobia in seed inoculated with matrine treatment
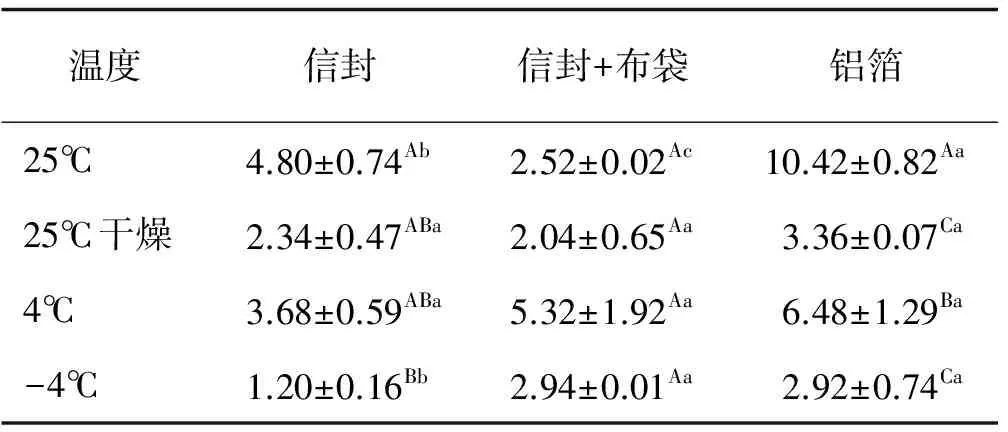
表4 不同贮藏方法处理下无菌蒸馏水根部浇灌接种获得的种子内生根瘤菌定殖数量Table 4 Effect of various storage methods on the colonization quantity of endogenous rhizobia in seed inoculated with sterile distilled water treatment
3 讨论
根瘤菌是一种能与宿主植物互利共生的有益内生细菌,它可通过植物皮层进入木质部导管中,随宿主的生长被运送到植物上部营养器官或繁殖器官中[19]。种子是豆科植物的主要繁殖器官,可进入新的土壤环境,成为下一代新植株内生根瘤菌的重要来源,为豆科植物-根瘤菌共生体系的构建提供了物质基础,可促进次代植株的生长、改善土壤环境。试验发现根瘤菌可通过主根微破损、根部浇灌、添加苦参碱根部浇灌的方法进入到苜蓿种子内,但因接种的目标根瘤菌遗传特性不同,所适宜的接种方法也不同[20]。12531f的原始菌株12531为慢生型根瘤菌,代谢速率慢,而gn5f的原始菌株gn5为快生型根瘤菌,代谢速率快,二者遗传性状差异较大。试验发现不同方法接种根瘤菌后获得的种子,在适宜的包装和温度贮藏条件下,种子内生根瘤菌定殖数量高于接种无菌蒸馏水获得种子的,表明接种目标根瘤后可增加苜蓿种子内生根瘤菌的定殖数量。接种gn5f获得的种子在贮藏时,以信封或是铝箔包装时种子内生根瘤菌定殖数量多于信封+布袋,尤其是主根微破损接种获得的种子在-4℃信封贮藏时内生根瘤菌定殖数量最多;接种12531f获得的种子以信封+布袋或是铝箔包装时种子内生根瘤菌定殖数量多于信封包装,尤其是根部浇灌获得的种子在25℃干燥以信封+布袋贮藏时内生根瘤菌定殖数量最多。
祁娟[2]发现在-20℃处理下,所有供试苜蓿种子内生根瘤菌均不能存活,且在此低温段,其他杂菌数量也很少,说明在-16℃~20℃存在着苜蓿种子内生根瘤菌存活的一个低温临界点,低于此温度临界点,苜蓿种子内生根瘤菌生长受阻。适宜的温度下微生物才能生长繁殖,过高或过低的温度均不利于微生物的生长和增殖,甚至死亡[21]。密封保存对毛竹种子生活力保存具有重要意义,空气相对湿度较高的环境下保存,种子将从空气中吸收水分而导致生活力下降[22]。蔡春菊等[23]同样发现,在4℃保存2年的毛竹种子,双层铝箔袋密封并内置硅胶干燥的塑料盒内保存比牛皮纸袋保存的毛竹种子,更有利于延长种子寿命。
25℃干燥和-4℃贮藏时种子内根瘤菌数量高于25℃和4℃,可能是因为添加硅胶后降低了种子含水量,使一些核酸、酶类的分解代谢和次生产物的积累变缓,此时的种子可为根瘤菌提供一定的养分和良好的生长环境,因此,根瘤菌数量高于相同温度时未干燥的处理。在4℃时种带部分杂菌生长受到抑制,而-4℃时则大部分杂菌的生长受到抑制,但根瘤菌则能正常生长,因此-4℃时种子内生根瘤菌定殖数量多于4℃。3种包装材料中,信封可使种子与外界环境进行充分的氧气接触,进行自由呼吸;信封+布袋可使种子进行适度的呼吸和与外部环境间的水热交换;铝箔则隔离外界水汽和热量的效果较好,从而使种子处于相对干燥环境。但因收获的种子含目标根瘤菌不同,所适宜的包装材料也不同。
4 结论
综合分析,接种gn5f获得的种子在贮藏时,以信封或是铝箔包装时种子内生根瘤菌定殖数量多于信封+布袋,尤其是主根微破损接种获得的种子在-4℃以信封贮藏时内生根瘤菌定殖数量最多;接种12531f获得的种子以信封+布袋或是铝箔包装时种子内生根瘤菌定殖数量多于信封包装,根部浇灌获得的种子在25℃硅胶干燥以信封+布袋贮藏时内生根瘤菌定殖数量最多。但因收获的种子含目标根瘤菌不同,所适宜的包装材料不同。含相同目标根瘤菌的种子以25℃干燥和-4℃贮藏时种子内根瘤菌数量高于25℃和4℃。
参考文献:
[1] 戚志强,玉永雄,胡跃高,等.当前我国苜蓿产业发展的形势与任务[J].草业学报,2008,17(1):107-113.
[2] 祁娟.苜蓿种子内生根瘤菌筛选及其促生能力研究[D].兰州:甘肃农业大学,2006.
[3] Afzal M,Khan S,Iqbal S,etal.Inoculation method affects colonization and activity of Burkholderia phytofirmans PsJN during phytore mediation of diesel-contaminated soil[J].International Biodeterioration & Biodegradation,2013,85:331-336.
[4] Gutierrez-Zmaora M,Martinez-Romero E.Nuatral endophytic association between Rhizobium etli and maize (ZeamaysL.) [J].Journal of Biotechnology,2001,91:117-126.
[5] Chi F,Shen S H,Cheng H P,etal.Ascending migration of endophytic rhizobia,from roots to leaves,inside rice plants and assessment of benefits to rice growth physiology[J].Applied and Environmental Microbiology,2005,71(11):7271-7278.
[6] Ji K X,Chi F,Yang M F,etal.Movement of rhizobia inside tobacco and lifestyle alternation from endophytes to free-living rhizobia on leaves[J].Journal of Microbiology and Biotechnology,2010,20(2):238-244.
[7] 李剑峰,张淑卿,师尚礼,等.苜蓿内生根瘤菌分布部位与数量变化动态[J].中国生态农业学报,2009,17(6):1200-1205.
[8] 祁娟,师尚礼.不同品种紫花苜蓿种子内生根瘤菌溶磷和分泌生长素能力[J].草原与草坪,2006(5):18-20.
[9] 陈利云,周志宇.紫穗槐种子内生根瘤菌数量分布与种类特征[J].干旱地区农业研究,2012(4):231-235.
[10] Lopez Y,Smith O,Senseman S,etal.Genetic factors influencing high oleic acid content in Spanish market- type peanut cultivars [J].Crop Science,2001,41(1):51-56.
[11] Delille D,Perret E.Influence of temperature on the gr-owth potential of southern polar marine acteria [J].Microbiology Ecology,1989,18:117-123.
[12] Rutter M,Nedwell D B.Influence of changing temperature on growth rate and competition between two psychrotolerant Antarctic bacteria:competition and survival in non-steadystate temperature environments [J].Applied and Environmental Microbiology,1994,60(6):1993- 2002.
[13] Knoblauch C,Jirgensen B B.Effect of temperature on sulphate reduction,growth rate and growth yield in five psychrophilic sulphate-reducing bacteria from Arctic sediments [J].Environmental Microbiology,1999,1(5):457-467.
[14] 张淑卿.基于荧光标记的苜蓿根瘤菌侵入植株体内的运移特性及影响因素研究 [D].兰州:甘肃农业大学,2012.
[15] 施邑屏.温度与微生物[J].微生物学通报,1982,22(6):291-294.
[16] 霍平慧.耐抑菌剂根瘤菌筛选及耐药菌株制备菌剂抑杂菌效果研究[D].兰州:甘肃农业大学,2014.
[17] 中华人民共和国农业部.GB-NY 227-1994微生物肥料农业行业标准[S].北京:中国标准出版社,1994:4-9.
[18] 何庆元,玉永雄,胡艳.不同苜蓿2根瘤菌结瘤固氮能力变异的研究[J].中国草地学报,2006,28(4):79-83.
[19] 许建香.芸豆高效根瘤菌的筛选及分子标记[D].北京:中国农业大学,2004.
[20] 苗阳阳,师尚礼,康文娟.赤霉素对根瘤菌转移定殖及苜蓿幼苗生长的影响[J].中国农业科学,2017,50(23):4545-4557
[21] 张玉凤,董经纬,蒋菊生,等.种子贮藏的研究进展[J].安徽农业科学,2007,35(19):5 855-5 856.
[22] 蔡春菊,刘凤,彭镇华,等.贮藏温度和种子含水量对毛竹种子生活力的影响[J].安徽农业大学学报,2009,36(4):607-611.

