高通量测序分析中国沙棘根瘤与根际土壤细菌多样性
张爱梅,韩雪英,孙 坤,张世虎,孔维宝,牛世全,朱学泰 (西北师范大学生命科学学院,甘肃 兰州 730070)
中国沙棘(Hippophaerhamnoidessubsp.sinensis)是一种落叶灌木或乔木,抗逆性极佳,对土壤适应性强,常生于海拔800~3 600 m的砾石,沙质土壤或黄土。我国西北地区大规模种植沙棘,既可进行生态绿化,又可作为经济林树种[1]。沙棘是一种典型的放线菌结瘤植物,沙棘根系发达,能与弗兰克氏菌属(Frankia)形成根瘤进行共生固氮,提高土壤肥力[2-3]。沙棘根际土壤的微生物类群非常丰富,根际土壤中微生物数量及种类的分布也呈现复杂的多样性[4]。根际是植物根系直接影响的土壤范围,生存于植物根际土壤中的微生物,称为根际微生物[5]。根际微生物与植物根系组成一个特殊的生态系统,根际土壤微生物的数量和群落结构及其变化与植物生长发育有着重要的关系,对研究微生物与植物的互利共生,探索生物多样性和生态系统功能有着重要的影响[6-7]。
对沙棘根瘤的研究发现,沙棘根瘤中的微生物主要是放线菌Frankia[8],除此之外还包括一些非Frankia内生菌[9]。对沙棘根际土壤微生物的研究发现,沙棘根际土壤中有丰富的微生物种类[10-11]。因此,通过采用高通量测序技术,研究中国沙棘根瘤内生细菌和根际土壤细菌多样性,并对中国沙棘根瘤内生细菌与根际土壤细菌群落结构进行比较,初步探究中国沙棘根瘤内生细菌与根际土壤细菌之间的关系,为进一步研究中国沙棘根瘤内生细菌的来源提供依据。
1 材料和方法
1.1 样品采集
试验样地位于甘肃省兰州市马衔山,样地信息见表1所示。于2016年9月在采样地选取3株中国沙棘植株,采集沙棘根瘤和沙棘根际土壤,带回实验室保存备用。
1.2 沙棘根瘤内生菌总DNA提取
选取新鲜幼嫩的沙棘根瘤样品,除去沙棘根瘤表面的泥沙等杂质,依次用自来水,蒸馏水和无菌水冲洗。然后用75%乙醇和1%NaClO溶液进行表面消毒,再用无菌水反复冲洗,收集最后一次冲洗的无菌水进行无菌检测[12]。将沙棘根瘤表面消毒后,采用CTAB法提取沙棘根瘤内生菌总DNA,用1%琼脂糖凝胶电泳检测所提取DNA的效果[13-14]。
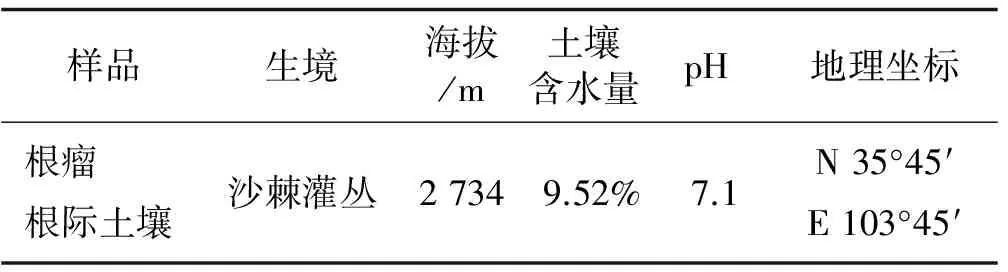
表1 样地基本信息Table 1 The information of sample site
1.3 沙棘根际土壤总DNA提取
1.4 16S rDNA-V4区PCR扩增
沙棘根瘤内生细菌与沙棘根际土壤细菌16S rRNA-V4区的PCR扩增采用带Barcode的特异性引物515F(5′-GTGCCAGCMGCCGCGG-3′)和806R(5′-GCCAATGGACTAHVGGGTWTCTAAT-3′)[15]。PCR扩增采用50 μLPCR扩增体系,扩增反应条件为98℃预变性5min,98℃变性30 s,50℃退火30 s,72℃延伸30 s,25个循环,最后72℃延伸5 min。PCR产物于2%琼脂糖凝胶电泳检测,剩余样品4℃保存备用。
1.5 文库构建和上机测序

1.6 高通量测序数据处理
将测序得到的原始数据截去Barcode和引物序列后进行拼接,拼接得到的序列经过严格的过滤,并去除其中的嵌合体序列得到最终的有效数据。再利用Uparse软件对样品的全部有效序列在97%水平上进行OTU聚类,并筛选出OTU中出现频率最高的序列作为OTUs代表序列,用Mothur方法与SILVA的SSUrRNA数据库进行物种注释分析,并在各个水平上统计样品的群落组成。
1.7 沙棘根瘤内生细菌多样性分析
沙棘根瘤内生细菌多样性分析采用Shannon指数、Simpson指数、Chao1指数和ACE指数[16-18]。
Shannon 指数:
Simpson 指数:DSimpson=1-∑pi2
式中:Pi为第i个物种的OTU数占总OTU数的比例,表明第i个物种的相对丰度,可用Pi=Ni/N求出,Ni为第i个物种OTU数;N为总OTU数。S为每个样品的物种总数;F1为检测到的singletons数目;F2为检测到的doubletons的数目;Sabund为优势OTU的数目;Srare为稀有OTU的数目;Cace为样品的丰度估计值;γ2为样品中稀有OTU的变异系数。
2 结果与分析
2.1 中国沙棘根瘤内生细菌和根际土壤细菌OTUs数目统计及物种注释
将中国沙棘根瘤内生细菌和根际土壤细菌分别进行高通量测序,对注释结果和OTU聚类进行统计(表2)。沙棘根瘤内生细菌的测序覆盖度为99.7%,根际土壤细菌测序覆盖度为97.5%,表明测序数据合理可靠。在沙棘根瘤内生细菌中检测到的OTU聚类及后续分析的有效序列(Total-tag)比根际土壤细菌中检测到的多7 076条,用于构建OTUs并获得注释信息的序列(Taxon-tag)比根际土壤细菌中检测到的多10 227条。在97%相似度下对所有序列进行OTU划分,在根际土壤细菌中检测到的OTU数为根瘤内生细菌的15.66倍。
对OTU代表物种进行物种注释,并比较沙棘根瘤内生细菌和根际土壤细菌的物种注释信息,找到其共有的和特有的物种,绘制韦恩图(图1)。沙棘根瘤内生细菌特有的OTU有51个,占沙棘根瘤内生细菌总OTU的21.98%;沙棘根际土壤细菌特有的OTU有3 452个,占根际土壤细菌总OTU的95.01%。沙棘根瘤内生细菌与根际土壤细菌共有的OTU有181个,占沙棘根瘤内生细菌总OTU的78.02%,占根际土壤细菌总OTU的4.99%。
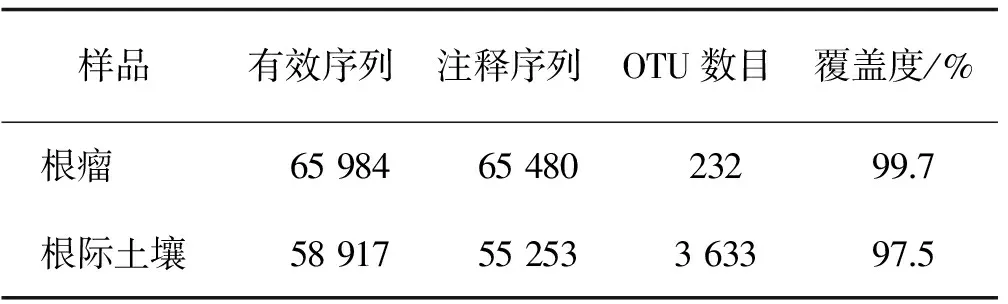
表2 中国沙棘根瘤内生细菌和根际土壤细菌序列数Table 2 Sequences number of root nodules endophytic and rhizosphere soil bacteria of Hippophae rhamnoidoes subsp. sinensis
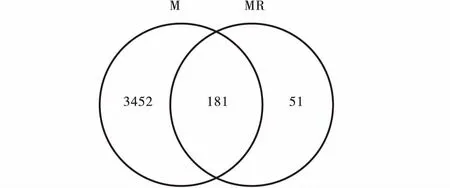
图1 OTU韦恩图Fig.1 Venn diagram of OTU注:图中M为根际土壤细菌;MR为根瘤内生细菌
2.2 沙棘根瘤内生细菌和根际土壤细菌多样性
Alpha多样性指数可以反映各群落内微生物多样性的丰富度。将沙棘根瘤内生细菌与沙棘根际土壤细菌的微生物多样性指数进行统计(表3)。沙棘根际土壤细菌Shannon指数、Chao1指数和ACE指数分别是沙棘根瘤内生细菌的1.59倍,12.33倍和11.84倍,说明根际土壤细菌的微生物多样性和丰度都比根瘤内生细菌的高。根际土壤细菌Simpson指数是根瘤内生细菌的1.59倍,说明根际土壤细菌均匀度比根瘤内生细菌好,且根际土壤细菌优势OTU比根瘤内生细菌多。
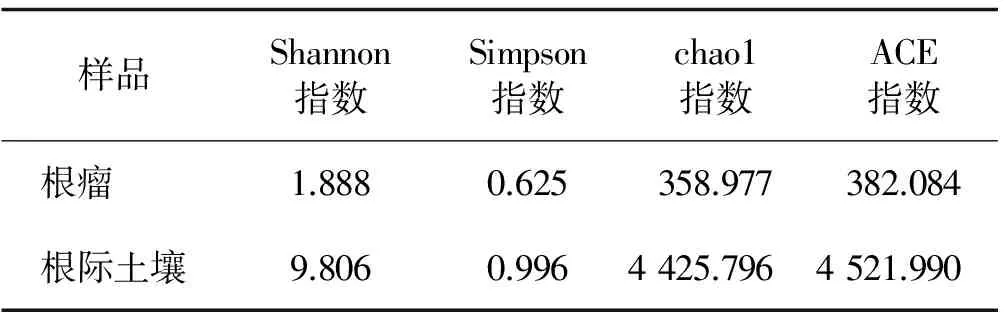
表3 沙棘根瘤内生细菌与根际土壤细菌微生物多样性指数Table 3 Microbial diversity index of root nodules endophytic bacteria and rhizosphere soil bacteria of Hippophae rhamnoidoes subsp. sinensis
2.3 沙棘根瘤内生细菌和根际土壤细菌群落结构
对OTU代表序列进行物种注释,获得分类学信息并分别在各个分类水平统计样本的群落组成(表4)。

表4 不同分类水平的细菌群落组成Table 4 Bacteria community structure at different classification levels
在门、纲、目、科和属等不同分类水平,沙棘根际土壤样品中检测到的微生物种类都比根瘤样品中检测到的微生物种类多,且分类水平越低,微生物差异就越明显,在目、科和属水平,根际土壤样品的微生物物种数分别是根瘤样品中的3.46倍,3.68倍和4.40倍。
在门分类水平,将沙棘根瘤内生细菌与根际土壤细菌中丰度前10的类群进行统计(表5),在沙棘根瘤内生菌中,Actinobacteria和Proteobacteria为优势类群,其相对丰度分别为94.16%和5.46%,占到所有内生细菌类群的99.62%。在沙棘根际土壤中,Proteobacteria,Actinobacteria和Acidobacteria为优势类群,其相对丰度分别为31.41%,27.28%和15.81%。在沙棘根际土壤中,相对丰度居前10的类群占到所有细菌类群的96.20%。在门分类水平,将沙棘根瘤内生细菌和根际土壤细菌中相对丰度居前10的物种进行比较,发现沙棘根瘤内生细菌相对丰度居前10的物种在根际土壤细菌中均存在,但根际土壤细菌中Thaumarchaeota的细菌在根瘤内生细菌中没有分布。
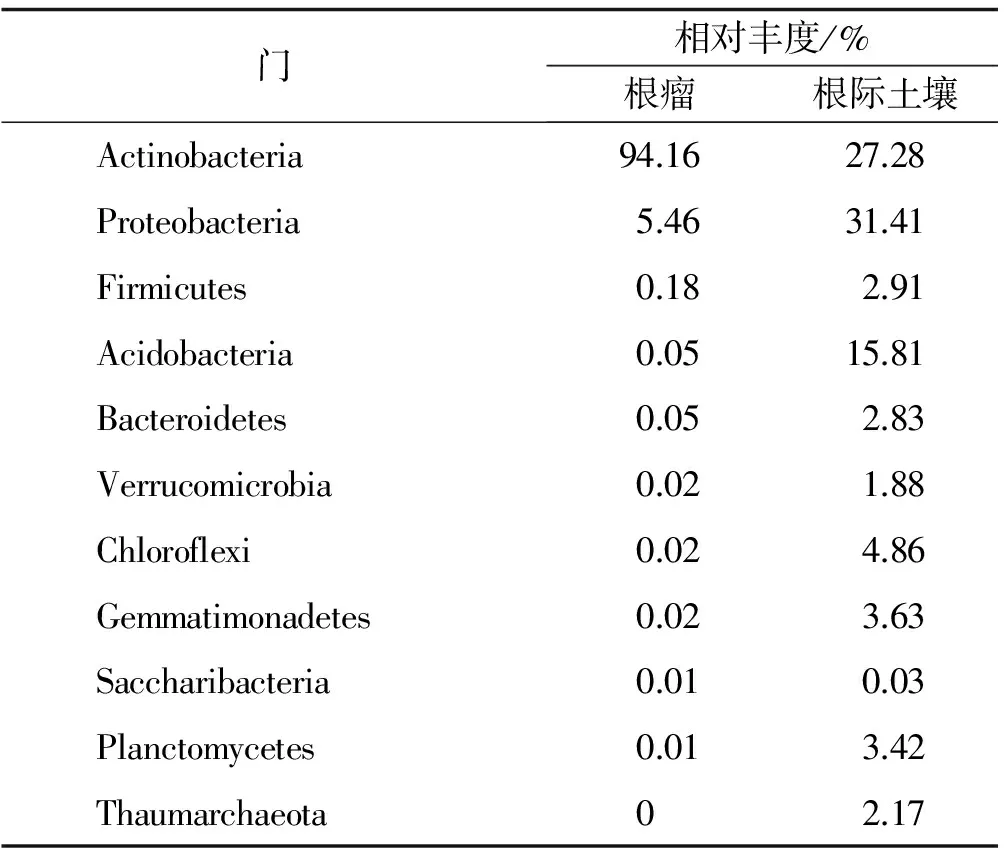
表5 中国沙棘根瘤内生细菌和根际土壤细菌相对丰度前10的门Table 5 The top 10 phyla of relative abundance of root nodules and rhizosphere soil bacteria of Hippophae rhamnoidoes subsp. sinensis
在属分类水平,将沙棘根瘤内生细菌与根际土壤细菌中相对丰度居前10的属进行统计(表6),在沙棘根瘤内生菌中,Frankia菌属为优势属且占绝对优势,其相对丰度为93.21%。在沙棘根际土壤中,Gaiella、Bacillus、Solirubrobacter、Arthrobacter、Stenotrophomonas为优势属,其丰度分别为1.99%、1.87%、1.87%、1.84%和1.21%。在属分类水平,将沙棘根瘤内生细菌和根际土壤细菌中相对丰度居前10的物种进行比较,发现沙棘根瘤内生细菌相对丰度居前10的物种在根际土壤细菌中均存在,但根际土壤细菌中Solirubrobacter和Blastococcus的细菌在根瘤中没有分布。

表6 中国沙棘根瘤内生细菌和根际土壤细菌相对丰度前10的属Table 6 The top 10 genera of relative abundance of root nodules and rhizosphere soil bacteria of Hippophae rhamnoidoes subsp. sinensis
在门和属分类水平进行比较发现,沙棘根瘤内生细菌和根际土壤细菌的群落组成既有相似性又存在一定的差异,尤其是细菌的丰度在两种样品间存在较大差异。在沙棘根瘤内生细菌中Frankia占93.21%,而在根际土壤细菌中仅占0.02%。同时还发现,与沙棘根瘤内生细菌相比,沙棘根际土壤细菌的均匀度较好,优势物种较多。
在属分类水平,将沙棘根瘤内生细菌与根际土壤细菌中相对丰度居前10的特有属进行统计(表8)。可见,在属分类水平,沙棘根瘤内生细菌特有的相对丰度居前10的物种分别为Lactobacillus、Aeromonas、Shewanella、Pelosinus、Buchnera、Blautia、Lactococcus、Anaerofustis、Sedimentibacter、Syntrophomonas。其中Lactobacillus相对丰度达到0.02%,其他属的相对丰度均未达到0.01%。沙棘根际土壤细菌特有的相对丰度居前10的属分别为Solirubrobacter、Candidatus-Alysiosphaera、Blastocatella、Microvirga、Skermanella、Marmoricola、Pirellula、Nitrosococcus、Rubrobacter和Terrimonas。其中Solirubrobacter相对丰度为1.87%,Candidatus-Alysiosphaera和Blastocatella相对丰度为0.79%,其他属相对丰度均在0.2%以上。

表7 中国沙棘根际土壤细菌在门水平相对丰度居前10的特有类群Table 7 The top 10 of peculiar phylum bacteria in rhizosphere soil of Hippophae rhamnoidoessubsp. sinensis
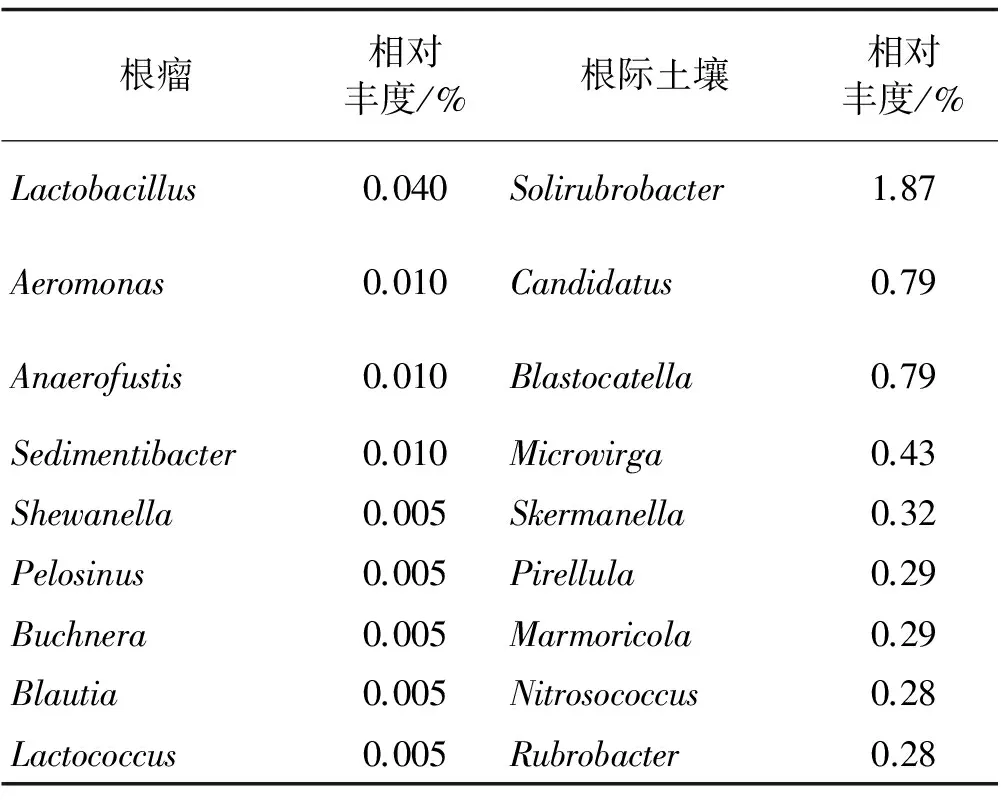
表8 中国沙棘根瘤内生细菌和根际土壤细菌在优势属水平相对丰度居前10的特有类群Table 8 The top 10 of peculiar genus bacteria in root nodules and rhizosphere soil of Hippophae rhamnoidoes subsp. sinensis
3 讨论
沙棘根瘤是沙棘根部受到Frankia侵染形成的共生结构,这种共生结构使内生菌和宿主植物在生理结构、营养物质的输送以及能量分配等方面达到一定平衡,维护内生菌和宿主植物的共生生活。徐瑞瑞[9]在研究沙棘根瘤时,发现在沙棘根瘤内生菌中,除了与沙棘共生的Frankia外,还有非Frankia内生菌存在于根瘤中。此次研究结果也表明,沙棘根瘤内生菌中Frankia为优势微生物,其相对丰度占到93.21%,除了Frankia外,沙棘根瘤内生菌中还有92个属的细菌,具有丰富的多样性。邱并生[16]和吴立娟等[17]在研究豆科植物与根瘤菌共生关系的过程中,发现根瘤中可以同时存在共生根瘤菌和非共生根瘤菌。可见,非豆科植物沙棘根瘤中,内生菌也具有丰富的多样性,且同时存在共生根瘤菌和非共生根瘤菌。
研究发现,沙棘根际土壤细菌多样性比根瘤内生细菌要丰富。沙棘根瘤内生细菌与根际土壤细菌群落组成既有相似性,又存在差异。沙棘根瘤内生细菌中有78.02%的OTU是与根际土壤共有的,门和属分类水平微生物群落组成分析也发现,沙棘根瘤内生细菌中存在的微生物在根际土壤细菌中也有分布。许多内生菌属于兼性内生,不仅存在于植物组织内部,也存在于根际土壤中,根际土壤是植物内生菌的主要来源[18-19]。在沙棘根瘤内生细菌中,优势门Proteobacteria所占比例为5.46%;而在沙棘根际土壤细菌中,其所占比例为31.41%,是绝对优势门。有研究表明,Proteobacteria是植物根际最为丰富的优势菌群,这与其生长速度快,能广泛利用各种根际分泌物有关[20]。
沙棘根瘤内生细菌与根际土壤细菌具有相似的群落组成,说明沙棘根瘤内生细菌中的一些细菌可能来源于根际土壤。在沙棘根瘤内生细菌中,Frankia所占比例为93.21%,而在沙棘根际土壤细菌中,其所占比例仅有0.02%。袁长芳[21]对山西不同土壤沙棘Frankia的数量和分布进行研究,发现地表生长沙棘的土壤中含有大量的Frankia,未生长沙棘的土壤中也有Frankia存在,Frankia应该作为土壤微生物的固有种群。在沙棘根际土壤中,除了Frankia外,还有大量其他的细菌存在[21]。但沙棘根瘤是由Frankia侵染引起的,Frankia侵染沙棘根部形成根瘤后,由于根瘤内的环境更适合Frankia生长繁殖,所以根瘤内Frankia含量远远高于根际土壤中的Frankia,有关沙棘根瘤内Frankia的侵染机制及途径还需进行进一步研究。
4 结论
采用高通量测序技术研究中国沙棘根瘤内生细菌与根际土壤细菌多样性,检测到中国沙棘根瘤内生细菌共10门93属,中国沙棘根际土壤细菌共39门409属,根瘤和根际土壤细菌均具有丰富的多样性,但根际土壤细菌比根瘤内生细菌多样性丰富。将中国沙棘根瘤内生细菌与根际土壤细菌群落结构进行比较,在沙棘根瘤中检测到的大部分细菌在沙棘根际土壤中都有分布,由此可以推测沙棘根瘤中的一些内生细菌可能来源于根际土壤。但相同种类的细菌,在沙棘根瘤内和根际土壤中的相对丰度具有较大差异,除此之外,在沙棘根瘤内与根际土壤中均检测到了特有的细菌类群。因此中国沙棘根瘤内生细菌与根际土壤细菌群落结构既有相似之处又存在一定的差异。
参考文献:
[1] 刘志林.人工栽培灌丛对牧草生长及水土保持效果的研究[J].草原与草坪,2009,38(6):50-52.
[2] Normand P,Fernandez M.Evolution and diversity ofFrankia[J].Prokaryotic Symbiontsin Plants,2009(8):103-125.
[3] 张爱梅,牛世全,孙坤,等.沙棘属植物结瘤特性及Frankia根瘤菌分离[J].草原与草坪,2010,30(2):43-46
[4] 张爱梅,孙坤,达文燕.马衔山两种不同生境沙棘根际微生物研究[J].西北师范大学学报(自然科学版),2008,44(1):69-73.
[5] 郭凤仙,刘越,唐丽,等.药用植物根际微生物研究现状与展望[J].中国农业科技导报,2017,19(5):12-21.
[6] 肖艳红,李菁,刘祝祥,等.药用植物根际微生物研究进展[J].中草药,2013,44(4):497-504.
[7] 李建宏,李雪萍,张建贵,等.饲用玉米根际促生菌资源筛选及其特性研究[J].草原与草坪,2017,37(1):44-50.
[8] 张吉科,张小民,陆锡芳,等.沙棘根瘤内生菌多型性[J].微生物学报,1996,36 (5):389-393+406
[9] 徐瑞瑞.沙棘弗兰克氏和非弗兰克氏放线菌的分离,培养及分子鉴定[D].北京:中国林业科学研究院,2011.
[10] 张爱梅.沙棘属植物根际可培养微生物的初步研究[D].兰州:西北师范大学,2008.
[11] 曹桂林.陕西黄土高原固氮植物沙棘根际微生物多样性研究[D].西安:西北大学,2010.
[12] 李振东,陈秀蓉,李鹏.紫花针茅内生细菌的分离与鉴定[J].草原与草坪,2011,31(1):8-12.
[13] 符德欢,朱高倩,郭佳玉,等.改良CTAB法提取重楼属3种药用植物干燥根茎DNA[J].中药材,2017,40(6):1295-1299.
[14] 赵桂琴,刘欢,刘美.ISSR标记的早熟禾遗传多样性分析[J].草地学报,2011(5):781-786
[15] Lundberg,Derek S.Practical innovations for highthroug-hput amplicon sequencing[J].Nature methods,2013,10(10) :999-1002
[16] 邱并生.根瘤内生细菌[J].微生物学通报,2013,40(3):544.
[17] LiJuan Wu,HaiQing Wang,EnTao Wang,etal.Genetic diversity of nodulating and non-nodulating rhizobia associated with wild soybean (GlycinesojaSieb.& Zucc.) in different ecoregions of China[J].FEMS Microbiology Ecology,2011,76(3):439-450.
[18] Zakhia F,Jeder H,Willems A,etal.Diverse bacteria associated with root nodules of spontaneous legumes in Tunisia and first report for nifH-like gene within the genera Microbacterium and Starkeya[J].Microbial Ecology,2006,51(3):375-393.
[19] 路国兵,张瑶,冀宪领,等.植物内生细菌的侵染定殖规律研究进展[J].生物技术通报,2007(3):88-92.
[20] 艾超,孙静文,王秀斌,等.植物根际沉积与土壤微生物关系研究进展[J].植物营养与肥料学报,2015,21(5):1343-1351.
[21] 袁长芳.山西省不同土壤沙棘Frankia的数量分布及菌剂接种效果[J].生态学杂志,1989,8(2):14-17.

