红三叶AFLP体系的建立及优化
蒲小剑,田久胜,田新会,杜文华(.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; .甘肃农业大学植物保护学院,甘肃 兰州 730070)
扩增片段长度多态性(AFLP)是由RFLP与RAPD结合而成的一种新的分子标记技术,具有RFLP标记和RAPD标记的优点,有“最有力的分子标记”或“下一代分子标记”的称号[7]。因其高多态性,可靠,高效[8],DNA用量少,检测率高[9],重复性高,加上选择为中性[10]等许多优点,AFLP技术普遍应用于生物研究领域。近年来,AFLP技术在牧草种质鉴定方面的应用发展迅速,在紫花苜蓿(Medicagosativa)[11],燕麦(Avenasativa)[12],狗牙根(Cynodondactylon)[13],老芒麦(Elymussibiricus)[14-15],扁蓿豆(Medicagosativa)[16],鸭茅(Dactylisglomerata)[17]等牧草的鉴定中均有报道。孟丽娟[18]通过对来自美国、加拿大和俄罗斯的31份红三叶材料运用ISSR分子标记建立并优化了适宜红三叶ISSR分析的最佳反应体系,扩增出58条多态性条带,后通过UPGMA聚类分析将试验材料分为5类。Mamta Gupta等[19]使用36对简单序列重复(SSR)引物分析全球收集红三叶材料的遗传多样性,其扩增片段1~6个,多态性值0.301~0.719,贝叶斯聚类模型分析将研究材料分为3类。Herrmann等[20]利用优化AFLP体系探索了野生和栽培红三叶群体的遗传特性和亲缘关系。Muntean等[21]用AFLP分子标记对红三叶品种遗传多样性进行了评价。虽然AFLP技术的原理简便,但步骤繁多,从酶切反应到银染成像的优化,若一个步骤或条件不合适,就出现带型不稳定、条带不清晰和多态性偏低等问题。所以,以岷山红三叶和红三叶新品系为试验材料,筛选AFLP优化条件,旨在建立适宜红三叶的AFLP反应体系,为红三叶分子遗传研究奠定基础。
1 材料和方法
1.1 试验地概况
田间试验在甘肃省临洮县临洮农校农场进行,地理位置E 103°87′,N 35°37′,海拔1 892 m,降水量562 mm,无霜期80~190 d,年平均气温7.0℃(最高气温34.6℃,最低气温-29.5℃)。土壤为黑麻土,肥力均匀,有灌溉条件,前茬作物为玉米。
1.2 试验材料
试验材料为以岷山红三叶为父本(Male parent,M)、抗白粉病红三叶新品系(甘农PR1)为母本(Female parent,F)杂交形成的F1代群体,以及2亲本。2015年3月下旬将杂交F1代种子点播,株距20 cm,行距30 cm,播种深度1(2 cm,得到F1代群体。于生长期间采摘幼嫩叶片1~2 g,放入液氮保存,带回实验室-80℃超低温冰箱保存备用。
1.3 试验试剂与仪器
MseI,EcoRI和T4DNA连接酶购自Thermo Scientific,2×PCR Master Mix与DNA Marker购于BBI Life Sciences。引物及接头(表1)上海生工生物工程有限公司人工合成,其他试剂均为国产分析纯。
试验所用仪器见表2。
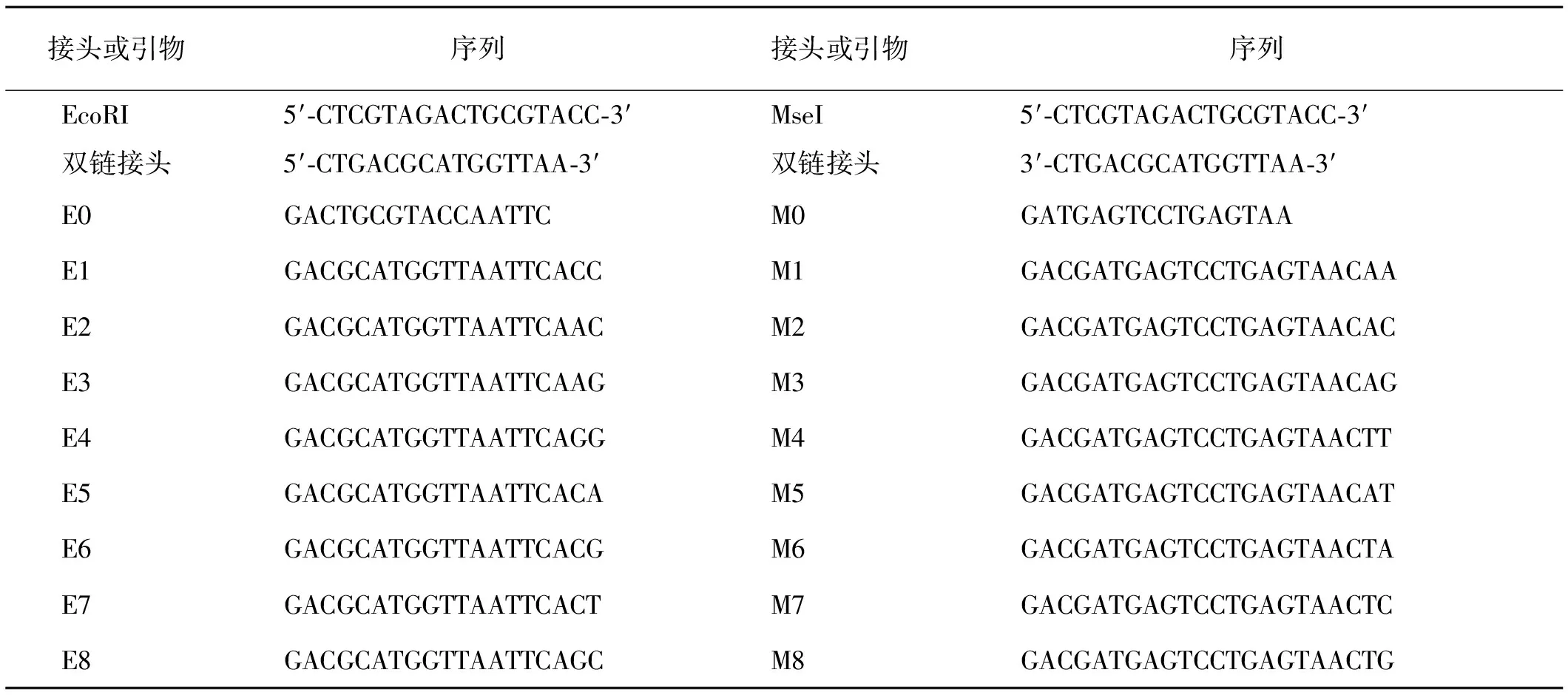
表1 接头和引物序列Table 1 Sequence of the adapter and primer
表2 试验仪器Table 2 Experimental instrument
1.4 基因组DNA制备及检测
采用改进CTAB法[22-23]提取红三叶基因组DNA。1 %琼脂糖凝胶电泳检测DNA的质量,TE稀释后用超微量紫外分光光度计检测D260nm/D280nm,D260nm/D230nm,以确定DNA的纯度与浓度。
1.5 体系优化筛选条件
体系优化筛选条件:酶切时间,DNA浓度,EcoRI、MseI浓度见表3;预扩增体系见表4,选择性扩增体系进行优化设计见表5。

表3 优化体系筛选条件设计及筛选结果Table 3 Optimization system screening conditions design and screening results
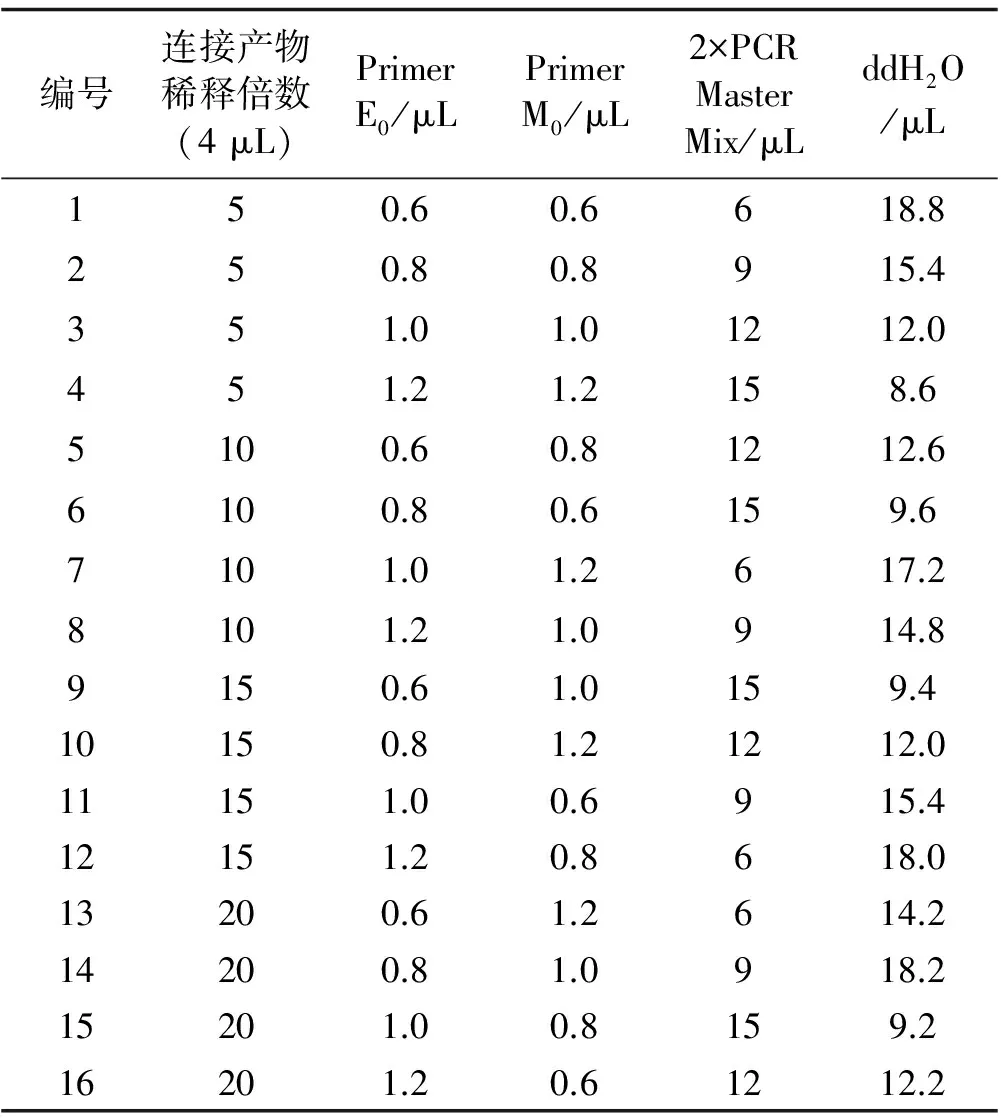
表4 预扩增正交体系设计Table 4 Orthogonal design for pre-amplification
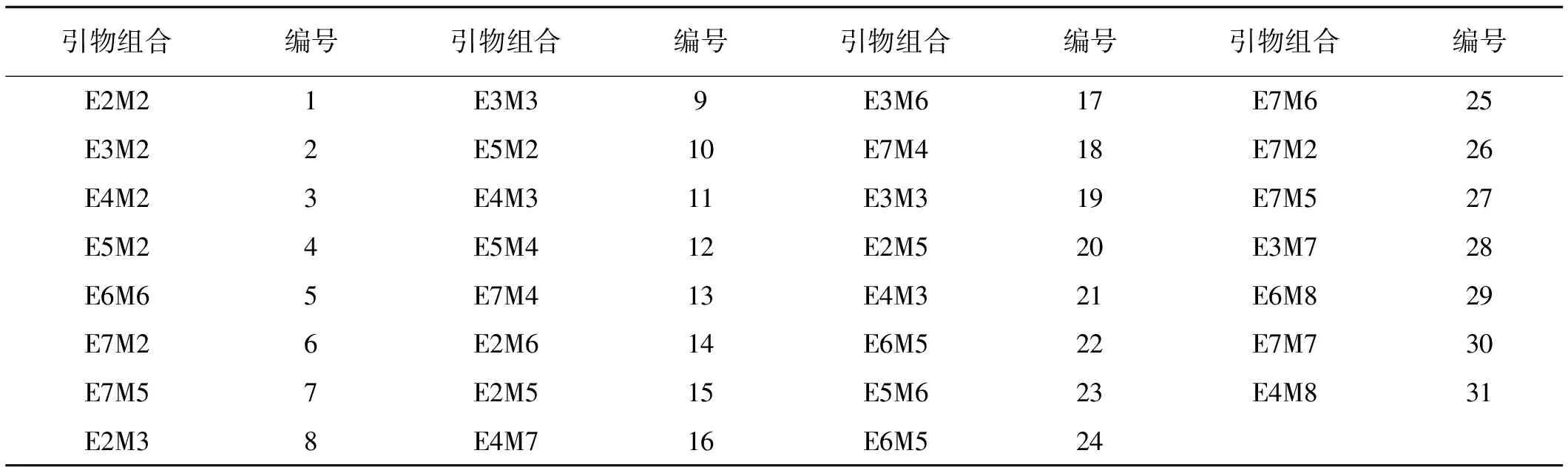
表5 选择性扩增引物组合编号Table 5 Primer numbers
注:E代表EcoRI,M代表MseI。
1.6 AFLP反应体系
1.6.1 基因组DNA双酶切 选取2种限制性内切酶EcoRI/MseI,反应体系共20 μL。包含,10×Tang buffer 3 μL,模板DNA(200~300 ng/μL)9 μL,8 UEcoRI,6 UMseI,ddH2O补平。双酶切时间,37℃水浴5 h、65℃水溶15 min。-20℃保存酶切产物。
1.6.2 接头连接 合成的单链人工接头稀释至50 μmol/L,经PCR反应合成双链,加入3 U T4DNA连接酶,于22℃下连接过夜。
1.6.3 AFLP预扩增反应 反应总体系30 μL,包括4 μL连接产物模板DNA,0.8 μLEcoRI,0.6 μLMseI预扩增引物,15 μL 2×PCR Master Mix,ddH2O补平,离心混匀进行PCR反应。
1.6.4 AFLP选择性扩增反应 反应总体系20 μL,包括2 μL稀释10、20、25、30、40、50倍的预扩增产物(稀释30倍);0.8 μL Primer E,1.0 μL Peimer M,2×PCR Master Mix6、7、8、9、10和11 μL;ddH2O补平后进行PCR反应。
1.6.5 扩增产物检测 制备4%变性聚丙烯酰胺凝胶,待胶聚合后预电泳30 min。选择扩增产物(2 μL)与上样Buffer混匀,经90℃变性3 min,置于4℃保存等待点样。点样后1 500 V恒功率电泳1.5 h左右,停止电泳。采用Carlos银染方法[22-23],胶版微干后拍照、统计数据。
2 结果与分析
2.1 DNA提取质量和检测
AFLP反应对DNA质量要求较高。高质量的DNA是获得重复性好、条带清晰AFLP扩增结果的关键因素。采取改良CTAB法提取红三叶基因组DNA。经1%琼脂糖凝胶电泳检测显示所提取的红三叶基因组DNA条带清晰、整齐、无拖尾(图1)。经超微量紫外分光光度计检测,D260nm/D280nm在1.7~1.9,D260nm/D230nm约为2,浓度在200 ng/μL。说明所提取DNA纯度高,浓度适中,能够达到下一步试验要求。

图1 红三叶基因组DNA电泳检测Fig.1 Agarose gel-electrophporesis of redclover genomic DNA注:1,2分别为红三叶DNA在1 %琼脂糖凝胶检测结果
2.2 酶切、连接体系优化
2.2.1 酶切时间优化 采用EcoRI和MseI进行基因组DNA酶切,识别序列分别为GAATTC和AATT。用1.5%琼脂糖凝胶电泳检测酶切产物。其DNA片段均在100~1 500 bp,表明酶切充分,符合试验要求(图2)。1~5条带亮度逐渐增加,6稍暗于5。因此酶切时间选用37℃ 5 h,65℃ 20 min。
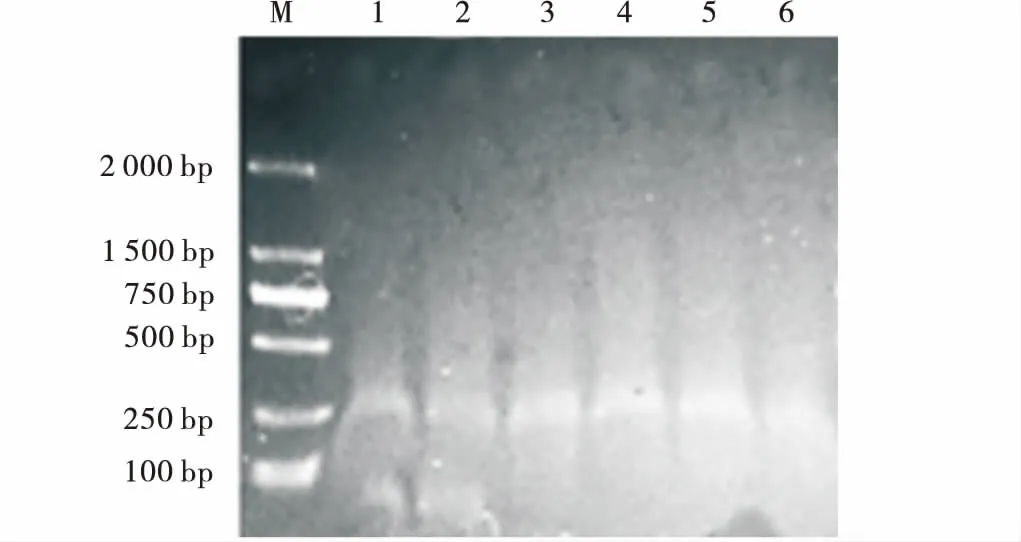
图2 酶切时间优化电泳图Fig.2 Agarose gel-electrophporesis of gradientextracted enzyme digestion time注:1~6分别为3,3.5,4.0,4.5,5.0,5.5 h酶切连接琼脂糖电泳带型,M为D2000分子量标记
2.2.2 DNA浓度筛选 40~90 ng/μL电泳条带亮度逐渐变大,100 ng/μL条带亮度暗于90 ng/μL。90 ng/μL DNA进行酶切反应(图3)。

图3 DNA浓度筛选电泳图Fig.3 Agarose gel-electrophoresis of different DNA concentrations注:1~7的DNA浓度分别为40、50、60、70、80、90、100 ng/μL,M为D2000分子量标记
2.2.3EcoRI浓度筛选 电泳结果(图4)表明,1~4条带亮度随内切酶EcoRI浓度增加变大,而5、6条带亮度暗于4。EcoRI浓度筛选结果为8 U。
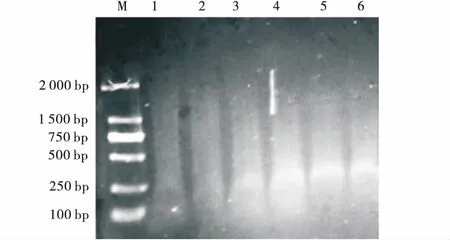
图4 EcoRI浓度筛选电泳图Fig.4 Agarose gel-electrophoresis of different EcoRI concentrations注:1~6的EcoRI浓度分别为2、4、6、8、10、12 U,M为D2000分子量标记
2.2.4MseI浓度筛选 电泳结果(图5)表明1、3条带明显亮于其他条带,3的条带亮度最大。MseI浓度筛选结果为6 U。
2.3 预扩增体系的优化
根据表2设计的16个PCR扩增结果图。整体效果不理想,仅第4与第6有条带。第6条带的亮度明显优于第4条带。因此,预扩增体系为,连接产物,4 μL(稀释10倍);Primer E0,0.8 μL;Peimer M0,0.6 μL;2×PCR Master Mix,15 μL;ddH2O,9.6 μL(图6)。
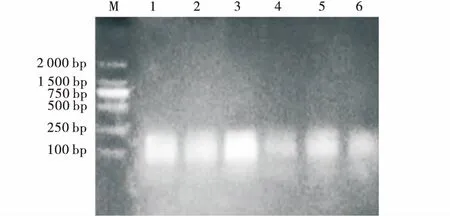
图5 MseI(Trμ9I)浓度筛选电泳图Fig.5 Agarose gel-electrophporesis of different MseI (Trμ9I) concentration注:1~6的MseI(Trμ9I)浓度分别为2、4、6、8、10、12 U,M为D2000分子量标记
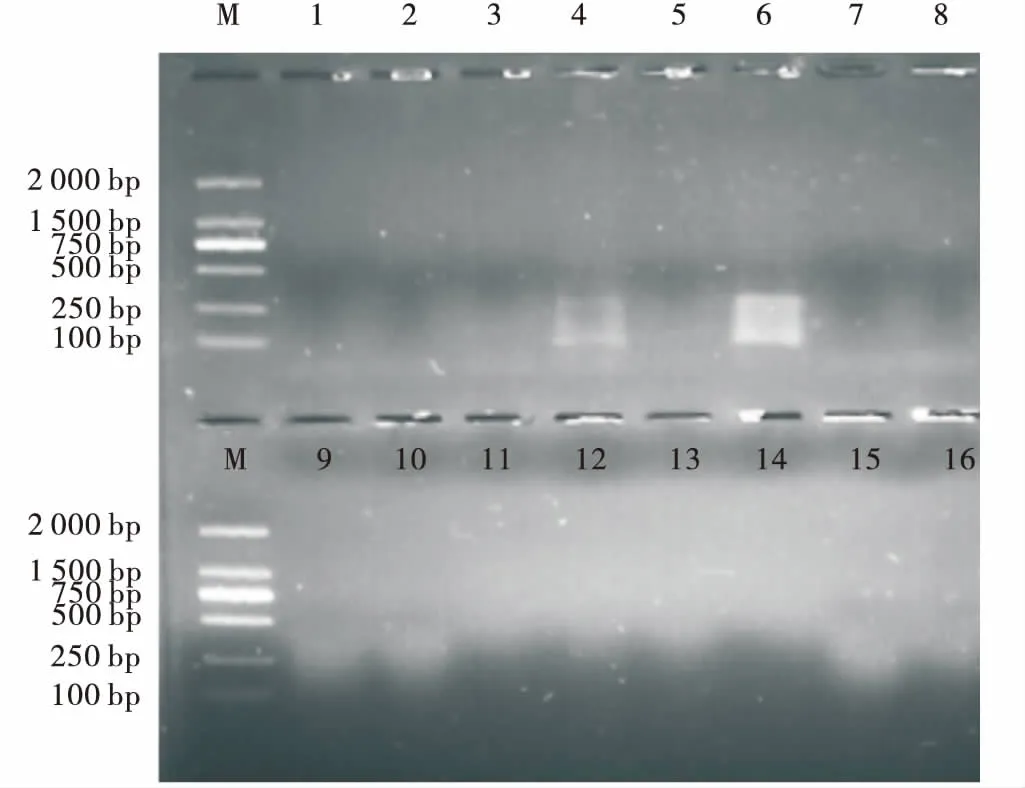
图6 预扩增正交设计电泳图Fig.6 Agarose gel-electrophporesis on orthogonal design of pre-amplification注:1~16代表正交体系编号,同表4
2.4 选择性扩增体系优化
2.4.1 预扩增产物稀释倍数筛选 在众多因素中,预扩增产物稀释的倍数对选择性扩增效果的影响最大。为使条带清晰、稳定,预扩增产物被稀释不同倍作比对试验,结果显示,最适宜的扩增效果是稀释30倍(图7)。
2.4.2 2×PCR Master Mix用量筛选 2×PCR Master Mix是即用型的常规PCR预混合溶液,含有TaqDNA Polymerase,dNTP混合物,MgCl2以及优化的缓冲体系,只需加入引物和模板即可进行扩增(图8),其用量大小会直接影响PCR结果。琼脂糖凝胶电泳表明,10 μL PCR产物电泳条带最亮,7 μL PCR产物次之,6 μL PCR产物最暗。
选择性扩增体系:预扩增产物,2 μL(稀释30倍);Primer E,0.8 μL;Primer M,1.0 μL;2×PCR Master Mix,10 μL;ddH2O,6.2 μL。
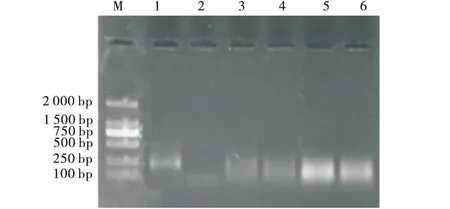
图7 预扩增产物稀释倍数处理下选择性扩增Fig.7 Effects of pre-amplification product diluted multiples on selective amplification注:1~6分别为5、10、15、20、25、30、40倍Mix用量,M为D2000分子量标记

图8 2×PCR Master Mix用量处理下选择性扩增Fig.8 Effects of concentration of 2×PCRMasterMix on selective amplification注:1~6分别为6、7、8、9、10、11 μL 2×PCR Master稀释,M为D2000分子量标记
2.4.3 引物对的筛选 从8条EcoRI酶切位点接头选择性引物和8条MseI酶切位点接头选择性引物组合共计64对选择性引物中筛选。只有1对引物组合没有扩增出条带,2对引物扩增结果与其他引物组合扩增条带重复,其余引物组合均能获得较清晰条带。其中31对引物的扩增图谱(图9)。选取16对条带清晰且条带数较多的引物组合进行后续分析。
3 讨论
AFLP被认为是十分理想、高效的分子标记技术,己经被广泛应用到水稻等作物的遗传多样性分析、种质鉴定、基因定位和连锁图谱构建等方面[24]。AFLP试验分析中,DNA模板限制性内切酶酶切是否充分、酶切片段T4DNA连接酶的连接是否成功是影响AFLP试验成功与否的关键,限制性内切酶及 T4DNA连接酶的用量根据模板 DNA量而定[25]。AFLP可采取单酶切、双酶切,据报道TE-AFLP用3种酶进行酶切反应[26]。双酶切具有DNA片段长度较小,易于分离扩增产物等优点,因此得以大量应用于试验研究。高品质基因组DNA的提取,是AFLP反应体系成功建立的关键[27],若含有质量较差的DNA时,试验结果的稳定性将会受到很大影响[28-29]。试验用于酶切的DNA经检测D260 nm/D280 nm的比值在1.7~1.9,纯度较高。琼脂糖凝胶电泳检测显示,不含RNA和其他杂质,完全达到了AFLP技术的要求。双酶切反应中,限制性内切酶对DNA的酶切必须完全彻底,否则扩增后变性聚丙烯电泳会出现多而密、中下部扩增带稀少的现象,EcoRI较MseI敏感,更容易受DNA质量和体系中各成分的影响,因此在酶切反应中,采用EcoRI酶切缓冲液作为双酶切的缓冲液。

图9 引物筛选电泳图Fig.9 Agarose gel-electrophporesis of primer screening注:M为DNA Marker(BBI Life Sciences)
AFLP反应中,不同材料的酶切时间、预扩增产物的稀释倍数和选择性扩增引物浓度这3个关键反应条件有所不同[30-31]。蔡丽艳等[11]构建苜蓿cDNA-AFLP反应体系的酶切时间为37℃ 6 h,65℃ 20 min。刘欢等[12]构建燕麦AFLP体系酶切的时间为37℃ 4 h,65℃ 15 min。引物浓度是反应体系的重要组成部分,对试验结果影响比较大[32]。如果引物浓度偏低,PCR效率也会降低,扩增产物产量也相应减少;如果引物浓度偏高,可能会发生异位引导,导致非特异性意外扩增,影响试验结果的准确性[33]。试验为2种引物分别设置了6个引物浓度梯度,并筛选出了最优浓度。
AFLP操作时,由于胶板点样口限制,同一对引物所扩增出的所有样需分批进行点样、跑胶,这就造成了不同玻璃板之间显影的差别,人工统计条带时,人为因素造成的误差会降低AFLP技术的有效性。因此,为了提高试验的精确性,试验对引物初步筛选后,选出16对引物(点样板最多点样32个)对红三叶新品系和岷山红三叶进行多样性分析,筛选出11对清晰的扩增条带且多样性丰富的引物组合进行下一步实验。
4 结论
通过对决定AFLP体系的DNA浓度,酶切时间,两酶EcoRI和MseI浓度,预扩增产物稀释倍数,2×PCR Master Mix用量,引物组合等7个要素进行筛选,逐一筛选出对应上述要素的最优化量。分别为90 ng/μL,5 h,8 U,6 U,30倍,10 μL,构建了AFLP优化体系。按照筛选结果得到31条清晰条带。并选出11条进行后续分析。
参考文献:
[1] 何玮,蒋安,王琳,等.PEG干旱胁迫对红三叶抗性生理生化指标的影响研究[J].中国农学通报,2013,29(5):5-10.
[2] 孟丽娟,赵桂琴.红三叶ISSR-PCR反应体系的建立与优化[J].草原与草坪,2015,35(2):21-26.
[3] 高雪芹,伏兵哲,王俊杰,等.红三叶的研究现状及利用前景[J].农业科学研究,2013,34(3):52-55.
[4] 姜义宝,王成章,崔国文.红车轴草异黄酮对肉鸡免疫器官、免疫球蛋白及抗氧化性能的影响[J].草地学报,2011,19(3):520-524.
[5] 杜文华.三叶草[M].兰州:甘肃科学技术出版社,2006:7-8.
[6] 刘晓玲,杜文华,宋超.氮磷肥施用量对红三叶中异黄酮含量的影响[J].西北农业学报,2010,19(7):159-163.
[7] 王真.丹参雄性不育基因的AFLP标记[D].杨凌:西北农林科技大学,2012.
[8] 李鸿雁,李志勇,辛霞,等.49份野生扁蓿豆种质资源的AFLP遗传多样性分析[J].中国草地学报,2016,38(4):20-26.
[9] 程小毛,李响,姜永雷,等.基于AFLP的滇西北玉龙雪山不同海拔川滇高山栎遗传多样性分析[J].华中农业大学学报,2017,36(1):22-27.
[10] 王晓英,张林,李承秀,等.51个春兰(Cymbidiumgoeringii)品种的AFLP遗传多样性分析[J].植物遗传资源学报,2015,16(3):653-658.
[11] 蔡丽艳,石凤翎,李志勇,等.苜蓿cDNA-AFLP反应体系的建立和优化[J].种子,2011,30(8):1-4,8.
[12] 王茅雁,齐秀丽.利用RAPD标记研究燕麦属不同种的遗传差异[J].华北农学报,2004,19(4):24-28.
[13] 凌瑶,杨树萍,张新全,等.西南地区野生狗牙根种质资源的SSR与AFLP联合分析[J].广西植物,2014,(6):734-741,815.
[14] 付艺峰.老化老芒麦种质遗传完整性研究[D].呼和浩特:内蒙古农业大学,2015.
[15] 陈云.两种牧草遗传多样性及逆境条件下甲基化水平分析[D].曲阜,曲阜师范大学,2015.
[16] 李鸿雁,李志勇,辛霞,等.野生扁蓿豆种质资源AFLP遗传多样性的分析[J].植物遗传资源学报,2016(1):78-83.
[17] 王少青,牟琼,欧钟明,等.鸭茅种质资源分子遗传多样性研究进展[J].草业与畜牧,2015(5):1-6.
[18] 孟丽娟.引进红三叶种质资源的表型和遗传多样性研究[D].兰州:甘肃农业大学,2015.
[19] M Gupta,V Sharma,S K Chahota,etal.Analysis of genetic diversity and structure in a genebank collection of red clover (TrifoliumpratenseL.) using SSR markers[J].Plant Genetic Resources,2016,1-4.
[20] D Herrmann,B Boller,F Widmer,etal.Optimization of bulked AFLP analysis and its application for exploring diversity of natural and cultivated populations of red clover[J].Genome,2005,48:474-486.
[21] L Muntean,C Botez,S Muntean.AFLP-based assessment of genetic diversity among red clover (TrifoliumpratenseL.) cultivars[C].42nd CROATIAN & 2nd INTERNATIONAL SYMPOSIUM ON AGRICULTURE,236-240.
[22] 刘世新.实用生物组织学技术[M].北京:科学出版社,2003:222-224.
[23] S Porebski,L G Bailey,B R Baum.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant molecular biology reporter,1997,15(1):8-15.
[24] 张凤仙,毕玉芬,王晓云.云南野生苜蓿与引进苜蓿的核型分析[J].云南农业大学学报,2008(4):431-435.
[25] 饶龙兵,杨汉波,郭洪英,等.陈益泰.桤木属植物AFLP反应体系的建立与优化[J].分子植物育种,2014,12(3):547-553.
[26] A V Wurff,Y L Chan,N M Straalen.TE-AFLP:combining rapidity and robustness in DNA fingerprinting.Nucleic Acids Research,2000,28(24):1-5.
[27] 王大玮,李煜,周玮,等.杜仲AFLP反应体系的建立及优化[J].西北农林科技大学学报(自然科学版),2010,38(6):88-94.
[28] 雷家军,于海涛,王志刚,等.卷丹百合AFLP反应体系的建立与优化[J].东北农业大学学报,2013,44(10):122-127.
[29] 琚茜茜,黄如葵,黄玉辉,等.苦瓜AFLP和SRAP的PCR反应体系优化及应用比较[J].南方农业学报,2013,44(2):195-199.
[30] M A Rodrigues,C A Santos,J R Santana.Mapping of AFLP loci linked to tolerance to cowpea golden mosaic virus[J].Genetics and Molecular Research,2012,11(4):3789-3797.
[31] A K Shukla,A K Shasany,S P Khanuja.cDNA-AFLP-Based numerical comparison of leaf and root organ cDNAs in Catharanthus roseus[J].OMICS A Journal of Integrative Biology,2012,16(7/8):397-401.
[32] 李芳弟,王舰,王芳,等.马铃薯种质遗传多样性分析的AFLP反应体系优化与引物筛选[J].分子植物育种,2010,8(1):179-185.
[33] 曹亚.实用分子生物学操作指南[M].北京:人民卫生出版社,2003:132-134.

