红三叶联合环磷酰胺对小鼠宫颈癌U14作用的实验研究
法洪文,孙 倩
(1. 天津中医药大学,天津 300073;2. 天津市人民医院,天津 300121)
红三叶联合环磷酰胺对小鼠宫颈癌U14作用的实验研究
法洪文1,孙 倩2
(1. 天津中医药大学,天津 300073;2. 天津市人民医院,天津 300121)

目的观察红三叶联合环磷酰胺对小鼠宫颈癌细胞系U14的作用。方法将U14瘤液接种在小鼠右前肢腋下,然后随机分为对照组、环磷酰胺组、红三叶低剂量组、红三叶中剂量组、红三叶高剂量组、红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组,对照组给予羧甲基纤维素钠,其余组给予相应药物灌胃及腹腔注射给药。给药6d,每天观察各组小鼠饮食、精神、活动情况及瘤体生长情况,第10天称取小鼠体质量,脱椎处死,取瘤块称质量,计算抑瘤率及两药相互作用系数(CDI和Q值),光镜观察肿瘤组织病理学改变,TUNEL方法检测细胞凋亡情况。结果对照组小鼠肿瘤结节最明显,生长速度也最快。红三叶高剂量组、红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组对U14荷瘤小鼠的抑瘤率均达到了有效标准,同时单用红三叶的药物剂量不能小于400mg/kg。红三叶促宫颈癌U14细胞的凋亡作用随着药物剂量的增加而明显,红三叶中剂量+环磷酰胺组促凋亡作用优于环磷酰胺组,两药联用具有协同作用。结论红三叶对U14荷瘤小鼠有抑瘤作用,以红三叶与环磷酰胺联用效果最明显,提示红三叶与环磷酰胺联用作为临床治疗宫颈癌的辅助药物值得关注。
红三叶;环磷酰胺;宫颈癌U14;抑瘤率;细胞凋亡
红三叶为豆科多年生草本植物,含有多种异黄酮类物质, 这些异黄酮类物质有着重要的生物作用[1]。近年来对红三叶在抗肿瘤、抗氧化、提高机体免疫功能、防止前列腺增生、改善更年期综合征以及防止骨质疏松等方面的作用研究越来越受到关注[2]。宫颈癌是常见的妇科恶性肿瘤,是造成妇女死亡的第三大常见原因。本研究观察了红三叶联合环磷酰胺对小鼠宫颈癌细胞系U14的作用,旨在为宫颈癌的治疗提出新的实验依据,现报道如下。
1 实验资料
1.1材料
1.1.1实验动物 昆明种雌性小鼠70只,体质量(20±2)g,由中国人民解放军军事医学科学院实验动物中心提供,合格证号:scxk-(军)2012-0004。天津市人民医院清洁级动物饲养房饲养,温度20~22 ℃,相对湿度45%~55%,自由饮水,用标准颗粒饲料喂养。
1.1.2瘤株 小鼠宫颈癌U14瘤株,天津市医药科学研究所提供。
1.1.3药物 红三叶,购自西安小草公司,批号:XC20131009,纯度为98%。注射用环磷酰胺,200 mg/支,江苏恒瑞医药股份有限公司生产,产品批号:14021225。
1.1.4试剂 TUENL试剂盒,为德国宝灵曼公司原装试剂盒。
1.2方法
1.2.1宫颈癌U14荷瘤小鼠模型的建立 将瘤株接种于昆明种小鼠,待生长7 d后出现腹水,在无菌条件下,用1 mL空针抽取腹水,加入生理盐水,按1∶4比例(即1 mL腹水加4 mL生理盐水)制成细胞悬液。取已稀释好的U14细胞悬液0.2 mL,注射到小鼠右前肢腋下,每只注射0.2 mL,共接种70只小鼠,接种成功率100%。
1.2.2实验分组及给药 将接种瘤株成功的70只小鼠随机分为对照组、环磷酰胺组、红三叶低剂量组、红三叶中剂量组、红三叶高剂量组、红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组,每组10只。对照组给予羧甲基纤维素钠0.4 mL/20 g灌胃,红三叶低、中、高剂量分别按100 mg/kg、200 mg/kg、400 mg/kg(实验之前已通过动物实验证实此剂量安全[3])配置,0.4 mL/20 g灌胃,共给药6 d。环磷酰胺仅接种24 h后腹腔给药1次(60 mg/kg)。各给药组按照上述相应药物剂量及方法联合处理。
1.3观察指标
1.3.1荷瘤鼠习性及瘤体生长情况 观察各组荷瘤鼠每天饮食、精神、活动情况,给药前称取荷瘤鼠体质量,给药后隔日测瘤鼠的体质量,于接种后第5天开始隔日测量肿瘤体积,并做记录。肿瘤体积按公式计算:瘤体积 = ab2π/6(a为肿瘤最长径,b为最短径)。
1.3.2抑瘤率 于接种后第10天称取小鼠体质量,脱椎处死小鼠,取瘤块称质量,分别计算红三叶各组和红三叶联合环磷酰胺各组的抑瘤率。抑瘤率(%)=(对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量×100%。
1.3.3荷瘤鼠胸腺和脾脏指数 于接种后第10天,无菌方法解剖摘取小鼠胸腺和脾脏,用电子分析天平称重,计算胸腺和脾脏指数。胸腺(脾)指数=胸腺(脾)质量/小鼠体质量×100%[4]。
1.3.4两药相互作用系数(CDI)及Q值 CDI=AB/A×B,其中AB为两种药物联合组的平均瘤质量与对照组平均瘤质量的比值,A或B是两种药物单独使用组的平均瘤质量与对照组平均瘤质量的比值;当CDI<1时两药有协同作用,当CDI<0.7时协同作用非常显著。按照金氏公式计算Q值来判断两种药物联合效应:Q=E(A+B)/[EA+(1-EA)×EB],其中E(A+B)为两种药物联合的抑瘤率,EA、EB为两种药物单用的抑瘤率;Q为0.85~1.15表示两药作用相加,Q>1.15表示两药作用协同,Q<0.85表示两药作用相互拮抗[5]。
1.3.5病理变化 于接种后第10天处死动物。各组均取2块肿瘤组织分别置于10%中性甲醛溶液中固定,标本经乙醇梯度脱水,石蜡包埋,制作切片,再经HE染色,以显微镜观察及IDA-2000高清晰度数码显微图像分析系统制出彩图。
1.3.6细胞凋亡情况 在400倍光学显微镜下观察TUENL染色切片,每张切片随机选取9个视野,计数每个视野内的阳性细胞个数,结果以这9个视野内阳性细胞数进行平均计算。阳性细胞的计数标准:细胞核染色呈棕黄色,大致为圆形或椭圆形,阳性细胞与周围组织之间有少许的孔隙。计数结果为健康的肿瘤组织中阳性细胞数,坏死组织不计算在内[6]。

2 结 果
2.1各组荷瘤鼠习性变化 接种后第1—3天,各组小鼠饮食、饮水、精神、活动方面无明显改变。接种后第4天,可触及各组小鼠右前肢腋下微小结节,各组比较差异无统计学意义(P>0.05)。第5天,对照组小鼠肿瘤结节明显增大,且精神状态欠佳,不活泼;环磷酰胺组、红三叶联合环磷酰胺各组较红三叶各剂量组小鼠饮食、饮水、精神情况欠佳。第6—8天,各组小鼠的饮食、饮水均减少,精神萎靡,毛发无光泽,蜷卧,不喜活动,以对照组表现最明显,且肿瘤结节最大,活动受限最明显。实验过程中各组各有1只小鼠死亡,可能与实验操作有关。
2.2各组荷瘤鼠肿瘤体积比较 各组种植肿瘤的体积逐渐增大,且呈局部结节状生长,以对照组小鼠肿瘤结节增大最明显,速度也最快。第5天时,各给药组瘤体体积均明显小于对照组(P均<0.05),红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组瘤体体积与环磷酰胺组相比差异无统计学意义(P>0.05)。第7天时,各给药组瘤体体积均明显小于对照组(P均<0.01),红三叶中剂量+环磷酰胺组瘤体体积明显小于环磷酰胺组(P<0.05)。第9天时,各给药组瘤体体积均明显小于对照组(P均<0.01),红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组瘤体体积均明显小于环磷酰胺组(P均<0.05)。红三叶对肿瘤体积的影响随剂量的增加而增强。见表1。
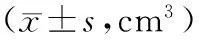
表1 各组U14荷瘤鼠不同时间肿瘤体积比较
注:①与对照组比较,P<0.01;②与对照组比较,P<0.05;③与环磷酰胺组比较,P<0.05。
2.3各组荷瘤鼠瘤质量及给药各组抑瘤率比较 红三叶低剂量组、红三叶中剂量组瘤质量与对照组相比差异无统计学意义(P均>0.05);环磷酰胺组、红三叶高剂量组、红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组瘤质量均明显低于对照组(P均<0.05)。红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组瘤质量和抑瘤率明显低于环磷酰胺组(P均<0.05),红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组瘤质量和抑瘤率明显低于红三叶高剂量组(P均<0.05),红三叶低剂量+环磷酰胺组瘤质量和抑瘤率与红三叶中剂量+环磷酰胺组相比差异无统计学意义(P均>0.05)。见表2。

表2 各组U14荷瘤鼠瘤质量及给药各组抑瘤率比较
注:①与对照组比较,P<0.01;②与对照组比较,P<0.05;③与环磷酰胺组比较,P<0.05;④与红三叶高剂量组比较,P<0.05。
2.4红三叶与环磷酰胺联合对U14荷瘤鼠肿瘤的作用 根据公式计算,红三叶低剂量+环磷酰胺组Q=2.76,CDI=0.57;红三叶中剂量+环磷酰胺组Q=2.09,CDI=0.61。提示红三叶与环磷酰胺联用具有非常显著的协同作用,其中红三叶低剂量+环磷酰胺组协同作用更显著。
2.5各组荷瘤鼠胸腺、脾脏指数比较 红三叶高剂量组胸腺指数与环磷酰胺组相比差异有统计学意义(P<0.05);其他各组胸腺指数与环磷酰胺组相比差异无统计学意义(P均>0.05),其中红三叶高剂量组的胸腺指数最高。各组间脾脏指数相比差异均无统计学意义(P均>0.05),但随着红三叶剂量的增加,脾脏指数有随之增加的趋势。见表3。
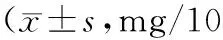
表3 小鼠脾脏指数、胸腺指数 g)
注:①与环磷酰胺组比较,P<0.05。
2.6各组荷瘤鼠肿瘤病理形态学比较 肉眼观察对照组肿瘤的体积最大,环磷酰胺组及联合用药组肿瘤体积明显小于对照组,并可见有的荷瘤鼠在解剖时肿瘤已消失,以联合用药组明显。光镜下对照组肿瘤细胞密集分布,上皮全层极性消失,细胞显著异型,核大,深染,染色质分布不均,有核分裂相,见图1。环磷酰胺组肿瘤组织中可见坏死瘤细胞,见图2。红三叶低剂量组瘤细胞密集,仅见少量坏死灶,有炎细胞浸润,见图3。红三叶中剂量组可见瘤组织大量坏死,瘤块面积缩小,见图4。红三叶高剂量组瘤组织中央大片坏死,见图5。红三叶低剂量+环磷酰胺组瘤组织呈大片坏死,瘤细胞分布不均,见图6。红三叶中剂量+环磷酰胺组肿瘤细胞坏死更明显,周围可见炎细胞浸润,见图7。
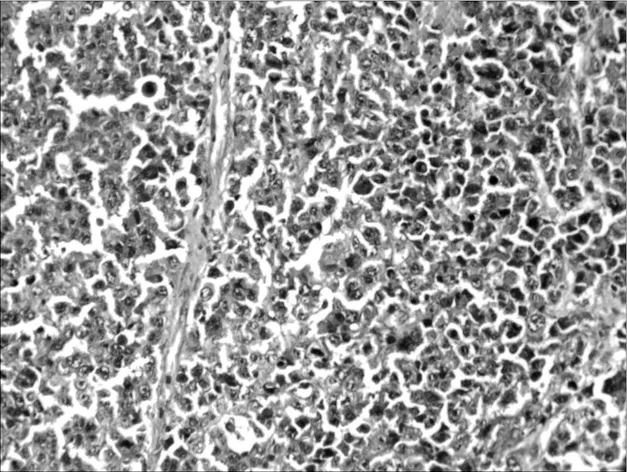
图1 对照组瘤细胞病理形态(200×)
2.7TUENL细胞凋亡检测结果 对照组阳性细胞数目为(3.17±0.40)个/视野,环磷酰胺组为(17.83±1.14)个/视野,红三叶低剂量组为(7.33±0.80)个/视野,红三叶中剂量组为(7.83±2.60)个/视野,红三叶高剂量组为(10.83±2.39)个/视野,红三叶低剂量+环磷酰胺组为(21.17±2.36)个/视野,红三叶中剂量+环磷酰胺组为(37.50±2.92)个/视野。各给药组阳性细胞数均明显多于对照组(P均<0.05)。红三叶低剂量+环磷酰胺组阳性细胞数与环磷酰胺组相比差异无统计学意义(P>0.05),红三叶中剂量+环磷酰胺组阳性细胞数明显多于环磷酰胺组(P<0.01)。
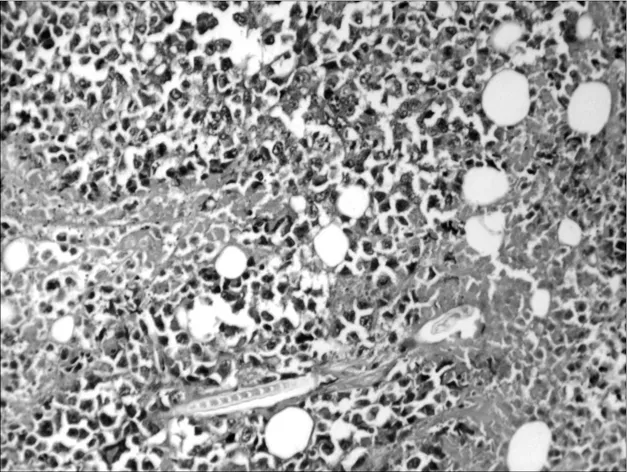
图2 环磷酰胺组瘤组织病理形态(200×)
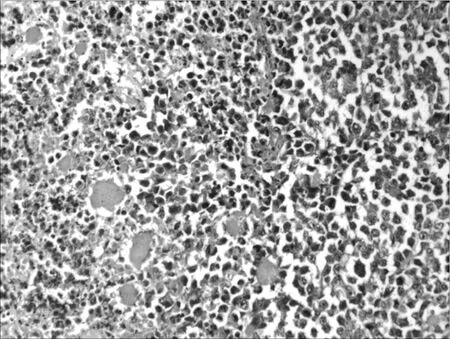
图3 红三叶低剂量组瘤组织病理形态(200×)
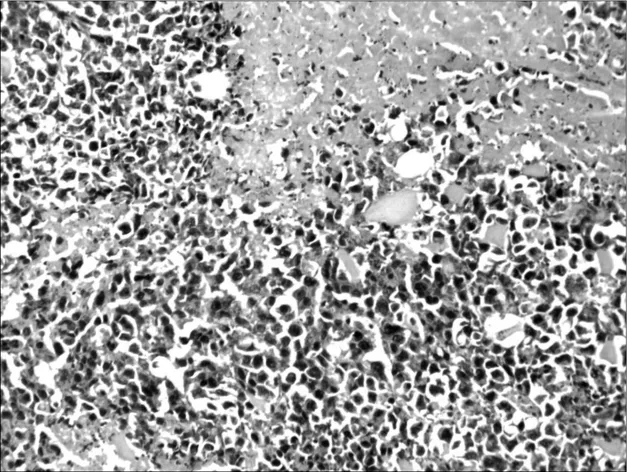
图4 红三叶中剂量组瘤组织病理形态(200×)
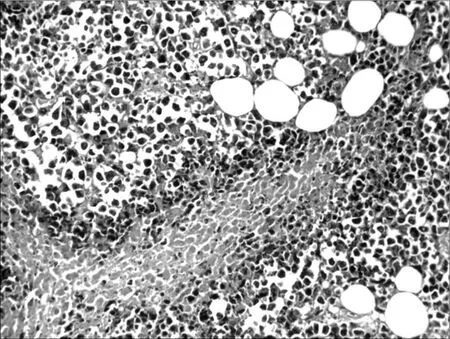
图5 红三叶高剂量组瘤组织病理形态(200×)
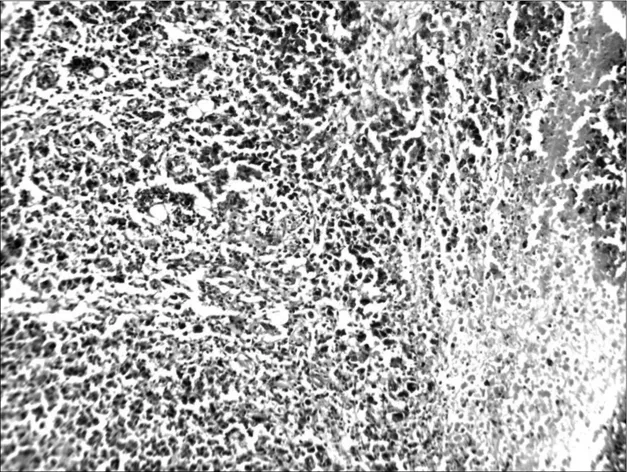
图6 红三叶低剂量+环磷酰胺组瘤组织病理形态(200×)
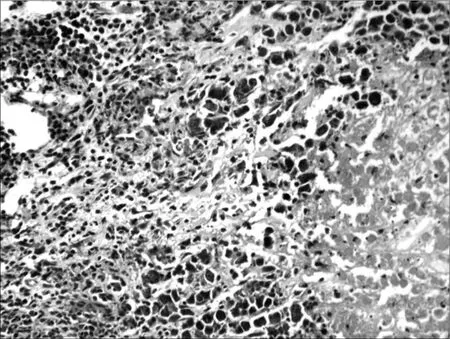
图7 红三叶中剂量+环磷酰胺组瘤组织病理形态(200×)
3 讨 论
本实验采用动物移植性肿瘤的方法造模,优点为实验动物同时接种同量的肿瘤细胞,生长速率比较一致,个体差异小,接种成活率高,对宿主的影响类似,易于客观判断疗效;实验周期较短,实验条件易于控制[7]。接种后第4天各组荷瘤鼠均可触及右前肢腋下小结节,第5天对照组小鼠肿瘤结节比给药各组明显增大,说明模型的建立是成功的。
环磷酰胺作为抗肿瘤药物已在临床广泛应用,其对多种恶性肿瘤具有临床效果,然而环磷酰胺也是一种强免疫抑制剂,能抑制细胞的增殖,对体液免疫和细胞免疫均有抑制作用,因此在治疗肿瘤的同时也会带来不良反应[8]。红三叶为豆科多年生草本植物,含有多种异黄酮类物质,是我国的特色天然药物之一,故也称红三叶异黄酮[1],其抗肿瘤、抗氧化、提高机体免疫功能备受关注。笔者在本实验前对红三叶提取物最大耐受量的实验中证明红三叶安全无毒。
抑瘤率是衡量一种药物抗肿瘤有效性的最基本和最重要的一个指标,《现代肿瘤治疗药物学》关于抗肿瘤中草药有效性的标准是抑瘤率>30%[9]。本实验结果提示,红三叶高剂量组、红三叶低剂量+环磷酰胺组、红三叶中剂量+环磷酰胺组U14荷瘤小鼠的平均瘤质量均低于对照组,抑瘤率均达到有效标准,且红三叶低剂量和红三叶中剂量与环磷酰胺联用时抑瘤率最佳,而红三叶低剂量和中剂量组的抑瘤率均小于30%,所以单用红三叶的药物剂量不能小于400 mg/kg。从肿瘤生长体积变化上也可以看出,红三叶低、中、高组随着剂量的增加瘤体积逐渐呈减小趋势,其中环磷酰胺组及联合用药组有的荷瘤鼠在解剖时肿瘤已消失,并以联合用药更明显,说明环磷酰胺及联合用药对肿瘤生长的抑制作用更强。从计算的CDI及Q值可以看出,红三叶与环磷酰胺联用具有协同作用,并以红三叶低剂量+环磷酰胺组协同作用更显著,这一结果有待增加样本量来进一步证实。
细胞凋亡的检测可以从分子水平揭示药物作用的机制。细胞凋亡是细胞程序性死亡的一种形式,是由细胞内特定的基因操纵和调控的细胞自杀性行为[6]。细胞凋亡可防止因基因突变等因素引起的细胞大量增殖,在维持机体正常发育及组织稳定中发挥着重要作用,并与肿瘤的发生和进程有密切关系。TUENL细胞凋亡检测是检测细胞凋亡敏感性和特异性较高的实验。本实验TUENL细胞凋亡检测结果显示,各给药组阳性细胞数均明显多于对照组,红三叶中剂量+环磷酰胺组阳性细胞数明显多于环磷酰胺组。表明红三叶能诱导U14宫颈癌细胞株的凋亡,并随着药物剂量的增加而明显,红三叶中剂量联合环磷酰胺的凋亡作用优于单用环磷酰胺。通过计算荷瘤鼠胸腺和脾脏指数,同样看出随着红三叶剂量的增加,胸腺和脾脏指数也随着增加。但红三叶能否增加机体免疫功能,减少环磷酰胺药物剂量和不良反应还有待进一步探讨,红三叶与环磷酰胺联合作为临床治疗宫颈癌的辅助药物值得关注。
[1] 陈学福,史高峰. 红三叶异黄酮的研究进展[J]. 中草药,2006,37(2):309-312
[2] 师旭彤,郭凤霞,祁娟. 红三叶异黄酮抗氧化功能及其药理作用研究进展[J]. 草原与草坪,2012,32(4):74-79
[3]XuT,ZhangS,ZhengL,etal.A90-daysubchronictoxicologicalassessmentofdioscin,anaturalsteroidsaponin,inSprague-Dawleyrats[J].FoodChemToxicol,2012,50(5):1279-1287
[4] 杨镇. 肿瘤免疫学[M]. 武汉:湖北科学技术出版社,1998:98
[5] 孙倩. 热疗联合紫杉醇对动物接种肿瘤抑制作用的实验研究[J]. 天津医科大学学报,2012,18(3):309-311
[6] 孙建平,谭竹钧,韩雅莉. 细胞凋亡检测方法的研究进展[J]. 生物技术通报,2012,21(1):54-59
[7] 刘华刚,刘丽敏,黄慧学,等. 抗肿瘤中药模型及机制研究进展[J]. 现代生物医学进展,2008,8(7):1224-1336
[8] 张云波. 环磷酰胺对免疫系统的影响[J]. 安徽农业科学,2013,41(30):12040-12042
[9] 廖子君,南克俊,韩军. 现代肿瘤治疗药物学[M]. 西安:世界图书出版公司,2002:8
Experimental study of red clover associated with cytoxan on mice inoculated with cervical cancer cell(U14)
FA Hongwen1,SUN Qian2
(1.Tianjin University of Traditional Chinese Medicine,Tianjin 300073,China;2. The People’s Hospital of Tianjin,Tianjin 300121,China)
Objective It is to observe the inhibitory effect of red clover associated with cytoxan on mice inoculated with cervical cancer(U14). Methods The suspension of U14 was inoculated subcutaneously in right axillary of the mice, then they were divided randomly into 7 groups, namely cytoxan group(CTX), red clover of low dosage group(RCIL), red clover of mid dosage group(RCIM), red clover of high dosage group(RCIH), RCIL+ CTX group, RCIM + CTX group and control group. Control group was given Carboxymethylcellulose, and the other groups were given respective drugs by intragastric administration and intraperitoneal injection. All the mice were treated for 6 days, the diet, spirit, activity, and the size of tumor were observed everyday. On the 10th day, the body weight of the mice was measured and was put to death by drawing spinal card. The tumor weight was measured. The inhibitory rate of tumor of each group, the value of CDI and Q was calculated. The pathological changes were observed under microscope. The apoptosis was checked with TUNEL. Results In control group, the size of tumor was greatest,and the growth speed was the fastest.The RCIH group,RCIL+CTX group, RCIM + CTX group all had the inhibitory effect, achieved effective standard, and prompted us red clover only could not be less than 400 mg/kg.Red clover could induce apoptosis of U14, especially the drug measurement increasing. RCIM + CTX was better than the CTX, red clover combining with cytoxan had synergistic.Conclusion Red clover has obvious inhibitory effect in mice inoculated U14, and the combined test group is the most obvious, which indicate that RCIM combined with CTX should be noted for the assistant treatment of cervical cancer in clinic.
red clover; cytoxan; cervical cancer(U14); inhibitory rate of tumor; apoptosis.
法洪文,女,硕士,研究方向为中西医结合治疗妇科肿瘤。
孙倩,E-mail:zhangmm89@sina.com
10.3969/j.issn.1008-8849.2015.29.003
R-332
A
1008-8849(2015)29-3199-05
2015-06-01

