染料木素对UVA诱导成纤维细胞急性光损伤的防护作用
宗兴燕 杨秀华 陈宏泉 王 璐 陆晓鸥
日光中的长波紫外线(UVA)是皮肤光损伤的主要原因,它具有较强的穿透力,约20%~30%能够穿过表皮到达真皮引起胶原蛋白减少和异常弹力纤维沉积[1,2]。短时间大剂量照射UVA可致皮肤出现疼痛性红斑、水疱及发热、恶心等急性光损伤表现,同时UVA可诱导活性氧生成,引起氧化应激反应,致使成纤维细胞损害或凋亡[3,4]。研究表明大豆异黄酮能预防紫外线照射所致的皮肤损伤,染料木素是大豆异黄酮中的一种有效成分,具有与雌激素相似作用[5,6],可抗氧自由基损伤,促进人皮肤成纤维细胞的胶原蛋白合成,减轻辐射的损伤[7]。
本实验根据参考文献及预实验选用10 J/cm2UVA照射成纤维细胞建立急性光损伤模型[8],以染料木素为光防护剂,检测染料木素对UVA所致成纤维细胞光损伤过程中细胞凋亡、Sirt1mRNA表达的影响,以探讨染料木素对UVA诱导成纤维细胞急性光损伤的防护作用。
1 材料与方法
1.1 材料与仪器 100 mmol/L染料木素由青岛大学陈文芳老师惠赠,用DMSO稀释成相应浓度。实验使用的皮肤标本取自包皮切除术切除的人正常包皮,供皮者年龄为15~25周岁,由青岛大学医学院附属医院低温医学科提供。紫外辐照仪,紫外灯管由北京师范大学光电仪器厂制造(波长320~400 nm,峰值365 nm);CCK8试剂盒、流式试剂盒、RT-PCR试剂盒购自Takara公司;凝胶成像分析仪由法国VILBE R LOURMAT制造。
1.2 方法
1.2.1 实验分组将成纤维细胞分为7组。A组:空白对照组,不照射UVA,不加染料木素;B组:UVA照射对照组,加10-3μmol/LDMSO;C组:0.01 μmol/L染料木素组;D组:0.1 μmol/L染料木素组;E组:1 μmol/L染料木素;F组:10 μmol/L染料木素组;G组:100 μmol/L染料木素组;C~G组均照射UVA。
1.2.2 成纤维细胞培养 成纤维细胞用10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖培养基,在37℃、体积分数为5% CO2的细胞培养箱中培养,取对数生长期的细胞用于实验。
1.2.3 照射方法 待成纤维细胞贴壁生长至80%左右融合时,从细胞培养箱中取出,无菌条件下加入不同浓度染料木素。空白对照组只加成纤维细胞专用培养基以使各孔的终体积相等。细胞放入37℃、体积分数为5% CO2细胞培养箱中孵育24 h后,除空白对照组外,其余组均照射UVA,照射剂量为10 mJ/cm2,照射垂直距离为10 cm。
1.2.4 CCK8法检测细胞存活率 选用对数生长期的贴壁成纤维细胞,用0.25%胰蛋白酶消化制成单细胞悬液后,将细胞密度调整为5×104个/mL,每孔接种100 μL的细胞悬液于96孔培养板中,置于5% CO2及饱和湿度下的培养箱内37℃培养12 h。每孔加入不同浓度染料木素,每组5个复孔,对照组加入相同体积培养基,置于37℃、5% CO2和饱和湿度下的培养箱内,继续培养12 h 和24 h。终止培养前1 h,每孔加入100 μL CCK8溶液,混匀,在细胞培养箱继续孵育1 h后,于酶标仪上490 nm波长处检测各孔的光密度OD值。
1.2.5 细胞凋亡检测 细胞经不同浓度染料木素处理并接受UVA照射后18 h,检测细胞凋亡率。采用流式细胞仪检测:用PBS洗涤,离心收集细胞(1000 r/min,5 min),弃上清,用缓冲液重新悬浮细胞,细胞计数后将浓度调整到1×106个/mL,按照Annenxin V-FITC凋亡检测试剂盒说明书操作规程检测细胞凋亡率。用流式细胞仪检测荧光强度。用专用Cell Quest软件将所得数据采进行收集、储存和分析各组HaCat细胞的凋亡率。
1.2.6 Sirt1mRNA表达量 细胞经不同浓度染料木素处理并接受UVA照射后18 h,用RT-PCR法检测Sirt1mRNA表达量,凝胶成像系统分析目的条带Sirt1/GAPDH的灰度比值并进行统计分析。Sirt1及GAPDH引物序列、反应条件、扩增产物分子量见表1。
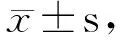
2 结果
2.1 染料木素对UVA照射后成纤维细胞增值活性的影响 染料木素对UVA照射后成纤维细胞增值活性的分析见图1,表2。与A组比较,照射对照组细胞OD值明显减少(P<0.05),说明UVA可明显抑制成纤维细胞增殖活性,各实验组间C~F组的细胞OD值明显高于B组,差异有统计学意义(P<0.05),说明0.01 μmol/L~10 μmol/L的染料木素可以降低UVA对成纤维细胞增殖活性的抑制作用,其中D组与E组细胞OD值高于其他实验组,差异有统计学意义(P<0.05)。
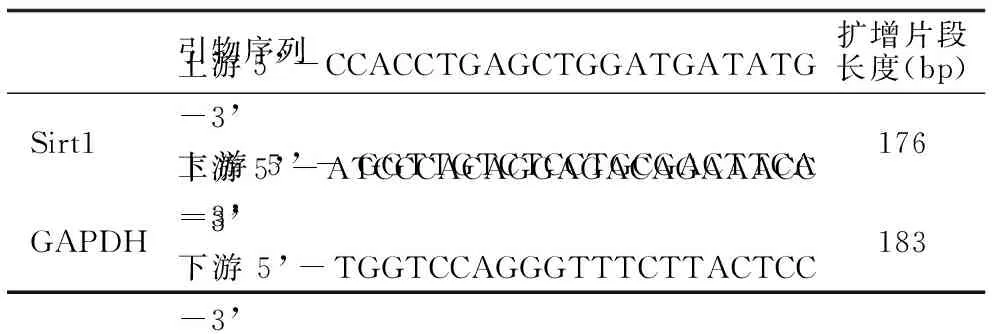
表1 GAPDH为内参Sirt1为目的引物序列

注:*其它组与B组比较:P<0.05
图1 A~G为CCK8检测UVA照射后各组成纤维细胞的OD值
2.1 染料木素对UVA照射后成纤维细胞凋亡率的影响 染料木素对UVA照射后成纤维细胞凋亡率结果分析见图2,表2:与A组比较,照射对照组细胞凋亡率明显增加(P<0.05),C~F组的细胞凋亡率明显低于B组,差异有统计学意义(P<0.05),而B组与G组比较,细胞凋亡率的差异无统计学意义(P>0.05);各实验组中E组凋亡率最低, 差异有统计学意义(P<0.05)。
2.2 染料木素对UVA照射后成纤维细胞Sirt1mRNA表达的影响 各组均有Sirt1mRNA的表达,GAPDH对照均出现明显扩增条带,表明各组细胞中RNA的质量及RT-PCR过程均良好,各组Sirt1/GAPDH相对表达量见表1,图3。与A组比较照射组B~G组表达量增多,差异有统计学意义(P<0.05),各实验组中,与B组比较,C~F组表达量增多,差异有统计学意义(P<0.05),其中E组表达量最多,差异有统计学意义(P<0.05)。

表2 染料木素对UVA照射后成纤维细胞凋亡率及OD值的影响
注:▲与A组比较:P<0.05;*与B组比较:P<0.05;○与C组比较:P<0.05;#与D组比较:P<0.05;◆与E组比较:P<0.05;+与F组比较:P<0.05;☆与G组比较:P<0.05

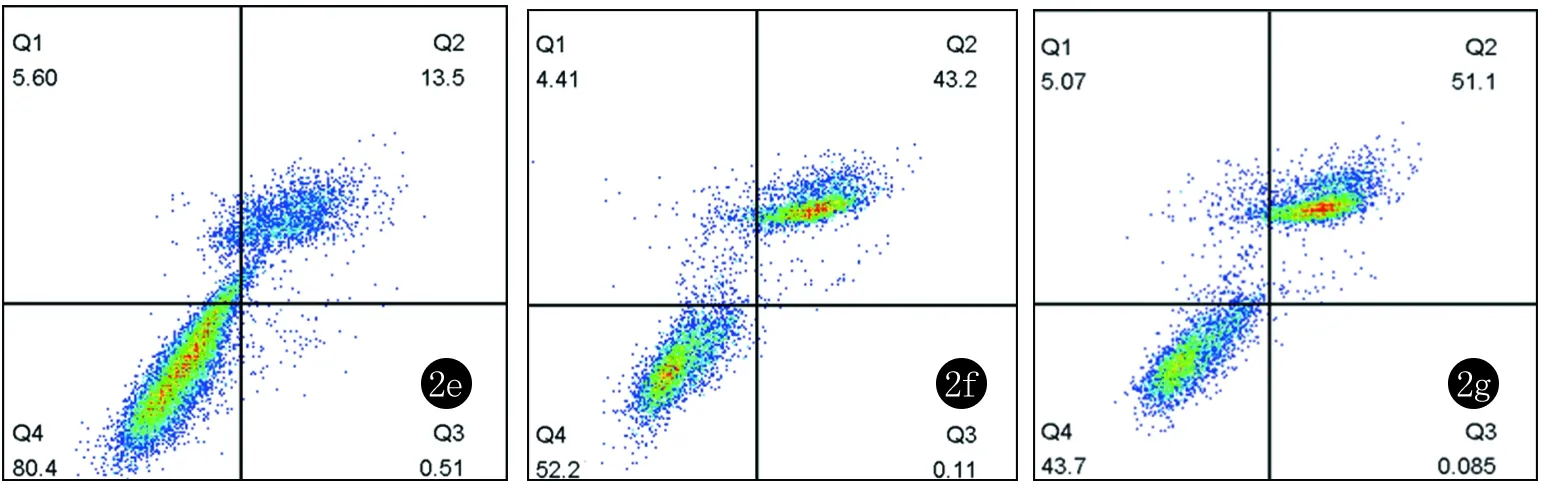
图2 a~g为流式细胞仪检测A~G组成纤维细胞凋亡的结果
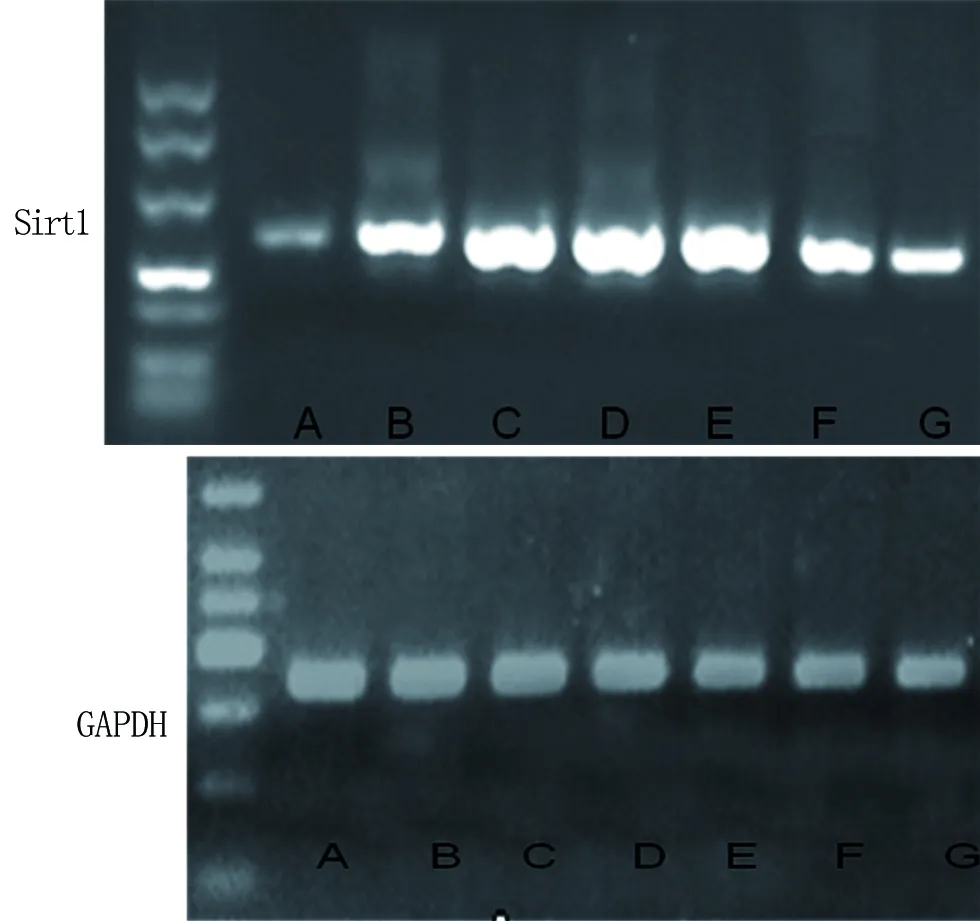
图3 各组PT-PCR扩增电泳结果
3 讨论
皮肤作为人体最大的感觉器官,又是预防机械、物理、化学损伤及微生物感染的第一道防线[9],在机体调节中发挥着重要作用,同时皮肤的活性与美感直接影响人体日常生活和身心健康,因而预防紫外线对皮肤的光损伤是近年来皮肤研究领域中的热门课题。UVA属于长波紫外线,具有较强的穿透能力,能穿过表皮到达真皮引起胶原成分的减少和异常弹力纤维沉积,引起真皮成纤维细胞DNA损伤、氧化应激、细胞凋亡。
“人类长寿基因”SIRT1是一种NAD+依赖的去乙酰化酶类,参与体内多种生理功能的调节,如基因沉默、机体生长、能量代谢、生物周期节律、新陈代谢等。近期研究表明,SIRT1可通过调节自噬系统或保护端粒长度对皮肤光老化起保护作用[10],同时可以通过组蛋白/非组蛋白去乙酰化的作用发挥其抗氧化应激、抗炎、抑制细胞凋亡等作用[11]。P53基因是一种抑癌基因,在发生DNA损伤时被激活的P53蛋白表达增加,抑制周期蛋白激酶的活性,使细胞周期停滞于G1期[12]。SIRT1能与P53底物紧密结合,同时使P53蛋白的382位赖氨酸发生去乙酰化,阻碍P53基因的表达[13],从而抑制细胞的凋亡。
研究表明雌激素受体β已成为皮肤光损伤新的治疗靶点[15],染料木素是一种大豆异黄酮类植物雌激素,其化学结构与17-β雌二醇相似,能与雌激素受体β结合,通过抑制炎症因子、金属蛋白酶及cox2的活性而使皮肤减少或避免光损伤。此外,染料木素可减少脂质过氧化物及硝基酪氨酸,促进细胞增殖和DNA的修复[16]。
本实验结果显示,与空白对照组比较,照射对照组成纤维细胞增殖活性明显降低(P<0.05),凋亡率明显增加(P<0.05),成纤维细胞Sirt1mRNA表达量明显增加(P<0.05),表明UVA照射成纤维细胞后可抑制细胞增殖导致细胞凋亡率、Sirt1mRNA表达量增加,验证了SIRT1光保护作用。相对于照射对照组,C~F组细胞增值活性明显升高,Sirt1mRNA表达明显增多,而细胞凋亡率明显减少,差异均有统计学意义(P<0.05),表明染料木素可能通过调控SIRT1基因从而抑制细胞凋亡,这与染料木素对缺血/再灌注肾损伤保护机制的研究结果相似[16]。目前染料木素调控SIRT1基因机制仍不明确,Hsu等[17]等研究者发现染料木素可能通过增加腺苷酸活化蛋白激酶的活性从而刺激SIRT1基因的表达。
研究结果发现染料木素在0.01 μmol/L~10 μmol/L浓度内可降低UVA对成纤维细胞增殖活性的抑制作用,增加Sirt1mRNA的表达量,降低UVA所致成纤维细胞的凋亡率,说明染料木素在一定浓度内对UVA具有防护作用。
综上所述,我们认为染料木素在一定浓度内(0.01 μmol/L~10 μmol/L)对UVA致成纤维细胞急性光损伤有防护作用,其作用机制可能与调控成纤维细胞Sirt1mRNA的表达水平有关。
参考文献
[1] Battie C, Jitsukawa S, Bernerd F, et al. New insights in photoaging, UVA induced damage and skin types[J]. Exp Dermatol,2014,23 Suppl 1(s1):7.
[2] Hahn HJ, Kim KB, Bae S, et al. Pretreatment of ferulic acid protects human dermal fibroblasts against Ultraviolet A Irradiation[J]. Ann Dermatol,2016,28(6):740.
[3] Gęgotek A, Bielawska K, Biernacki M, et al. Time-dependent effect of rutin on skin fibroblasts membrane disruption following UV radiation[J]. Redox Biol, 2017, 12(C):733-744.
[4] Ji C, Huang JW, Xu QY, et al. Gremlin inhibits UV-induced skin cell damages via activating VEGFR2-Nrf2 signaling[J]. Oncotarget, 2016, 7(51):84748.
[5] 曹琦琪, 刘子业, 郑幽,等. 异黄酮预防紫外线照射所致小鼠皮肤损伤[J]. 第二军医大学学报, 2017, 38(8):1028-1033.
[6] 王艺臻,徐征丽. 染料木素对大鼠髁突软骨改建影响的初步研究[J]. 医学研究杂志,2011,40(7):81-84.
[7] 李林,瞿小婷,陆阳. 植物雌激素的筛选及抗皮肤老化的体外研究[J]. 上海交通大学学报:医学版,2011,31(10):1361-1365.
[8] 侯巍, 郑跃, 许庆芳,等. UVA致人皮肤成纤维细胞急性和慢性光损伤模型的建立[J]. 临床皮肤科杂志, 2014, 43(12):703-706.
[9] Wu Z, Zhang L. Polycomb group proteins: Novel molecules associated with ultraviolet A-induced photoaging of human skin[J]. Exp Ther Med,2017,14(3):2554-2562.
[10] Lim CJ, Lee YM, Kang SG, et al. Aquatide activation of SIRT1 reduces cellular senescence through a SIRT1-FOXO1-Autophagy Axis[J]. Bio Ther,2017,25(5):511.
[11] 杨熙. SIRT1氧化应激通路与疾病的关系[J]. 西部医学, 2015, 27(8):1275-1278.
[12] 卞彩云,蒋献.紫外线辐射诱导角质形成细胞凋亡的机制[J].国际皮肤性病学杂志,2006,32(6):374-376.
[13] Luo J, Nikolaev AY, Imai S, et al. Negative control of p53 by Sir2alpha promotes cell survival under stress[J]. Cell, 2001, 107(2):137.
[14] Chang KC, Wang Y, Oh IG, et al. Estrogen receptor beta is a novel therapeutic target for photoaging[J]. Mol Pharmacol,2010,77(5):744.
[15] Terra VA, Souzaneto FP, Frade MA, et al. Genistein prevents ultraviolet B radiation-induced nitrosative skin injury and promotes cell proliferatio[J]. J Photochem Photobiol B,2015,144:20-27.
[16] Li WF, Yang K, Zhu P, et al. Genistein Ameliorates Ischemia/Reperfusion-Induced Renal Injury in a SIRT1-Dependent Manner[J]. Nutrients, 2017, 9(4).
[17] Hsu MH, Savas U, Lasker JM, et al. Genistein, resveratrol, and 5-aminoimidazole-4-carboxamide-1-β-D-ribofuranoside induce cytochrome P450 4F2 expression through an AMP-activated protein kinase-dependent pathway[J]. J Pharmacol Exp Ther,2011,337(1):125.

