β1-肾上腺素受体自身抗体通过促进肝细胞凋亡参与小鼠肝损伤
于海存,杜芸辉,张诗晗,闫 莉,李玉明
(1.首都医科大学 基础医学院 生理学与病理生理学系, 北京 100069; 2.首都医科大学附属安贞医院北京心肺血管疾病研究所,北京 100029;3.中国医学科学院基础医学研究所 北京协和医学院基础学院生理与病理生理学系,北京 100005;4.首都医科大学 燕京医学院 基础医学院生理学与病理生理学系, 北京 101300)
慢性肝损伤是全球范围内高致病率、高病死率的肝脏疾病,发病原因主要包括病毒感染、酒精性或非酒精性肝脏疾病、脂质代谢异常、 药物损伤及自身免疫性疾病[1]等,其中交感神经系统的过度激活在肝损伤过程中发挥的作用越来越引起人们的关注[2]。已有的研究发现,在小鼠肝纤维化过程中有β1-肾上腺素受体(β1-AR)的过度表达,而给予β肾上腺素受体阻滞剂可以明显改善肝脏纤维化,这提示β1-AR的过度激活参与了肝损伤的发生发展。近年来发现一种针对于β1-肾上腺素受体细胞外第二环(β1-AR-ECII)的自身抗体(β1-AA),其广泛存在于扩张性心肌病、心律失常等心血管疾病中,可以通过持续激活β1-AR而发挥正性肌力、正性传导和升高细胞内钙离子的受体激动剂样作用。已知肝细胞表面有β1-AR的表达[3],那么循环血液中的β1-AA是否会通过作用于肝脏表面的β1-AR而对肝脏产生影响尚不得而知。
因此,本研究的目的主要是探讨β1-AA对肝脏结构和功能的影响及作用机制,为临床β1-AA阳性患者肝功能损伤的治疗提供新的思路和研究基础。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性BALB/c小鼠,8周龄,体质量(20±2)g[首都医科大学动物中心,实验动物许可证号:SCXK(京)2012-0001];15只SPF级SD大鼠的乳鼠,0~3 d (北京维通利华实验动物技术有限公司);正常肝细胞系QSG7701细胞(中国医学科学院基础研究所细胞中心)。
1.1.2 主要试剂:具有活性的单克隆抗体β1-AA[4]、胰蛋白酶1∶250 (trypsin powder,porcine 1∶250,Sigma-Aldrich公司);Ⅱ型胶原酶(coll-agenase type 2,Worthington公司);Tunel染色试剂盒(Roche公司);annexin V/PI凋亡试剂盒(Invitrogen公司);caspase 3活性检测试剂盒(Biomol公司);美托洛尔(metoprolol tar-trate,Abcam公司);2,2-azino-di (3-ethylbenzothiazoline) sulphonic acid (ABTS)-H2O2(Roche公司)。
1.2 方法
1.2.1 动物分组及处理:以5 μg/g的β1-AA进行小鼠腹腔注射,每2 周给药1次,连续给药20 周,同期设置IgG阴性对照组。采用本实验室改良的酶联免疫吸附法(ELISA)动态监测血清中1-AA的含量[5]。
1.2.2 乳鼠心肌细胞跳动频率的检测:将提取的心肌细胞[6]接种于96孔板,培养2~3 d,实验分组为阴性IgG组、β1-AA组(10-7mol/L)、β1-AA(10-7mol/L)+ β1-AR阻断剂metoprolol组(3×10-7mol/L)和单独的metoprolol组(3×10-7mol/L);加入阻断剂1 h后再加入β1-AA作用48 h,显微镜下每组观察7~8个培养孔,每个培养孔随机计数5~8个视野,每个视野每次计数30 s,最后计数分离的单个细胞1 min内同步收缩的次数,验证β1-AA的生物活性。
1.2.3 BALB/c小鼠血清中AST、ALT、GLB和ALB(谷草转氨酶、谷丙转氨酶、球蛋白和白蛋白)水平的检测:通过鼠尾静脉采血收集正常对照组和β1-AA被动免疫组小鼠4、8和12周的血清,委托北京北方生物技术研究所用速率法检测血清中AST、ALT、GLB和ALB的浓度。
1.2.4 小鼠肝脏门静脉流速、肝静脉流速和肝脏直径的检测:将对照组和β1-AA被动免疫组小鼠在0、8周时,分别仰卧固定,于1.5%体积浓度的异氟烷吸入麻醉下,剪去腹部鼠毛后涂以耦合剂,用高频线阵探头 (75 MHz)探测肝脏大小、回声状况、肝静脉和门静脉血管内径,所有数据均测量3次并取其平均值。
1.2.5 Tunel染色检测肝细胞凋亡:肝组织用10%甲醛固定,分级乙醇(85%、95%和100%)脱水。在二甲苯中渗透后,石蜡包埋。将石蜡块切成4 μm切片,按试剂盒说明书所述进行Tunel染色,每张载玻片选取5~8个视野,计算凋亡细胞核的百分比,评估细胞凋亡指数。
1.2.6 AnnexinV/PI检测肝细胞凋亡:将QSG7701细胞以(1~5)×105/孔接种到6孔板,过夜,分别设置阴性IgG组(10-7mol/L)、β1-AA组(10-7mol/L)和β1-AA+metoprolol(3×10-7mol/L)组,作用24 h,根据说明书进行操作,利用流式细胞仪进行检测。
1.2.7 肝细胞caspase 3活性的检测:将QSG7701细胞以1×105/孔接种到12孔板,待其增殖良好,分别设置阴性IgG组(10-7mol/L)、不同浓度的β1-AA组(10-6、10-7和10-8mol/L)及β1-AA+metoprolol(3×10-7mol/L)组,作用24 h,按照说明书进行操作,最后利用荧光酶标仪检测荧光度值(Ex: 400 nm,Em 508 nm)。
1.3 统计学分析
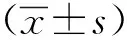
2 结果
2.1 成功制备β1-AA单克隆抗体,并建立β1-AA被动免疫小鼠模型
β1-AA与IgG具有相同的蛋白条带,重链分子质量55 ku,轻链25 ku(图1A);该单克隆抗体可以增加乳鼠心肌细胞跳动频率(P<0.01),β1肾上腺素受体阻滞剂metoprolol可以部分逆转这一效应(图1B);在β1-AA被动免疫小鼠第4 周,外周血清β1-AA浓度明显上升(P<0.05),随后,被动免疫组小鼠血清中β1-AA浓度相对于正常对照组都明显升高,提示被动免疫小鼠模型建立成功(图1C)。
2.2 β1-AA长期被动免疫导致小鼠肝损伤
β1-AA免疫组小鼠血清中ALT、AST在被动免疫第8 周时明显升高(P<0.05),ALB下降(P<0.01)(图2)。
2.3 β1-AA长期被动免疫致小鼠肝脏门静脉流速和肝静脉流速降低
β1-AA长期被动免疫小鼠第8 周时,肝静脉血流速(HPV)和门静脉流速(MPV)明显降低(表1)。
2.4 β1-AA长期被动免疫过程中小鼠肝细胞发生凋亡
β1-AA免疫第8 周肝组织凋亡的肝细胞核百分比为8.00%±0.02%,显著高于对照组的2.30%±0.03%(图3)。
2.5 β1-AA通过β1-肾上腺素受体促进肝细胞系QSG7701发生凋亡
Annexin V/PI染色发现β1-AA(10-7mol/L)可以促进正常肝细胞系QSG7701发生凋亡,当给予β1肾上腺素受体阻滞剂metoprolol(3×10-7mol/L)后,可以逆转这一效应(P<0.05)(图4A),但并不能完全逆转;caspase 3活性检测发现,不同浓度的β1-AA(10-6、10-7及10-8mol/L) 促进肝细胞caspase 3活性增加,而β1-AR特异性阻断剂metoprolol可以部分逆转此效应(图4B)。
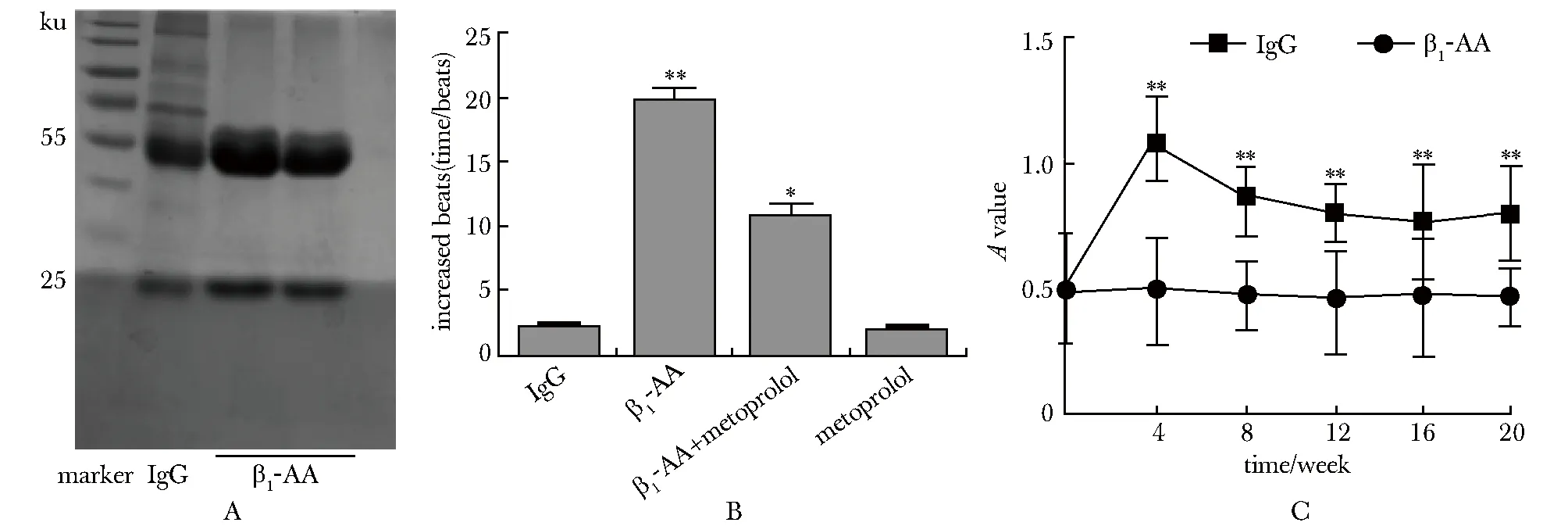
A.β1-AA had the same molecule mass as commercial mice IgG tested by Coomassie brilliant blue staining; B.β1-AA that was synthesised had the biological activity; C.the serum value of β1-AA in the passive immunization model was higher than the negative IgG group;*P<0.05,**P<0.01 compared with IgG group
图1具有生物活性的β1-AA单克隆抗体及β1-AA被动免疫模型小鼠的鉴定
Fig1Identificationofthebiologicallyactiveofβ1-AAandpassiveimmunizationmicemodel

*P<0.05, **P<0.01 compared with IgG group图2 β1-AA被动免疫小鼠过程中肝脏生化学指标的变化Fig 2 Changes of biochemical indexes in liver during the β1-AA passive n=6)

groupHPV/(mm/s)MPV/(mm/s)hepatictransfer/mmIgG 24.5±2.3 70.0±1.820.0±0.9β1-AA 19.3±1.3* 8.0±2.1**21.0±1.3
HPV.hepatic vein velocity; MPV.portal vein velocity;**P<0.05,*P<0.01 compared with IgG group.
3 讨论
已知β1-AA最早是在扩张性心肌病患者体内发现的,可以结合β1肾上腺素受体细胞外第二环而致受体持续激活,是一种潜在的损伤因子。β1-AA作为机体免疫系统的产物,它可以促进小鼠源性巨噬细胞系RAW264.7细胞分泌TNFα[7], 而β1-AR的激动剂异丙肾上腺素(ISO)可以抑制LPS诱导的RAW264.7细胞分泌TNFα[8]。 提示,β1-AA可能与β1-AR激动剂效应不同。同时,有文献报道β1-AA可以通过作用于T淋巴细胞增加胰岛素抵抗,进而影响血糖水平[9]。这进一步说明β1-AA和机体的免疫系统密不可分。肝脏是机体免疫反应系统的重要器官之一,β1-AA在导致心功能下降的同时,它对肝功能的影响是怎样的目前并不清楚。本研究发现,β1-AA可能通过作用于肝细胞表面的β1-AR导致肝细胞凋亡,进而引起肝功能受损。
为了明确β1-AA对肝脏的影响,本研究首先构建了一种针对β1-AR细胞外第二环,并且与患者血清中的β1-AA具有相同生物学效应的单克隆抗体,即β1-AA,排除了其他非特异性抗体的干扰。另外,采用β1-AA长期被动免疫小鼠模型能够更好的模拟临床疾病,并且有效的排除了抗原肽段的影响。
本研究连续选取β1-AA被动免疫小鼠0、4、8和12周为监测点, 动态观察了小鼠肝功能的变化。

图3 β1-AA被动免疫过程中小鼠肝细胞的变化Fig 3 Hepatocytes changes during the β1-AA passive immunization
血清ALT水平和AST水平常被用作临床试验肝功能的生物学标志物[10]。当肝脏长期受损时,ALB合成降低[11]。在本研究中,初步得到在被动免疫小鼠第8 周时ALT、AST明显升高,ALB明显下降。提示,β1-AA长期作用会导致肝损伤。肝脏超声结果提示,在β1-AA长期作用下肝静脉和门静脉流速明显下降,而肝脏大小尚无出现明显的变化。肝组织切片、Annexin V/PI染色和肝细胞caspase 3活性检测进一步验证了β1-AA对肝细胞的直接损伤作用,而β1-肾上腺素受体阻滞剂可以部分逆转这一效应,提示β1-AA可能通过β1-肾上腺素受体途径引起肝细胞凋亡,但并不能排除还有其他作用途径存在,比如非β1-肾上腺素受体途径。本研究初步阐明了β1-AA在导致心功能损伤的同时可能通过肝细胞表面的β1-AR致肝细胞凋亡,进而导致肝功能下降,为临床肝损伤发生发展的机制研究提供新的思路和实验基础。

A.the apoptosis of hepatocytes induced by β1-AA; B.the caspase- 3 relative activity of hepatocytes induced by different ooncentrative of β1-AA;*P<0.05,**P<0.01 compared with IgG group;#P<0.05 compared with 10-7β1-AA group;##P<0.01 compared with β1-AA group

参考文献:
[1] Garioud A, Cadranel JF.Autoimmune hepatitis [J]. Rev Prat, 2015, 65: 163- 169.
[2] 刘娜,张晓岚,梁传栋,等.肝脏纤维化过程中去甲肾上腺素各受体亚型表达的动态变化[J]. 中华肝脏杂志, 2009, 17:653- 656.
[3] Takahata T,Yasui-Furukori N,Sakamoto J,etal. Influence of hepatic impairment on the pharmacokinetics and pharmacodynamics of landiolol hydrochloride, an ultra-short-acting beta1-blocker [J]. Drugs R.D:J Drvgs Dermatol,2005, 6: 385- 394.
[4] 杜芸辉, 李笑, 于海存,等. 一种新型 β1肾上腺素受体单克隆抗体的制备及其临床应用[J]. 心肺血管病杂志, 2017, 36: 696- 700.
[5] Yan L, Tan X, Chen W,etal. Enhanced vasoconstriction to α1 adrenoceptor autoantibody in spontaneously hypertensive rats [J]. Sci China Life Sci, 2014, 57: 681- 689.
[6] 董玉,吕婷婷,徐文丽,等.利用SPR检测26肽与 β1-肾上腺素受体自身抗体的相互作用[J]. 首都医科大学学报, 2016, 6:736- 739.
[7] Du Y, Yan L, Du H,etal. β1 -adrenergic receptor autoantibodies from heart failure patients enhanced TNF-α secretion in RAW264.7 macrophages in a largely PKA-dependent fashion [J]. J Cell Biochem, 2012, 113: 3218- 3228.
[8] Avni D,Ernst O, Philosoph A. Role of CREB in modulation of TNFα and IL- 10 expression in LPS-stimulated RAW264.7 macrophages[J]. Mol Immunol, 2010, 47:1396- 1403.
[9] Gong Y, Xiong H, Du Y,etal. Autoantibodies against β1-adrenoceptor induce blood glucose enhancement and insulin insufficient via T lymphocytes [J]. Immunol Res, 2016, 64:584- 593.
[10] Cheng PN, Chiu YC, Chiu HC,etal. The application of liver stiffness measurement in residents without overt liver diseases through a community-based screening program [J]. Medicine (Baltimore), 2016, 95: 3193- 3201.
[11] Liu W,Zheng J,Xing R. Clinical significance of a scoring formula of liver injury for the preoperative evaluation of patients with livercirrhosis [J]. Eur J Gastroenterol Hepatol,2014, 26: 95- 100.

