低氧增强巨噬细胞中脂多糖诱导的IL- 1β表达
白瑜珊,焦时宇,曲爱娟
(首都医科大学 基础医学院 生理学与病理生理学系 重塑相关心血管疾病教育部重点实验室代谢紊乱相关心血管疾病北京市重点实验室,北京100069)
低氧可以诱发炎性反应,尤其在促炎细胞因子白细胞介素1β(interleukin 1β, IL- 1β)的产生过程中发挥重要作用[1- 2]。动脉粥样硬化(atherosclerosis,AS)是一种复杂的慢性炎性反应疾病,IL- 1β在AS发生发展中发挥重要的调控作用[3- 5]。研究表明低氧可以作为一种新的危险信号促进AS斑块内巨噬细胞IL- 1β的产生[1, 6],因此,研究低氧对IL- 1β转录、翻译、成熟和分泌的机制可能对找到治疗AS的新靶点有重要意义。IL- 1β主要来源于巨噬细胞[7],是固有免疫和炎性反应的主要调节因子。脂多糖(lipopolysaccharide, LPS)可促进巨噬细胞IL- 1β的转录和翻译[8],而IL- 1β的加工和分泌主要通过NOD样受体3(nucleotide binding oligomerization domain-like receptor 3, NLRP3)炎性小体激活半胱氨酸天冬蛋白酶1(cysteinyl aspartate specific proteinase 1, caspase- 1)后介导[9]。有研究表明低氧可放大LPS处理后人巨噬细胞中IL- 1β的表达,且介导细胞适应性低氧反应的主要核转录因子1α(hypoxia inducible factor 1α, HIF- 1α)与IL- 1β、caspase- 1在AS斑块巨噬细胞中存在共定位[1]。但低氧对巨噬细胞产生IL- 1β的作用及机制尚不清楚。因而,本文将研究低氧对LPS诱导的巨噬细胞产生IL- 1β的作用及可能机制。
1 材料与方法
1.1 实验材料
1.1.1 动物:具有C57BL/6J背景的巨噬细胞特异性希佩尔林道蛋白(Von Hippel-Lindau, VHL)基因敲除(VhlΔMac/Apoe-/-)小鼠和同窝对照(Vhlfl/fl/Apoe-/-)小鼠(美国国立卫生研究院Frank J.Gonzalez课题组)。小鼠饲养于首都医科大学实验动物中心SPF级动物房,提取腹腔巨噬细胞所用的小鼠均为8~10周龄。实验动物的使用遵循首都医科大学实验动物管理条例,并通过首都医科大学实验动物伦理委员会的批准。
1.1.2 细胞:Abelson小鼠白血病病毒诱导的肿瘤RAW264.7巨噬细胞细胞系(北京市心肺血管疾病研究所所赠)及小鼠原代腹腔巨噬细胞(从VhlΔMac/Apoe-/-小鼠和同窝对照Vhlfl/fl/Apoe-/-小鼠中提取所得)。
1.1.3 主要试剂:DMEM培养基、胎牛血清(fetal bovine serum, FBS)、丙酮酸钠(Hyclone公司);LPS(Sigma-Aldrich公司);Brewer改良巯基乙醇酸盐肉汤(BD公司);反转录试剂盒(Promega公司);RT-qPCR引物(Sangon Biotech公司);RIPA裂解液(Solarbio公司);蛋白酶抑制剂HaltTMProtease Inhibitor Cocktail(Thermo Fisher Scientific公司);核蛋白和胞浆蛋白提取试剂盒(凯基生物公司);β-actin小鼠单克隆抗体、laminB1单克隆一抗和caspase- 1单克隆一抗(Abcam公司);HIF-1α小鼠单克隆抗体(Novus Biologicals公司);NLRP3大鼠单克隆一抗(RD公司);大鼠HRP二抗(中杉金桥生物技术公司);IL- 1β小鼠单克隆抗体、小鼠HRP二抗和兔HRP二抗(Cell Signaling公司)。
1.2 实验方法
1.2.1 RAW264.7的细胞培养及分组处理:将RAW264.7培养在含4×10-3mol/L L-谷氨酰胺、4.5 g/L葡萄糖、1×10-3mol/L丙酮酸钠、1.5 g/L NaHCO3和10% FBS的DMEM完全培养基中,细胞贴壁8~10 h后,用含1% FBS的上述培养基饥饿培养8~10 h,分别于37 ℃、5% CO2、21% O2的培养箱及37 ℃、5% CO2、2% O2的精密三气细胞培养箱中进行细胞的常氧及低氧培养。
实验分组:1)常氧组:常氧(21% O2)培养24 h;2)常氧+LPS组:常氧培养24 h后LPS(5×10-3ng/L)培养4 h;3)低氧组:低氧(2% O2)培养24 h;4)低氧+LPS组:低氧培养24 h后LPS培养4 h。
1.2.2 小鼠腹腔巨噬细胞的提取、培养及分组处理:实验前3 d给予小鼠腹腔注射3%巯基乙醇酸钠,每只2 mL。3 d后提取小鼠腹腔巨噬细胞,种于细胞培养皿中,于37 ℃、5% CO2、21% O2的培养箱中培养。
实验分组:1)对照组:Vhlfl/fl/Apoe-/-及VhlΔMac/Apoe-/-腹腔巨噬细胞给予PBS;2)LPS组:Vhlfl/fl/Apoe-/-及VhlΔMac/Apoe-/-腹腔巨噬细胞LPS(50×10-3ng/L)培养24 h。
1.2.3 总RNA提取和RT-qPCR检测Vegf、Nlrp3、Il1b、Vhl和Il6的mRNA表达水平:利用Trizol有机溶剂抽提法提取细胞总RNA,定量后利用反转录试剂盒将RNA反转成cDNA。利用RT-qPCR检测目的基因mRNA的表达水平(引物序列见表1)。
1.2.4 Western blot检测HIF- 1α、NLRP3、caspase- 1、cleaved caspase- 1、Pro-IL- 1β和IL- 1β的蛋白水平:利用RIPA裂解液及蛋白酶抑制剂提取细胞总蛋白,利用核蛋白和胞浆蛋白提取试剂盒提取细胞核蛋白及细胞浆蛋白。蛋白变性后,经SDS-PAGE凝胶分离,转移到PVDF膜上,5%脱脂牛奶封闭后,孵育一抗及二抗,利用化学发光法显色发光,随后使用Image J进行吸光度值分析的统计。
1.3 统计学分析

2 结果
2.1 低氧可显著升高RAW264.7细胞中Nlrp3和Il1b的mRNA水平
与常氧组相比,低氧能使RAW264.7细胞中Vegf、Nlrp3、Il1b的mRNA水平显著上调(P<0.01)(图1)。
2.2 低氧可升高LPS诱导的RAW264.7细胞中NLRP3、IL- 1β的mRNA及蛋白水平
与常氧组相比,给予LPS培养后,低氧能显著增加LPS诱导的NLRP3和IL- 1β的mRNA及蛋白水平(P<0.01),但不能诱导caspase- 1激活及Pro-IL- 1β剪切。此外,与常氧组相比,给予LPS培养后,低氧联合LPS还能升高HIF- 1α的蛋白水平及其经典靶基因Vegf的mRNA水平(P<0.05)(图2)。

表1 引物序列Table 1 Sequences of primers

*P<0.01, **P<0.001 compared with normoxia group图1 低氧可升高RAW264.7细胞中Nlrp3和Il1b的mRNA水平Fig 1 Hypoxia increased the mRNA levels of Nlrp3 and Il1b in RAW264.7 n≥3)
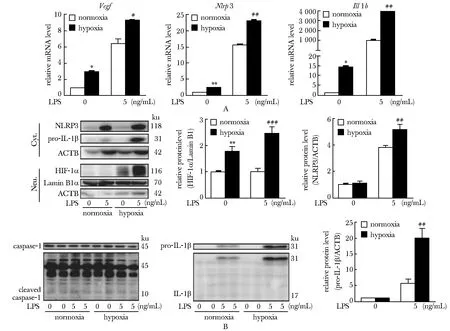
RAW264.7 cells were stimulated with 5 ng/mL LPS for 4 hours; A.the mRNA levels ofVegf,Nlrp3andIl1bwere determined by RT-qPCR; B.cell lysates were fractionated by SDS-PAGE and immunoblotted with antibodies to HIF- 1α, NLRP3, caspase- 1, cleaved caspase- 1, Pro-IL- 1β,IL- 1β,β-actin and LaminB1; densitometric analyses of the bands corresponding to HIF- 1α, NLRP3 and Pro-IL- 1β,β-actin and LaminB1 were served as internal control;*P<0.05,**P<0.01 compared with normoxia control group;#P<0.05,##P<0.01,###P<0.001 compared with LPS stimulation group
图2低氧可升高RAW264.7细胞中LPS诱导的NLRP3和IL-1β的mRNA及蛋白水平
2.3 特异性敲除巨噬细胞Vhl可升高LPS诱导的小鼠腹腔巨噬细胞中Nlrp3和Il1b的mRNA水平
RT-qPCR结果显示,VhlΔMac/Apoe-/-小鼠腹腔巨噬细胞中Vhl基因的敲除效率为20%以下(P<0.001)。与Vhlfl/fl/Apoe-/-小鼠腹腔巨噬细胞相比,给予LPS(50×10-3ng/L 24 h)培养后,VhlΔMac/Apoe-/-小鼠腹腔巨噬细胞中Nlrp3、Il1b和Il6的mRNA水平显著升高(P<0.05)(图3)。
3 讨论
本研究表明低氧可升高RAW264.7细胞中Nlrp3和Il1b的mRNA水平,放大LPS诱导的NLRP3和IL- 1β mRNA和蛋白水平,促进巨噬细胞IL- 1β的产生,并且特异性敲除巨噬细胞Vhl可显著升高LPS诱导的小鼠腹腔巨噬细胞中Nlrp3和Il1b的mRNA水平。以上结果表明低氧或Vhl敲除可升高LPS诱导的NLRP3和IL- 1β mRNA及蛋白水平,提示HIFs激活可能在此过程中发挥重要作用。
HIFs是调节氧稳态的主要转录因子,由α和β亚基构成异二聚体,HIFs主要受脯氨酸羟化酶(prolyl hydroxylases, PHDs)羟基化后经VHL介导的蛋白酶体途径降解[10]。低氧或敲除Vhl可导致HIFs经蛋白酶体降解途径受阻,HIFs在细胞内积聚并促进其靶基因的转录。有研究表明低氧可通过延长LPS诱导的人巨噬细胞中Pro-IL- 1β的半衰期增加其蛋白水平,但低氧不增加LPS诱导的人巨噬细胞中的IL1βmRNA水平[1]。另一项研究表明低氧可扩大LPS诱导的小鼠骨髓巨噬细胞IL- 1β的分泌[11]。这与本研究结果不完全一致。本研究结果发现低氧不仅可以促进RAW264.7中Nlrp3和Il1b的mRNA水平升高,还可进一步促进LPS诱导的NLRP3和IL- 1β mRNA及蛋白水平升高,但低氧不能诱导Pro-IL- 1β剪切。本研究与以往研究不完全一致的原因可能是由于巨噬细胞种属不同及LPS处理的时间、剂量不同。本研究还发现特异性敲除巨噬细胞Vhl所诱导的HIFs持续激活可进一步升高LPS诱导的小鼠腹腔巨噬细胞中Nlrp3和Il1b的mRNA水平。研究表明低氧通过HIF- 1α-NLRP3-IL- 1β轴可加重小鼠静脉血栓栓塞[12],且HIF- 1α可通过促进IL- 1β的转录和分泌参与巨噬细胞IL- 1β产生[11]。在本研究中,HIF- 1α-NLRP3-IL- 1β轴也可能在低氧增强巨噬细胞中LPS诱导的IL- 1β表达过程中发挥重要作用。
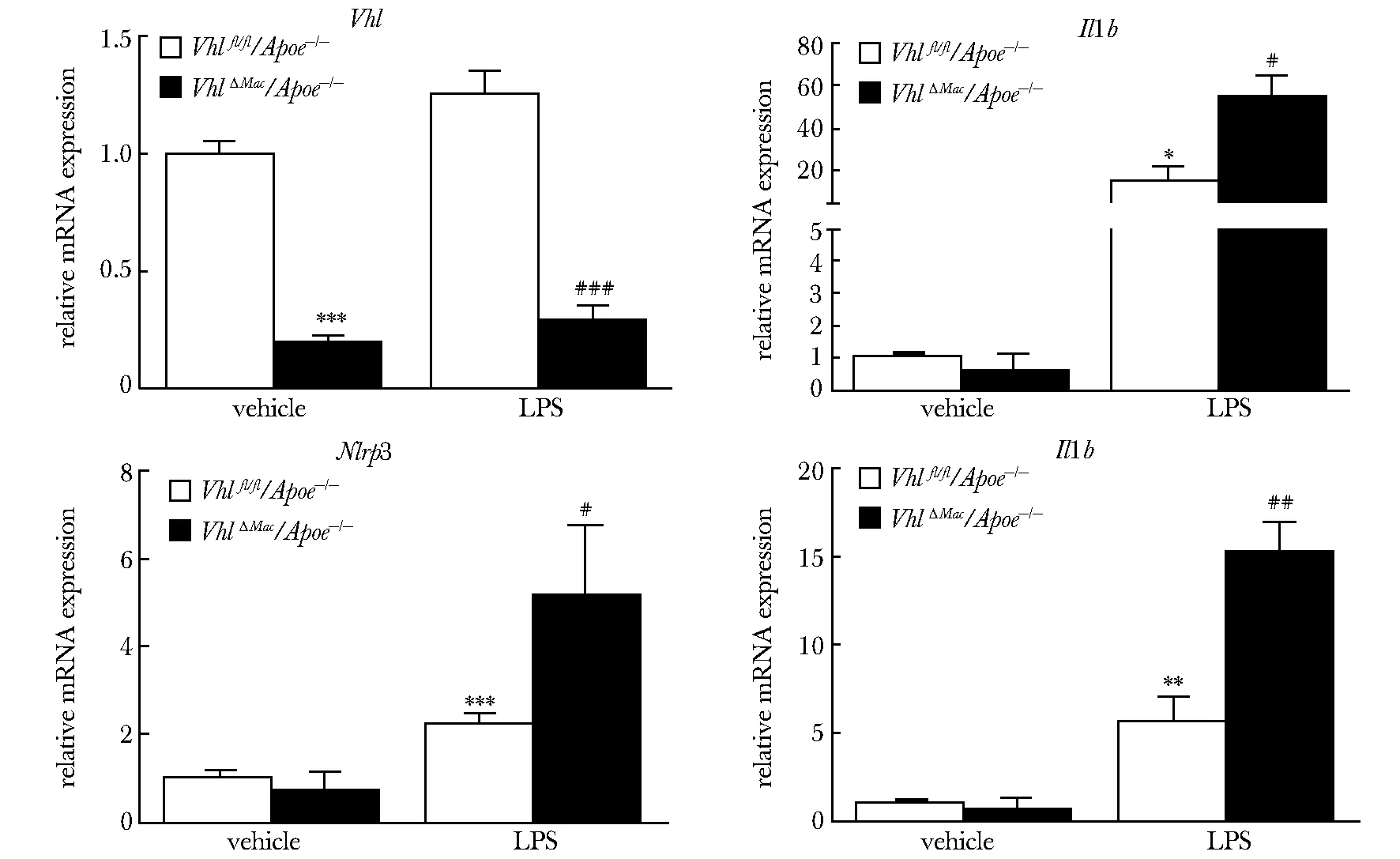
*P<0.05,**P<0.01,***P<0.001 compared withVhlfl/fl/Apoe-/-vehicle group;#P<0.05,##P<0.01,###P<0.001 compared withVhlfl/fl/Apoe-/-with LPS stimulation group
综上所述,低氧可能通过激活HIFs升高LPS诱导的巨噬细胞中NLRP3和IL- 1β的mRNA和蛋白水平,进而参与低氧增强巨噬细胞中LPS诱导的IL- 1β表达。然而,低氧调节巨噬细胞IL- 1β产生的机制还需进一步研究。
参考文献:
[1] Folco EJ, Sukhova GK, Quillard T,etal. Moderate hypoxia potentiates interleukin-1 beta production in activated human macrophages[J]. Circ Res, 2014, 115:875-883.
[2] Cummins EP, Keogh CE, Crean D,etal. The role of HIF in immunity and inflammation[J]. Mol Aspects Med, 2016, 47- 48:24- 34.
[3] Chamberlain J, Evans D, King A,etal. Interleukin- 1 beta and signaling of interleukin- 1 in vascular wall and circulating cells modulates the extent of neointima forma-tion in mice[J]. Am J Pathol, 2006, 168:1396- 1403.
[4] Kirii H, Niwa T, Yamada Y,etal. Lack of interleukin- 1beta decreases the severity of atherosclerosis in ApoE-deficient mice[J]. Arterioscler Thromb Vasc Biol, 2003, 23:656- 660.
[5] Duewell P, Kono H, Rayner KJ,etal. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010, 464:1357- 1361.
[6] Sergin I, Evans TD, Bhattacharya S,etal. Hypoxia in plaque macrophages: a new danger signal for interleukin- 1beta activation?[J]. Circ Res, 2014, 115:817- 820.
[7] Dinarello CA. Immunological and inflammatory functions of the interleukin- 1 family[J]. Ann Rev Immunol, 2009, 27:519- 550.
[8] Unlu S, Kumar A, Waterman WR,etal. Phosphorylation of IRF8 in a pre-associated complex with Spi- 1/PU.1 and non-phosphorylated Stat1 is critical for LPS induction of the IL1B gene[J]. Mol Immunol, 2007, 44:3364- 3379.
[9] Lamkanfi M, Dixit VM. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 157:1013- 1022.
[10] Semenza GL. Oxygen sensing, hypoxia-inducible factors, and disease pathophysiology[J]. Ann Rev Pathol, 2014, 9:47- 71.
[11] Tannahill GM, Curtis AM, Adamik J,etal. Succinate is an inflammatory signal that induces IL- 1 beta through HIF- 1alpha[J]. Nature, 2013, 496:238- 242.
[12] Gupta N, Sahu A, Prabhakar A,etal. Activation of NLRP3 inflammasome complex potentiates venous thrombosis in response to hypoxia[J]. Proc Natl Acad Sci U S A, 2017, 114:4763- 4768.

