生活垃圾焚烧厂周边土壤硝化和反硝化功能基因分布特征及影响因子
孙许超,郭彦海,张士兵,钱雅洁,刘振鸿,薛罡,高品
东华大学环境科学与工程学院,上海 201620
土壤氮循环是土壤物质循环的重要组成部分,包括氨化作用、硝化作用、反硝化作用、固氮作用等,其中微生物硝化-反硝化作用在生态氮循环过程中占重要地位。硝化作用是将NH3氧化成NO2-,再氧化成NO3-的过程,参与该过程的微生物主要为氨氧化细菌(由氨单加氧酶amoA基因编码)和硝酸细菌(由亚硝酸盐氧化还原酶nxr基因编码);反硝化作用是将NO3-最终还原成N2的过程,主要由反硝化细菌完成,包括NO3-还原(由narG或napA基因编码)、NO2-还原(由nirS或nirK基因编码)、NO还原(由norB基因编码)和N2O还原(由nosZ基因编码)。虽然目前已有较多针对农田、林地和草地等土壤生态系统中氮循环特定关键过程功能基因变化特征及环境影响因子的研究报道(高嵩涓等,2017;洪晨等,2014;张晶等,2009),如高嵩涓等(2017)采用荧光定量 PCR(qPCR)法研究了红壤稻田中不同时期AOA-amoA、narG和nosZ基因丰度变化,发现土壤理化性质对其具有重要影响,但关于垃圾焚烧厂周边土壤重金属累积污染对硝化-反硝化功能基因的变化影响规律方面的研究还很少(钟山等,2014)。
本研究以上海某垃圾焚烧厂周边草地表层土壤为研究对象,采用qPCR法定量分析不同硝化和反硝化功能基因丰度,包括 AOB-amoA、nxrB、narG、nirS、norB和nosZ基因,探讨土壤重金属累积污染及其理化性质对硝化和反硝化功能基因丰度变化的作用影响,为进一步掌握重金属污染对土壤氮循环功能微生物的影响规律提供数据支撑。
1 材料与方法
1.1 样品采集
研究区为上海某生活垃圾焚烧厂周边区域,经实地考察,在综合考虑研究区地形分布、土壤类型、气象参数及交通网络等特征的基础上,以垃圾焚烧厂为中心,在半径4 km范围内主要采集草地0~20 cm表层土壤,共布设21个采样点,各采样点具体位置如图1所示。采样过程中尽量避开外来土和近期被扰动过的土层,按梅花形布点方法进行采样,在5 m×5 m正方形区域中心点和4个顶点分别采集等量土壤,混合均匀后作为1个样品(约1 kg),装入土样采集袋中,运回实验室待分析。
1.2 土壤样品预处理及理化分析
1.2.1 样品预处理
所有土壤样品先剔除植物根茎、沙砾等杂物,其中一部分保存于-20 ℃冷冻箱内,以备后续分子生物学分析;另一部分置于实验室内通风处自然风干,研磨过100目筛网,然后贮存于土壤样品瓶中,用于土壤理化性质、重金属含量测定等。为避免人为因素的干扰,土壤样品在采集和预处理过程中均采用木铲、木棒、玛瑙研钵等器具。
1.2.2 土壤理化性质和重金属总量测定
土壤 pH值采用 S210-K型 pH计(Mettler Toledo,瑞士)测定,测定时水土比控制为2.5∶1。土壤总有机碳(TOC)和总氮(TN)含量采用Multi N/C®3100型总有机碳/总氮分析仪(Analytikjena,德国)测定。采用电感耦合等离子体发射光谱(ICP-OES,Perkin-Elmer,美国)测定土壤中Cd、Pb、Cu、Ni、Cr、Zn和As等7种重金属含量,预处理使用HNO3-HCl-HF-H2O2微波消解。
1.3 目标氮循环功能基因检测
1.3.1 DNA提取
土壤总 DNA采用 TIANamp Soil DNA Kit(TIANGEN)进行提取,提取步骤参照试剂盒操作说明书,所提取的DNA使用1.0%琼脂糖凝胶电泳和Qubit 2.0型核酸蛋白测定仪(Invitrogen,美国)检测其纯度和浓度。
1.3.2 氮循环功能基因检测分析
本研究选取AOB-amoA、nxrB、narG、nirS、norB和nosZ基因作为研究对象,使用Bio-rad T100型普通 PCR优化反应条件并制备标准品。采用LightCycler®96型荧光定量qPCR(Roche,瑞士)对目标基因进行定量检测分析,所用扩增引物序列、扩增子大小和退火温度见表 1。qPCR反应体系总体积为 20 μL,包括 FastStart Essential DNA Green Master(Roche)10 μL,上下游引物(4 μmol·L-1)各 1.5 μL,DNA 模板 1 μL,ddH2O 6 μL。热循环反应条件为:95 ℃预变性10 min,95 ℃变性10 s,退火20 s,72 ℃延伸30 s,共40个循环,同时利用熔解曲线检测分析扩增产物的特异性。每组样品3个平行反应,并以无菌水作为阴性对照。
目标基因标准品委托生工生物工程(上海)有限公司合成,按梯度稀释(10-2~10-7)后进行qPCR反应构建标准曲线(共6个稀释点),各qPCR反应扩增效率在90%~99%之间,相关系数R2>0.99。
1.4 数据分析

图1 研究区域表层土壤采样点位置示意图Fig.1 Schematic of the surface soil sampling sites in the study area

表1 qPCR反应所使用的基因引物信息Table1 Sequences of primers used for qPCR reaction
数据分析运用SPSS 19.0统计分析软件,采用线性回归进行相关性分析,计算因变量和自变量之间的Pearson相关系数(r)和P值;显著性检验水平α=0.05,若P<0.05,则认为具有显著的相关性,反之则认为相关性不显著。运用ArcGIS 10.2软件进行空间分布分析,运用Canoco 4.5软件进行冗余分析。
2 结果与讨论
2.1 研究区土壤理化性质及重金属含量分析
如表2所示,研究区所有采样点土样pH值在7.64~8.81之间,整体呈偏碱性。土壤TOC和TN含量范围分别为 4.17~20.86 g·kg-1和 0.8~2.26 g·kg-1。史利江等(2010)针对上海市不同土地利用方式下的土壤TOC和TN含量水平进行分析,结果发现草地土壤TOC平均含量约为10.05 g·kg-1,TN平均含量约为1.12 g·kg-1,与本研究结果相似。
由表 2可知,重金属 Cd平均含量约为0.083~1.065 mg·kg-1,除采样点 NW2 外,其余采样点均高于上海市土壤背景值(中国环境监测总站,1990),其中E3采样点超出背景值约6.7倍。大部分土样中Cr(85.7%)、Cu(61.9%)、Pb(61.9%)、Ni(57.1%)和 Zn(81.0%)等重金属平均含量均略高于上海市土壤背景值,但未超出《土壤环境质量标准》(GB15618—1995)二级标准。所有土样中As平均含量均未超过上海市土壤背景值。上述结果表明,研究区土壤已受到不同程度的重金属污染,且以Cd污染最为严重。因此,本研究以《土壤环境质量标准》(GB15618—1995)一级标准值作为重金属污染评价依据,计算 21个采样点的内梅罗综合污染指数。结果表明,垃圾焚烧厂周边西北方向W1和NW1采样点土壤中Cd含量超出一级标准3倍以上,属于中度污染区域;类似地,采样点NE1、NE2和S2周边范围属于轻度污染区域,这可能与当地气候条件有关。研究区春夏季主导风向为东南风,受垃圾焚烧厂焚烧烟气的影响,在其下风向(NW)区域土壤受到一定程度的重金属污染。此外,采样点E3中Cd平均含量超出一级标准约5倍,这主要是因为该采样点位于建筑工地和道路附近,除焚烧烟气外,其受交通尾气和建筑扬尘等污染影响也较大。

表2 各采样点土壤理化性质及重金属含量Table2 Physicochemical properties and heavy metal contents of each soil sample
采用ArcGIS 10.2反距离权重法分析重金属空间分布特征,结果如图 2所示。Cd、Zn、Pb、Cu和Ni在垃圾焚烧厂周边含量较高,随着距离增大重金属含量降低,表明土壤中这些重金属可能主要来源于焚烧烟气的排放沉降。此外,在采样点 E3处存在Cd、Zn、Pb和Cu的高值区,在采样点W3处Ni与Pb含量也较高,这可能是因为该采样点附近主要为建筑工地和道路,受交通运输、建筑施工等污染源影响较大。此外,Cr在采样点W2处存在一个高含量区,经实地考察,该区域以前是一家机动轮骑车厂,需采用镀Cr工艺,导致其在周边土壤中发生累积。
2.2 硝化-反硝化功能基因丰度分布特征
对所有采样点土壤中目标硝化-反硝化功能基因丰度进行测定,结果如表3所示。微生物硝化作用 AOB-amoA基因丰度范围为 4.89×102~1.34×105copies·g-1,不同土样之间变化幅度相差较大,达 3个数量级,而nxrB基因丰度范围为 5.43×106~5.41×107copies·g-1。反硝化作用功能基因narG、nirS、norB和nosZ丰度范围分别为 1.21×106~7.91×106copies·g-1、3.79×106~7.39×107copies·g-1、1.61×105~1.33×107copies·g-1和 1.44×104~2.18×105copies·g-1,不同土样之间变化幅度相差较小,约为1个数量级。土壤氨氧化作用主要由氨氧化古菌(AOA)和氨氧化细菌(AOB)承担,而在碱性土壤中AOB比AOA更为活跃,是土壤硝化作用的主要驱动者(Xia et al.,2011),但其受外部环境因子影响较大。本研究结果同样表明,AOB-amoA基因对环境因子的变化较为敏感。
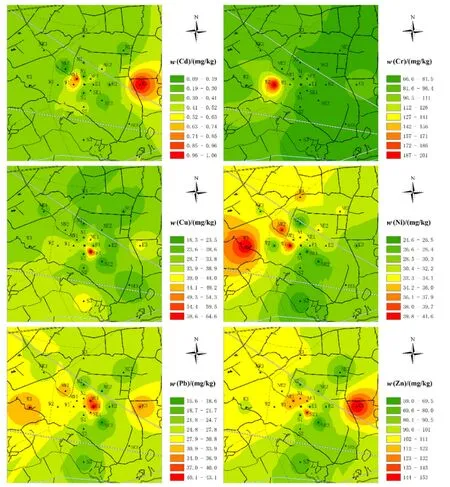
图2 研究区域重金属含量空间分布Fig.2 Spatial distribution of heavy metals in soils in the study area

表3 研究区各采样点硝化和反硝化功能基因丰度Table3 Quantities of nitrification and denitrification functional genes of soil samples in the study area
图3所示为各硝化和反硝化功能基因丰度空间分布情况。分析可知,硝化和反硝化作用功能基因总体变化趋势基本一致,在焚烧厂附近NW方向丰度较高,SE方向丰度较低。结合图2重金属空间分布情况发现,硝化和反硝化功能基因丰度较高区域同样检出较高含量重金属,如采样点W1(Ni、Zn)、W2(Cr)、NW1(Cd、Zn)、N1(Zn)和NE1(Pb、Zn)等,且总体上随着重金属含量的增大,各功能基因丰度呈现出逐渐升高的趋势,表明一定含量范围的重金属元素对土壤微生物硝化过程具有促进作用。Stuczynski et al.(2003)研究同样发现,Cd和Pb通常能够刺激土壤微生物行为过程,而高含量Zn(>700 mg·kg-1)对土壤微生物行为具有抑制作用。此外,Broos et al.(2005)研究结果显示,重金属Cd和Zn对土壤硝化速率影响的最低毒性含量分别为 7 mg·kg-1和 107 mg·kg-1,而本研究区土壤中Cd含量远低于7 mg·kg-1,Zn含量除在少部分土样(33.3%)中超出107 mg·kg 外,其余也均低于该限值,表明重金属含量对研究区土壤微生物硝化作用的毒性抑制作用较小。
此外,根据研究区采样点空间分布特征进行分析,目标硝化-反硝化功能基因在垃圾焚烧厂下风向(NW方向)区域采样点土壤中的丰度相对较高,而在上风向(SE方向)区域采样点土壤中相对较低,其分布特征与土壤TN含量分布是一致的,表明垃圾焚烧厂焚烧烟气污染未对周边土壤中微生物硝化和反硝化过程产生明显抑制作用。
相关性分析结果显示(表4),硝化与反硝化功能基因两两之间均呈现出正相关关系,除AOB-amoA与nosZ之间相关性不显著外(P=0.130),其余硝化与反硝化功能基因之间均具有显著相关性(P<0.05),表明研究区土壤中硝化和反硝化作用之间存在一定相关关系,并对土壤环境变化具有一致响应性,这与上述硝化和反硝化功能基因空间分布特征是相一致的。此外,Zhou et al.(2012)和高嵩涓等(2017)在稻田土壤中同样发现类似的结果。
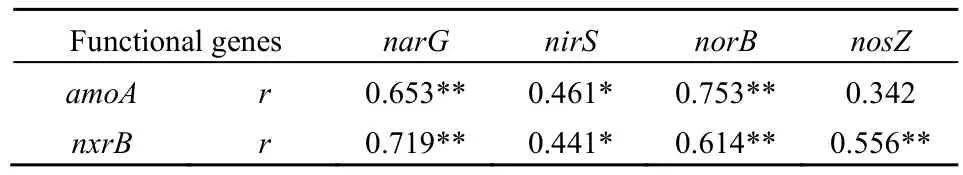
表4 硝化和反硝化功能基因之间相关关系Table4 Correlation between nitrification and denitrification functional genes
2.3 硝化-反硝化功能基因丰度与环境因子相关性分析
土壤中硝化和反硝化作用受很多因素影响,如土地利用方式、土壤理化性质及外源污染物输入等(夏月等,2009)。本研究针对目标硝化和反硝化功能基因与土壤理化性质及重金属元素进行相关性分析(见表5),结果表明,除Cd和Zn外,其他5种重金属与硝化和反硝化功能基因之间均不存在显著相关性(P>0.05),表明重金属对研究区土壤硝化和反硝化作用过程影响较小,这可能是因为这些重金属含量水平较低(见2.1章节),不足以对土壤硝化和反硝化作用产生显著的促进或抑制作用。相比之下,Cd与amoA、nxrB、narG和norB基因之间,以及Zn与nxrB基因之间均具有显著正相关关系(P<0.05),表明Cd和Zn对研究区土壤硝化和反硝化作用过程具有一定促进作用,这与2.2章节的分析结果是相一致的。张伟等(2009)研究同样发现,低含量Cd(<1.0 mg·kg-1)能够促进土壤硝化作用,从而造成NO3--N含量相应升高,然而随着 Cd 含量的增大(1.0~70.0 mg·kg-1),土壤硝化作用受到抑制,NO3--N含量则相应降低。
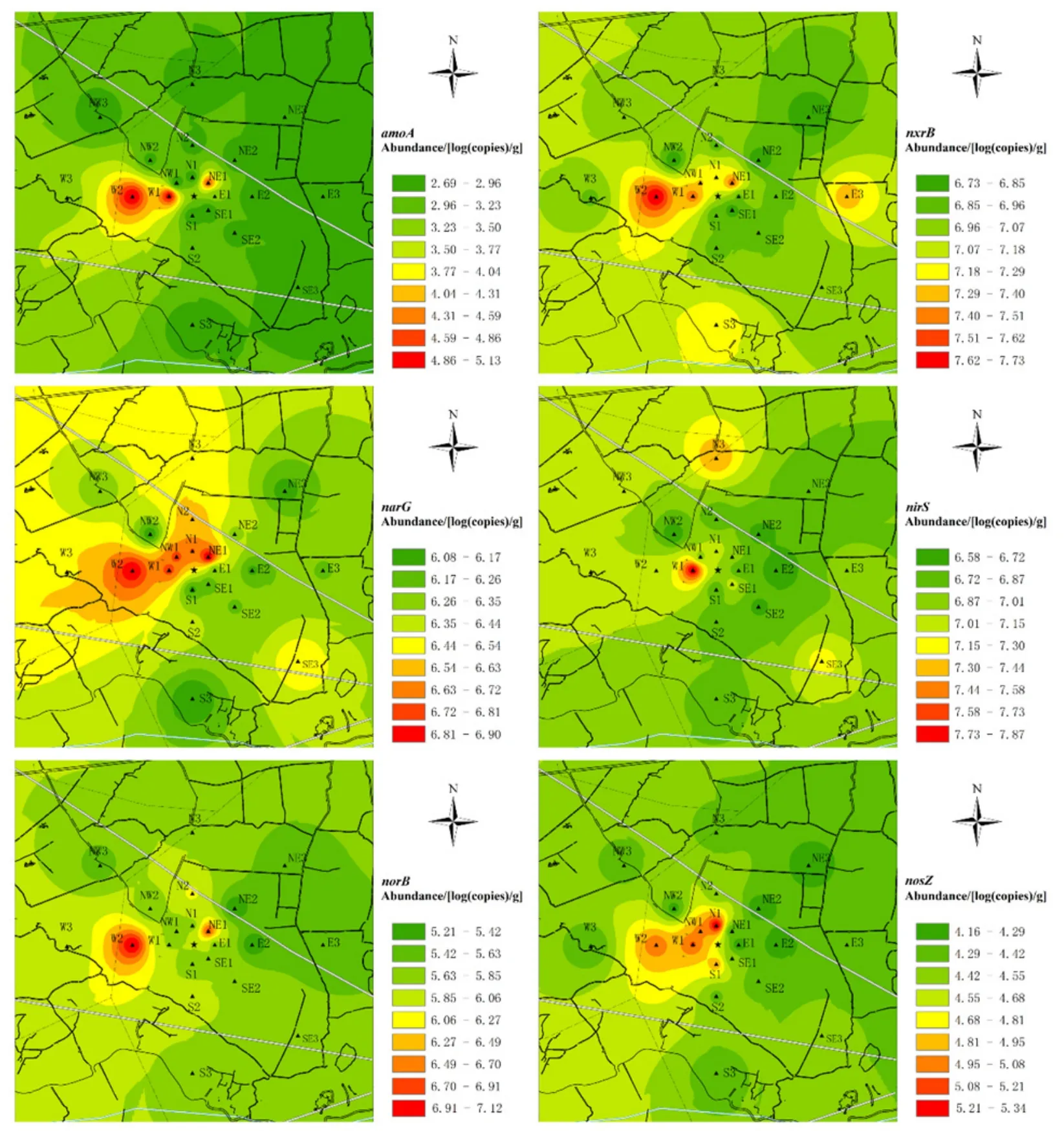
图3 研究区域功能基因空间分布Fig.3 Spatial distribution of functional genes in soils in the study area

表5 土壤理化性质和重金属含量与硝化和反硝化功能基因之间相关关系Table5 Correlation between soil physicochemical properties and heavy metal contents and nitrification-denitrification functional genes
此外,由表5可知,研究区土壤pH值、TOC和TN与大部分硝化和反硝化功能基因之间存在显著正相关关系(P<0.05),表明土壤理化性质是影响硝化和反硝化作用过程的重要因素(Yao et al.,2013;Rosa et al.,2014)。N作为硝化作用的基质,对土壤硝化和反硝化过程具有重要影响,相关性分析结果同样表明,土壤TN与目标硝化和反硝化功能基因之间均具有显著相关性。
土壤 pH值是影响硝化作用的另一个重要因子,由于pH值会直接影响氨的存在形态,且硝化过程需要消耗碱度,因此pH降低会抑制硝化过程的进行。有研究表明(Jiang et al.,2015),在偏碱性(pH=8.2)土壤中硝化作用较为强烈,氨氧化细菌得到显著富集。此外,低pH值同样会降低反硝化功能酶基因的活性(McMillan et al.,2016),从而不利于反硝化过程的有效进行。
C是微生物有机体的必需组分,由表5可知,土壤TOC与nxrB、narG、nirS和nosZ基因之间存在显著相关性(P<0.05),表明土壤有机质含量水平同样会影响硝化和反硝化作用过程。Barrett et al.(2016)研究显示,草地土壤中有机碳源种类对nirS和nosZ基因具有显著影响,并能够改变反硝化作用途径。
对影响硝化和反硝化功能基因丰度的环境因子进行冗余分析(RDA),以辨识影响功能基因丰度的主要环境因子,如图4所示。图中箭头表示环境因子,箭头连线的长度表示环境因子对功能基因丰度的影响程度,箭头连线与排序轴间夹角表示该环境因子与排序轴相关系数的大小。Monte Carlo置换检验结果表明,所有排序轴均具有显著性(P<0.01),表明排序效果理想。RDA 的前两轴分别代表了基因丰度51.3%和17.7%的变异,分别对应67.4%和23.3%的基因丰度与环境因子之间的相关关系。第1排序轴与pH、Pb和Cr相关性较强,而第2排序轴与TOC、Zn和Cd之间具有显著相关性。从图3可知,土壤TOC、pH和TN是影响硝化和反硝化功能基因丰度的主要影响因子,相比之下,重金属对其的影响作用较弱,这与上述研究结果一致。
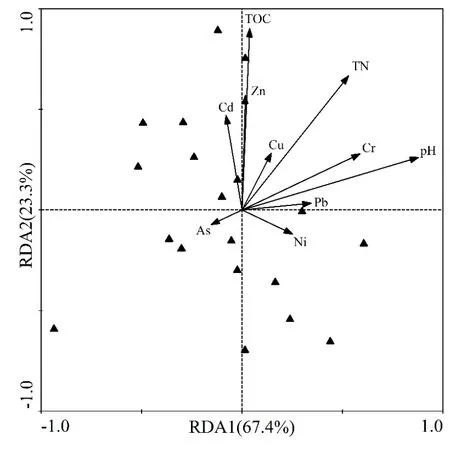
图4 冗余度分析环境因子对土壤硝化和反硝化功能基因丰度的作用影响Fig.4 Redundancy analysis of quantity of nitrification-denitrification functional genes across all of the soil samples
3 结论
垃圾焚烧厂周边土壤中共检出7种重金属,除As外,其他6种重金属(Cd、Cr、Cu、Pb、Ni和Zn)均超出上海市土壤背景值,表明周边土壤已受到不同程度的重金属污染。目标硝化和反硝化功能基因在垃圾焚烧厂周边土壤中均被检出,丰度在102~107之间,硝化基因与反硝化基因之间具有显著相关性。相关性分析和冗余分析结果表明,土壤理化性质对硝化和反硝化功能基因丰度变化具有显著影响,而重金属对其影响较小。
参考文献:
AOI Y, MASAKI Y, TSUNEDA S, et al. 2004. Quantitative analysis of amoA mRNA expression as a new biomarker of ammonia oxidation activities in a complex microbial community [J]. Letters in Applied Microbiology, 39(6): 477-482.
BARRETT M, KHALIL M I, JAHANGIR M M R, et al. 2016. Carbon amendment and soil depth affect the distribution and abundance of denitrifiers in agricultural soils [J]. Environmental Science and Pollution Research, 23(8): 7899-7910.
BROOS K, MERTENS J, SMOLDERS E. 2005. Toxicity of heavy metals in soil assessed with various soil microbial and plant growth assays: a comparative study [J]. Environmental Toxicology and Chemistry,24(3): 634-640.
DIONISI H M, LAYTON A C, HARMS G, et al. 2002. Quantification ofNitrosomonasoligotropha-Like ammonia-oxidizing bacteria andNitrospiraspp. from full-scale wastewater treatment plants by competitive PCR [J]. Applied and Environmental Microbiology, 68(1):245-253.
GILLER K E, WITTER E, MCGRATH S P. 1998. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: a review [J]. Soil Biology & Biochemistry, 30(10-11): 1389-1414.
HUANG L Q, DONG H L, WANG S, et al. 2014. Diversity and abundance of ammonia-oxidizing archaea and bacteria in diverse Chinese paddy soils [J]. Geomicrobiology Journal, 31(1): 12-22.
JIANG X, HOU X, ZHOU X, et al. 2015. pH regulates key players of nitrification in paddy soils [J]. Soil Biology and Biochemistry, 81:9-16.
LÓPEZ-GUTIÉRREZ J C, HENRT S, HALLET S, et al. 2004.Quantification of a novel group of nitrate-reducing bacteria in the environment by real-time PCR [J]. Journal of Microbiological Methods, 57(3): 399-407.
MCMILLAN A M S, PAL P, PHILLIPS R L, et al. 2016. Can pH amendments in grazed pastures help reduce N2O emissions from denitrification? - The effects of liming and urine addition on the completion of denitrification in fluvial and volcanic soils [J]. Soil Biology and Biochemistry, 93: 90-104.
PESTER M, MAIXNER F, BERRY D, et al. 2014. Nxr B encoding the beta subunit of nitrite oxidoreductase as functional and phylogenetic marker for nitrite-oxidizingNitrospira[J]. Environmental Microbiology, 16(10): 3055-3071.
ROSA S M, KRAEMER F B, SORIA M A, et al. 2014. The influence of soil properties on denitrifying bacterial communities and denitrification potential in no-till production farms under contrasting management in the Argentinean Pampas [J]. Applied Soil Ecology, 75:172-180.
STUCZYNSKI T I, MCCARTY G W, SIEBIELEC G. 2003. Response of soil microbiological activities to cadmium, lead, and zinc salt amendments [J]. Journal of Environmental Quality, 32(4):1346-1355.
XIA W, ZHANG C, ZENG X, et al. 2011. Autotrophic growth of nitrifying community in an agricultural soil [J]. The ISME Journal, 5(7):1226-1236.
YAO H, CAMPBELL C D, CHAPMAN S J, et al. 2013. Multi-factorial drivers of ammonia oxidizer communities: evidence from a national soil survey [J]. Environmental Microbiology, 15(9): 2545-2556.
ZHOU S, SAKIYAMA Y, RIYA S, et al. 2012. Assessing nitrification and denitrification in a paddy soil with different water dynamics and applied liquid cattle waste using the15N isotopic technique [J]. Science of the Total Environment, 430(430): 93-100.
高嵩涓, 曹卫东, 白金顺, 等. 2017. 湘南红壤稻田AOA-amoA、narG、nosZ基因丰度及其环境影响因子[J]. 中国土壤与肥料, (1): 21-27.
洪晨, 邢奕, 司艳晓, 等. 2014. 铁矿区内重金属对土壤氨氧化微生物群落组成的影响[J]. 中国环境科学, 34(5): 1212-1221.
史利江, 郑丽波, 梅雪英, 等. 2010. 上海市不同土地利用方式下的土壤碳氮特征[J]. 应用生态学报, 21(9): 2279-2287.
夏月, 朱永官. 2007. 硝化作用作为生态毒性指标评价土壤重金属污染生态风险[J]. 生态毒理学报, 2(3): 273-279.
张晶, 林先贵, 尹睿, 等. 2009. 参与土壤氮素循环的微生物功能基因多样性研究进展[J]. 中国生态农业学报, 17(5): 1029-1034.
张伟, 常梅. 2009. 镉污染对土壤中硝态氮含量的影响[J]. 江西农业学报, 21(3): 101-102.
中国环境监测总站. 1990. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社: 90-497.
钟山, 高慧, 张漓衫, 等. 2014. 平原典型垃圾焚烧厂周边土壤重金属分布特征及污染评价[J]. 生态环境学报, 23(1): 164-169.

