二甲双胍通过AMPK通道对界膜中滑膜成纤维细胞的增殖和成骨作用的研究
陈坤 李奇
南方医科大学珠江医院(广州 510280)
无菌性松动(aseptic loosening,AL))是关节假体移植发生松动的主要原因之一,在假体与骨界面应力过大就会产生一定的微动[1],达到一定的微动程度就会抑制假体周围骨的长入,从而形成一定的空隙而填充界膜。界膜主要含有巨噬细胞、成纤维细胞(synovial fibroblasts,FLSs)、异物巨细胞、破骨细胞和淋巴等细胞,其中成纤维细胞占到30%~70%[2]。FLSs与间质干细胞具有同源性,具有成骨分化的潜力,有研究发现牙周成纤维细胞在周期应力的刺激下有分化成骨的能力[3]。目前二甲双胍对成骨和破骨作用研究集中在对巨噬细胞、破骨细胞、成骨细胞和间充质干细胞方面,发现二甲双胍激活AMPK信号通道在多个组织、器官中对巨噬细胞有着明显的抑制炎症作用,如可明显抑制巨噬细胞在脂多糖(LPS)和磨损颗粒诱导下的L⁃6、iNOS和OPG等溶骨炎症因子的表达[4-5]。同时二甲双胍和AICAR也促进成骨细胞细胞外成骨,同时AMPK通道阻滞剂compound C能抑制成骨细胞细胞外成骨[6]。可见AMPK通道对多种细胞都有着促骨生成的效能。同时磨损颗粒可以诱导FLSs分泌RANKL/OPG比例的增高,促进溶骨[7]。二甲双胍在对细胞增殖抑制方面,其对多种肿瘤细胞生长具有抑制作用,并促进其凋亡或抑制肿瘤细胞的周期,例如对前列腺癌细胞、肺癌细胞、肝癌Hep G2细胞和直肠癌细胞等,通过LKB1⁃AMPK⁃mTOR通路直接抑制肿瘤的生长和降低宿主胰岛素水平间接作用于恶性肿瘤细胞[8-11],进一步发现二甲双胍对成纤维细胞也表现生长抑制的作用[12]。假体与骨间隙中的FLSs大量增殖形成界膜,界膜为巨噬细胞、破骨细胞提供良好的微环境,同时FLSs本身增殖和在颗粒诱导下RANKL/OPG比例失调都是促进假体松动的重要原因。所以本研究致力于二甲双胍对FLSs增殖和成骨方面,验证二甲双胍抑制FLSs的增殖同时促进FLSs成骨的作用,体外实验检测成骨活性特异性标准酶⁃ALP和细胞外钙结节。二甲双胍抑制界膜的增殖,促进骨形成,有利于骨和假体的融合而稳定假体,为临床假体AL预防和治疗提供新的思路,同时有利于老药新用。
1 材料与方法
1.1 材料和试剂标本取自南方医科大学珠江医院关节外科年轻膝关节损伤患者关节镜手术中切除的滑膜,已经医院伦理委员会批准。胎牛血清(Gibico)、DMEN/F12培养基,I型胶原酶(sigma),兔抗人OPG抗体(abcam),兔抗人RANKL抗体(abcam),鼠抗人HIF⁃1α(cst),羊抗兔二抗(博奥森),羊抗鼠二抗(博奥森),兔抗人vimentin(H⁃84)(Santa CruzBiotechnology),兔 抗 人 CK18(Santa Cruz Biotechnology),羊抗兔二抗(中衫金桥)。兔SP试剂盒(中衫金桥),BCIP/NBT Kit(康为),茜素红S染色液(索莱宝),盐酸二甲双胍(MedChem Express),AICAR(Inhibitor Expert),Compound C(MedChem Express),抗坏血酸(索莱宝),β⁃甘油磷酸(索莱宝),地塞米松(索莱宝)。超灵敏化学发光仪(Biorad),酶标仪(Bio⁃tek)。
1.2 实验方法
1.2.1 FLSs的提取与鉴定将组织置于六孔板内,用PBS漂洗三遍。移入洁净的孔内,滴入一滴全培液(含10%血清、1%青霉素链霉素双抗的DNMEM/F12培养基),眼科镊将组织剪碎至1 mm×1 mm大小,加入2%Ⅰ型胶原酶3 mL,移入37℃、5%CO2的细胞培养箱内消化4 h,每30 min轻轻震荡样本。四小时后将消化后的混合液体用直径70 μm细胞滤网过滤,1 000 r/min离心滤液5 min,倾弃上清全。加入适量的全培液,移入25 cm2细胞培养瓶内,于37℃、5%CO2的细胞培养箱培养过夜,24 h后显微镜小观察贴壁的细胞,并更换新的完全培养基。此后每3天更换新的培养基。待细胞覆盖瓶底80%瓶底时,进行传代,取培养4或5代纯化的细胞用于实验。通过形态观察、角质蛋白和波形丝细胞免疫化学染色对FLSs进行鉴定。
1.2.2 二甲双胍对FLSs生长的影响取第4代的细胞行MTT检测,以5×103/孔接于96孔板,实验分组设置:① 5个药物浓度组:0、5、20、40、60 μmol/L和②3 μmol/L AICAR、20 μmol/L二甲双胍,然后采取MTT检测①②组在不同时间段对FLSs抑制的OD值,然后计算出抑制率;
1.2.3 二甲双胍对FLSs的成骨诱导分化取第4代的细胞行成骨诱导分化,以5×104/皿接种于6 cm的培养皿中。实验设置:A、B和C组:A:空白,B:20 μmol/L 二甲双胍,C:50 mg/L 抗坏血酸+0.1 μmmol/L地塞米松+0.5 mmol/Lβ⁃甘油磷酸钠。再采用碱性磷酸酶染色检测和茜素红染色,分别检查二甲双胍促进FLSs合成碱性磷酸酶和生成钙结节的效能。其中碱性磷酸酶染色分别检测3组(A、B和C组)培养7、14和21 d后碱性磷酸酶活性的结果;茜素红染色分别检测3组(A、B和C组)培养21、28和35 d后细胞外钙结节形成的结果。
1.2.4 检查二甲双胍对FLSs信号通道AMPK的表达及磷酸化的影响取第5代的细胞行West⁃ern Blot检测,以5×105/皿接种于10 cm的培养皿中。实验设置①0、5、20、40 μmol/L 组和② 3 μMAICAR、20 μmol/L 二甲双胍组,使用 Western Blot检测不同药物处理3 d时的FLSs的AMPK信号通道表达及磷酸化水平的情况。
1.3 观测指标倒置显微镜下观察FLSs培养第4代时的形态以及细胞免疫化学染色对FLSs的成纤维属性鉴定结果。MTT检测出不同组的OD值并计算出抑制率。倒置显微镜下观察碱性磷酸酶染色和茜素红染色结果。Western Blot检测不同二甲双胍和AMPK通道的激动剂作用下通道AMPK表达及磷酸化水平情况。
1.4 统计学方法所得数据使用SPSS 20.0进行统计分析,组间差异使用单因素方差分析,检验水准α=0.05。
2 结果
2.1 HE染色和细胞免疫化学鉴定结果低倍镜下可见细胞为长梭形,胞体比较大,也可见少量的多角细胞,胞核较大,核呈卵圆形和圆形,1~2个核仁(图1A)。角质蛋白细胞免疫化学染色呈阴性(图1B)。波丝蛋白细胞免疫化学染色呈深棕色,呈强阳性(图1C)。
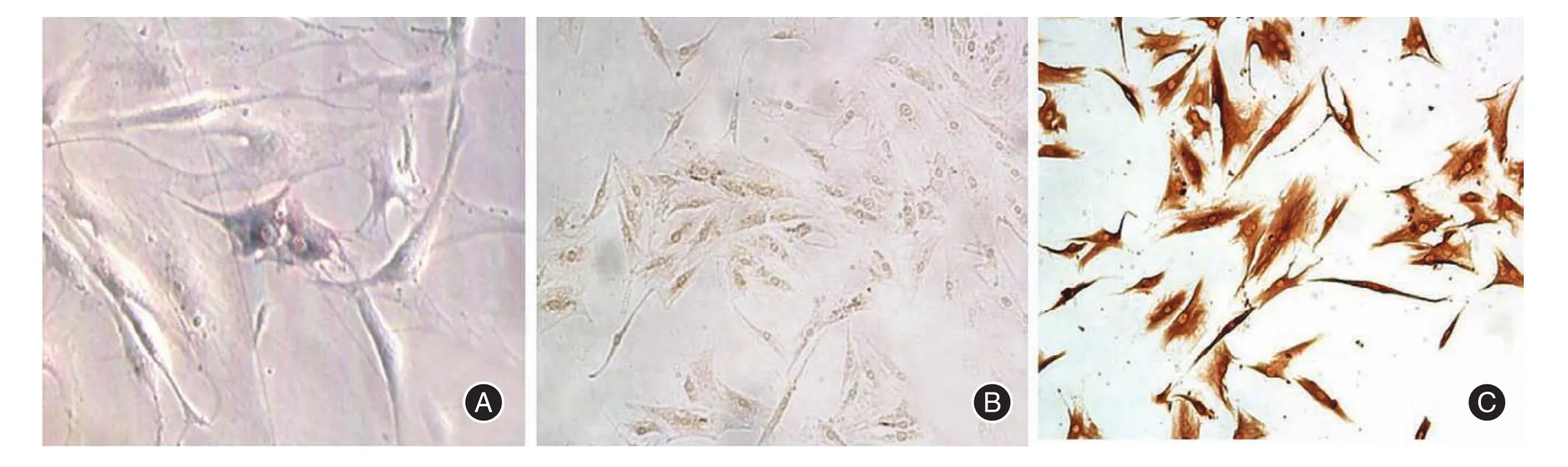
图1 细胞形态和细胞免疫化学染色Fig.1 Cell morphology and immunocytochemicalstaining
2.2 MTT检测结果二甲双胍在一定浓度范围内浓度越高对FLSs的增殖抑制越明显,有明显的浓度依赖性,但在时间梯度方面,随着作用时间的加长二甲双胍对FLSs的抑制没有明显的增强,当二甲双胍为60 μmol/L时,随着作用时间抑制趋势有着明显增强的趋势(图2A)。浓度为3 μmol/L的AICAR作用FLSs也表现出来了明显的增殖抑制趋势作用(图2B)。

图2 MTT结果Fig.2 MTT Results
2.3 碱性磷酸酶和茜素红染色结果用20 μmol/L的二甲双胍和50 mg/L抗坏血酸+0.1 μmol/L地塞米松+0.5 mmol/Lβ⁃甘油磷酸钠作用于FLSs 7、14和21 d,可见在7 d时,二甲双胍组和50 mg/L抗坏血酸+0.1 μmol/L地塞米松+0.5 mmol/Lβ⁃甘油磷酸钠组表现出明显诱导FLSs合成碱性磷酸酶的趋势,相对对照组阳性趋势明显。同时表现明显的时间依赖性,作用时间越长诱导合成碱性磷酸酶越明显(图3)。20 μmol/L的二甲双胍和50 mg/L抗坏血酸+0.1 μmol/L地塞米松+0.5 mmol/Lβ⁃甘油磷酸钠同时表现出明显诱导FLSs细胞外钙结节形成的趋势,同时有着明显的时间依赖性(图4)。
2.4 Western Blot检测结果不同浓度二甲双胍作用FLSs 3 d,可见信号通路AMPK在FLSs总体表达量恒定,二甲双胍能促进AMPK磷酸化,同时有着明显的浓度依赖性(图5A)。3 μmol/L AICAR也能明显的促进AMPK的磷酸化(图5B)。
3 讨论
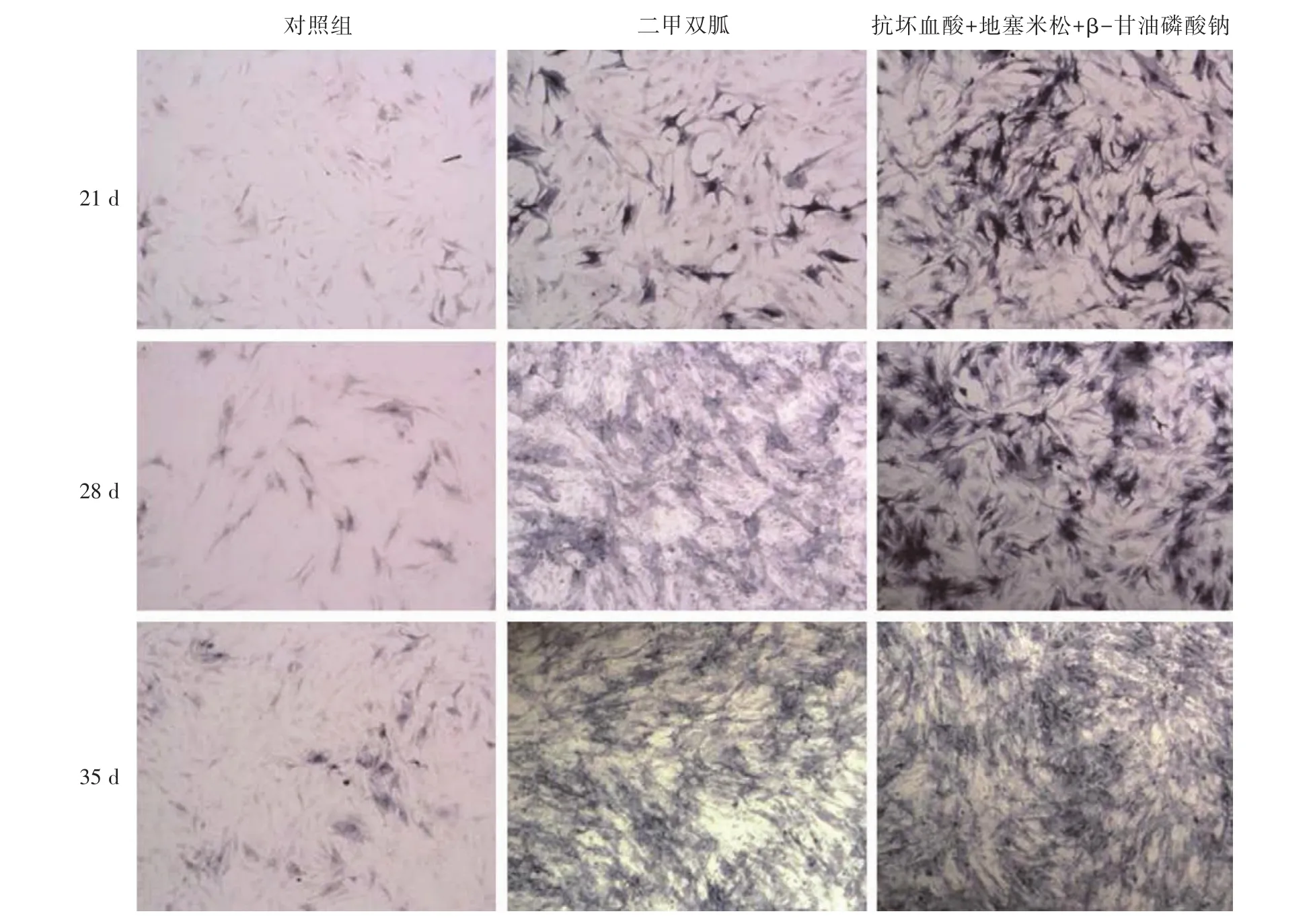
图3 碱性磷酸酶染色Fig.3 Alkaline phosphatase(ALP)staining
假体的磨损颗粒诱导一系列的溶骨炎症是引起无菌性松动主要原因,随着国内关节假体置换患者基数增大,对无菌性松动的预防和治疗迫在眉睫。二甲双胍是治疗Ⅱ型糖尿病治疗的一线药,近期大量研表明二甲双胍有着促进骨生成和抑制多种肿瘤细胞的增殖的效能。二甲双胍通过AMPK通道可促进成骨细胞的骨保护素分泌且抑制RANKL分泌,抑制破骨细胞的分化和活性,抑制UHMWPE诱导巨噬细胞多种溶骨炎症因子的释放。同时二甲双胍对多种肿瘤细胞及成纤维细胞生长具有抑制作用,并促进其凋亡或抑制肿瘤细胞的周期。本研究发现,二甲双胍可抑制FLSs增殖生长,其抑制效应有着浓度依赖性,随着浓度越大抑制率越大,并在浓度约为60 μmol/L抑制率达到50%。在AICAR作用于AMPK也可抑制FLSs的增殖,同时具有时间依赖性。二甲双胍对FLSs的促骨效能方面,在二甲双胍的作用下,能促进FLSs成骨活性特异性标志酶⁃ALP的合成和细胞外钙结节的沉淀。在培养7 d时可见ALP活性明显增强以及有着明显的时间梯度。在21 d时可见明显的细胞外钙结节的沉淀,也有着明显的时间梯度性。阳性对照组(抗坏血酸、β⁃甘油磷酸和地塞米松合剂)FLSs培养7 d时也可见碱性磷酸酶合成明显增加和21 d时细胞外出现钙结节,同时有着时间依赖性。二甲双胍作用AMPK信号通道,促进AMPK通道的磷酸化。二甲双胍作用于AMPK通道,促进其磷酸化,同时抑制下游重要靶点m⁃TOR的磷酸化,从而发挥抑制FLSs增殖和促进FLSs成骨的生理功能。但有研究表明二甲双胍通过IGF⁃1/PI3K/AKT/m⁃TOR发挥着间接作用,大量研究表明二甲双胍通过该通道可抑制多种肿瘤细胞的增殖,并阻滞其周期在G2期等期限[13],再者二甲双胍还能通过该通道抑制强直性脊柱炎关节滑膜成纤维细胞的炎症反应[14]。但对二甲双胍是否也通过IGF⁃1/PI3K/AKT抑制m⁃TOR的磷酸化发挥间接作用而抑制FLSs增殖和促进成骨的研究目前国内外尚未报道。本研究也未对二甲双胍作用AMPK通路后的下游通路展开详细研究。笔者后期要对二甲双胍通过IGF⁃1/PI3K/AKT/m⁃TOR发挥着间接作用和二甲双胍作用AMPK通路后的下游通路机制展开详细研究。国内外目前集中在巨噬细胞、破骨细胞和骨髓间充质细胞方面的研究,在二甲双胍对FLSs成骨和增殖方面尚未研究报道。本研究为临床假体无菌性松预防和治疗提供新的思路和靶点,同时有利于老药新用。

图4 茜素红染色Fig.4 Alizarin Red S staining
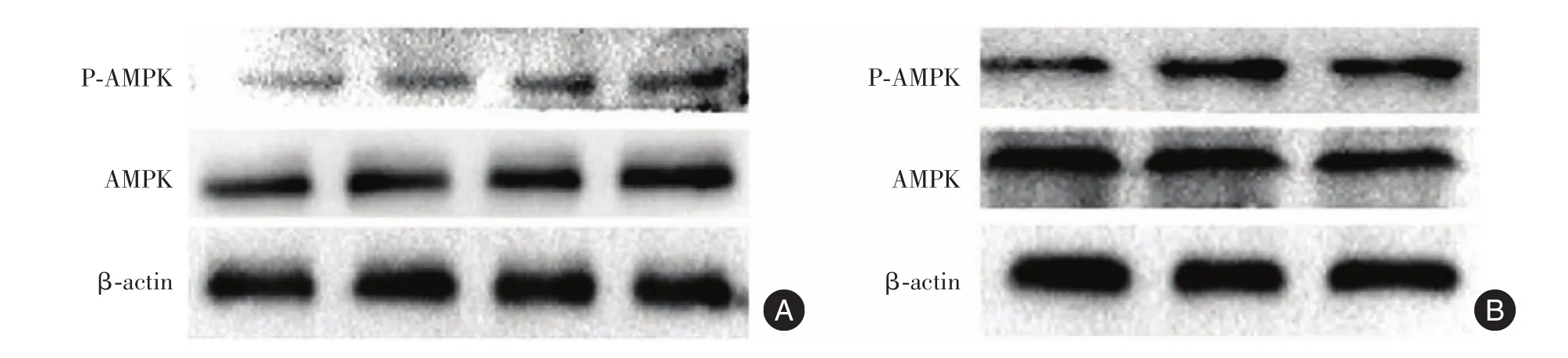
图5 Western BlottingFig.5 Western Blotting
[1]JAKOBSEN T,KOLD S,SHIGUETOMI⁃MEDINA J,et al.Topical zoledronic acid decreases micromotion induced bone re⁃sorption in a sheep arthroplasty model[J].BMC Musculoskelet Disord,2017,18(1):441.
[2]LIU G,GUO T,ZHANG Y,et al.Apoptotic pathways of mac⁃rophages within osteolytic interface membrane in periprosthesti⁃costeolysis after total hip replacement[J].APMIS,2017,125(6):565⁃578.
[3]REN D,WEI F,HU L,et al.Phosphorylation of Runx2,in⁃duced by cyclic mechanical tension via ERK1/2 pathway,con⁃tributes to osteodifferentiation of human periodontal ligament fi⁃broblasts[J].J Cell Physiol,2015,230(10):2426⁃2436.
[4]WANG W,ZHANG Y,XU M,et al.Fenoterol inhibits LPS⁃in⁃duced AMPK activation and inflammatory cytokine production through beta⁃arrestin⁃2 in THP⁃1 cell line[J].Biochem Biophys Res Commun,2015,462(2):119⁃123.
[5]顾巧丽,杨惠林,施勤.二甲双胍对PMMA颗粒作用下的间充质干细胞成骨分化的影响[J].实用医学杂志,2017,33(14):2263⁃2266.
[6]KONDO A,OTSUKA T,KATO K,et al.AMP⁃activated pro⁃tein kinase regulates thyroid hormone⁃stimulated osteocalcin synthesis in osteoblasts[J].Int J Mol Med,2013,31(6):1457⁃1462.
[7]王成强,何盛茂,谢小波,等.钛颗粒诱导松动界膜中滑膜成纤维细胞HIF⁃1α的表达抑制其对RANKL/OPG信号通路的活化作用[J].实用医学杂志,2017,33(10):1580⁃1583.
[8]MORALES D R,MORRIS A D.Metformin in cancer treatment and prevention[J].Annu Rev Med,2015,66:17⁃29.
[9]LI L,HAN R,XIAO H,et al.Metformin sensitizes EGFR⁃TKI⁃resistant human lung cancer cells in vitro and in vivo through in⁃hibition of IL ⁃6 signaling and EMT reversal[J].Clin Cancer Res,2014,20(10):2714⁃2726.
[10]TSUTSUMI Y,NOMIYAMA T,KAWANAMI T,et al.Com⁃bined Treatment with Exendin⁃4 and Metformin Attenuates Pros⁃tate Cancer Growth[J].PLoS One,2015,10(10):e139709.
[11]陈纪涛,陈良才,贾小婷,等.低浓度二甲双胍对肝癌细胞线粒体形态结构及功能的影响[J].实用医学杂志,2016,32(6):875⁃878.
[12]孟庆玲,金秀萍,吴乃君,等.二甲双胍对胰岛素抵抗状态的小鼠胚胎成纤维细胞中腺苷酸活化蛋白激酶及葡萄糖转运子4表达的影响[J].中国糖尿病杂志,2014,22(02):177⁃180.
[13]FU Y L,ZHANG Q H,WANG X W,et al.Antidiabetic drug metformin mitigates ovarian cancer SKOV3 cell growth by trig⁃gering G2/M cell cycle arrest and inhibition of m⁃TOR/PI3K/Akt signaling pathway[J].Eur Rev Med Pharmacol Sci,2017,21(5):1169⁃1175.
[14]QIN X,JIANG T,LIU S,et al.Effect of metformin on ossifica⁃tion and inflammation of fibroblasts in ankylosing spondylitis:An in vitro study[J].J Cell Biochem,2018,119(1):1074⁃1082.

