食管鳞癌组织中TRIM28和p16的表达与临床病理因素的关系
孙微 刘博 李秀娟 李坤 林媛媛 吕洋 李凤玉
河北北方学院 1组织学与胚胎学教研室,3病理教研室(河北张家口 075000);2河北北方学院附属第一医院病理科(河北张家口 075000);4解放军251医院肿瘤科(河北张家口 075000)
近年来,肿瘤已成为危害人类生命的头号杀手,所有肿瘤中病死率位居第6位的是食管癌,其5年生存率 <20%[1],其中食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)为最常见的组织分型[2]。目前,医者对于肿瘤的治疗主要着眼于手术及术后放、化疗,在治疗方式上已取得较大突破,但患者的总生存期改善效果不佳,大部分ESCC患者确诊时已到晚期,且预后较差易转移或复发,因此尽早找到治疗ESCC的关键靶点迫在眉睫。三结构域蛋白家族(tripartite motif,TRIM)是近年发现的影响肿瘤细胞生长、侵袭、迁移的重要调控家族,其中该家族成员TRIM28是肿瘤发展中主要的调节因子[3]。TRIM28可使细胞本身对DNA损伤的敏感性增强,进而阻止凋亡发生并调控细胞节律周期,研究表明TRIM28在宫颈癌、结直肠癌、胃癌、肺癌、乳腺癌、甲状腺癌等多种癌症中均高表达,且与患者的不良预后相关[3]。但目前国内外尚未见TRIM28基因在食管癌中生物学作用的相关报道。p16基因又叫做多肿瘤抑制基因1(multiple tumor suppressor 1,MTS1),是一种直接参与细胞周期节律性调控的新型抑癌基因,其负性调节细胞的分裂衍生,p16基因缺失、突变将直接导致肿瘤细胞恶性生长[4]。研究[5]发现 p16基因在卵巢癌、胰腺癌、肾癌、膀胱癌等多种肿瘤中低表达,且与患者病理特征相关。本研究通过免疫组织化学染色及免疫荧光染色技术,对136例ESCC患者肿瘤组织及37例距肿瘤边缘5 cm以上的正常食管黏膜组织中的TRIM28和p16进行检测,观察ESCC中TRIM28和p16的表达情况及与临床病理特征的相关性,从而为食管癌的早期发现、早期诊断、早期治疗提供新的实验依据。
1 资料与方法
1.1 一般资料本研究应用随机的方式,收取2008年1月1日至2009年12月31日间河北北方学院附属第一医院136例原发性ESCC患者手术切除的组织标本,同时选取37例距癌组织边缘5 cm以上的正常食管黏膜组织作为对照,经病理证实对照标本均未见癌细胞浸润、细胞增生、炎症等病变。136例原发性ESCC患者的临床及随访资料均齐全,且在术前均未接受过其他治疗,年龄27~80岁(中位年龄61岁),其中女45例,男91例。每一病例选择相同的蜡块取4 μm厚连续切片备用。
1.2 研究方法
1.2.1 主要试剂兔抗人TRIM28多克隆抗体、鼠抗人p16多克隆抗体(America⁃Gene Tex公司);枸橼酸缓冲液、DAB显色剂、PBS缓冲液、S⁃P免疫组化试剂盒(China⁃北京梦怡美生物科技公司);异硫氰酸荧光素(FITC)标记山羊抗鼠IgG(America⁃Santa Cruz公司);TritionX⁃100、DAPI显色剂、抗体稀释液(China⁃北京依诺凯生物科技公司)。
1.2.2 免疫组织化学染色将标本切片脱蜡水化,高压加热法进行抗原修复10~15 min,随后滴加内源性阻断剂阻断8 min;加入一抗使其将组织完全覆盖(对照组织一抗用PBS代替,结果为阴性),4℃过夜后取出复温25 min,PBS浸洗3次,严格按照试剂盒说明书顺序依次滴加二抗等试剂;接着加入室温下已配制的新鲜二氨基联苯胺液(DAB液),显色5 min;最后依次复染、脱水、封片固定。
结果判定:由两位病理科主任医师在双盲的条件下评判全部免疫组化染色结果,并进行图像采集;TRIM28和p16蛋白的阳性信号均主要定位于细胞核,胞核呈现染色一致的棕黄色颗粒或丝状物判为阳性。权衡阳性细胞占观察细胞的百分比大小及着色效果的强弱对染色结果进行判定:遵循随机化的原则,选取5个高倍镜视野分别计算每个视野下阳性细胞所占百分比并得出平均数,依阳性细胞数量所占百分比大小评为0~3分,阳性细胞<10%评为0分,10%~49%评为1分,50%~74%评为2分,≥75%为3分;同理着色强弱也评为0~3分,无色评为0分,灰黄色评为1分,金黄色评为2分,棕黄色评为3分;最终将两项评定标准所得分数相加按总分进行阴阳分级:0~2分评为阴性,≥3分评为阳性。
1.2.3 免疫荧光染色向已脱蜡至水的组织标本滴加1%TritionX⁃100进行破膜,随后用枸橼酸缓冲液抗原修复15 min,加入封闭液,用滤纸轻柔吸去组织表面封闭液,滴加一抗并覆盖全部组织;4℃过夜后取出避光复温25 min,以下操作均在暗室内进行,PBS浸洗3次,滴加FITC标记的荧光二抗,随后在37℃的条件下避光温育45 min;加入新鲜配制的DAPI染色剂,室温孵育15 min进行染色;最后PBS漂洗3次后封片,于激光共聚焦扫描显微镜下观察。
结果判定:在激光共聚焦显微镜下对图像进行采集,呈阳性表达的细胞可见胞核部位显现为黄绿色荧光(FITC),呈点状分布;而阴性表达细胞的胞核可以被DAPI复染而显现为蓝色荧光,且整体背景清晰无其他着色。
1.4 统计学方法所有资料数据结果均通过SPSS 17.0统计软件加工处理。TRIM28及p16蛋白在ESCC组织中表达的特征与患者临床病理表现的关系、两种蛋白在正常食管黏膜组织及ESCC组织中表达量差异均用χ2检验分析处理;采用Spearman等级相关分析处理TRIM28及p16蛋白在ESCC组织中表达相关性。P<0.05表示差异具有统计学意义。
2 结果
2.1 TRIM28及p16在两种组织中的表达情况蛋白表达结果显示,TRIM28的阳性率在ESCC组织(91.2%)高于正常食管黏膜组织(24%),而p16的阳性率在ESCC组织(32.4%)则低于食管黏膜组织(57%),差异均有统计学意义(均P<0.05)。见图1、2及表1。

图1 TRIM28及P16在136例ESCC中的表达情况(SP×200)Fig.1 The expression of TRIM28 and P16 in 136 cases of ESCC(SP × 200)
2.2 TRIM28及p16的表达与患者临床病理特征的关系TRIM28及p16在ESCC的异常表达均与患者肿瘤的浸润深度、TNM分期、有无淋巴结转移相关(均P<0.05)。具有高TNM分期、伴有淋巴结转移表现且浸润程度侵及全层的ESCC患者,其肿瘤组织中的TRIM28表达较强而p16表达较弱。见表2。
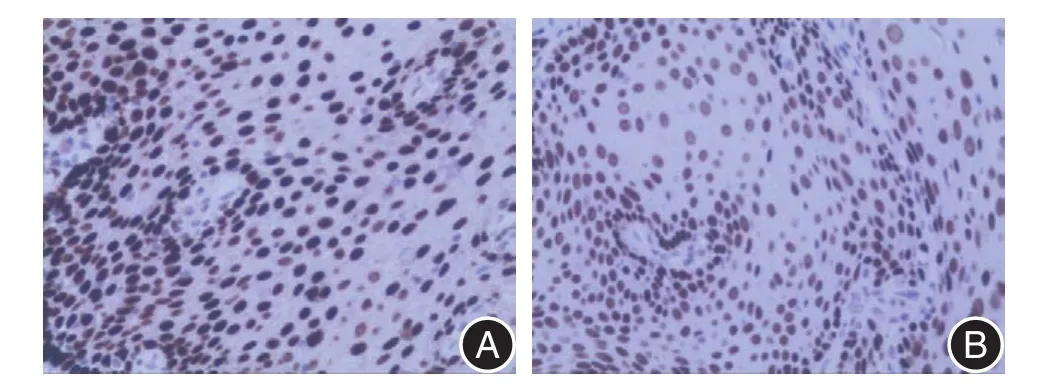
图2 TRIM28及P16在37例正常食管黏膜中的表达情况(SP×200)Fig.2 The expression of TRIM28 and P16 in 37 cases of normal esophageal mucosa(SP × 200)
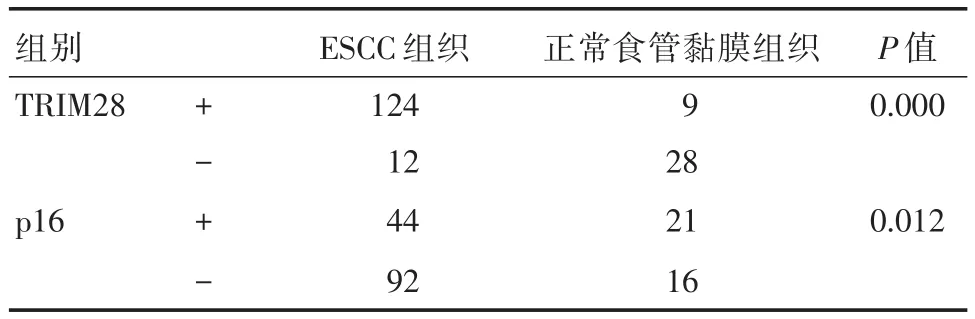
表1 TRIM28及p16在ESCC和正常食管黏膜组织中的表达情况Tab.1 The expression of TRIM28 and p16 in ESCC and normal esophageal mucosa 例

表2 TRIM28及p16的表达与ESCC患者病理情况的关系Tab.2 The expression of TRIM28,p16 and their relation to clincopathologic factors in esophageal carcinoma 例
2.3 免疫荧光染色结果激光共聚焦显微镜下观察TRIM28及p16二者阳性信号在ESCC组织中的定位表达情况。结果发现,二者在ESCC组织中均定位于胞核。见图3。
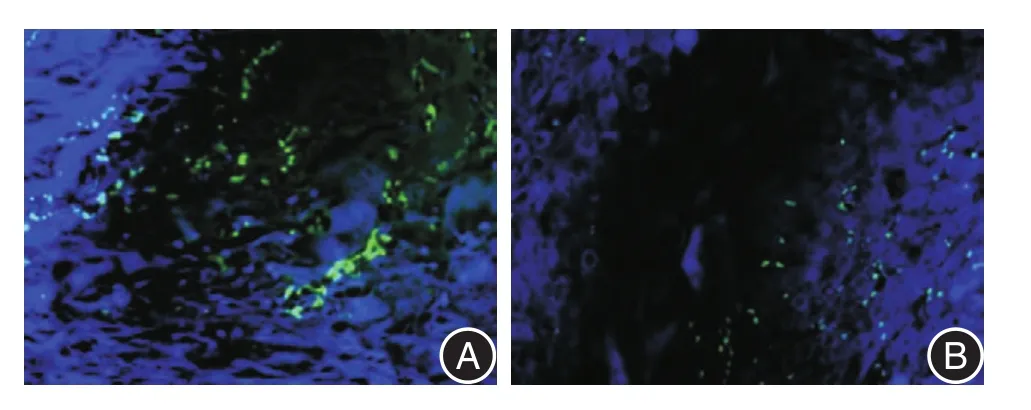
图3 TRIM28及p16在136例ESCC中的定位情况Fig.3 The location of TRIM28 and p16 in 136 cases of ESCC
2.4 TRIM28及p16在ESCC中表达的相互关系TRIM28与p16在ESCC组织中的表达呈负相关(r=-0.284)。TRIM28在p16阳性组中的表达率(79.5%)低于其在p16阴性组中的表达率(96.7%),差异具有统计学意义(P=0.001)。
3 讨论
ESCC形成及恶化的生物学过程极为复杂,在诸多生理病理因素的影响下其病死率及术后复发率逐年攀升,而致其复发的根基在于癌细胞的侵袭迁移。在多种基因参与及多个生物化学反应发生的条件下癌细胞才能在其宿主体内顺利完成迁移,目前,研究发现,原癌基因激活及抑癌基因失活的动态平衡失调将直接主导癌细胞的转移[6]。HATAKEYAMA[7]发现TRIM家族的多位成员均以原癌或抑癌基因的身份作用于肿瘤细胞从而参与肿瘤生长的生物过程。TRIM28也被称为TIF1β或KAP1,有研究报道,TRIM28是调节人类机能的枢纽站,其可在DNA损伤反应、免疫反应、肿瘤反应、病毒复制、细胞分裂分化等生物学进程中展现调节功能,例如TRIM28可通过修复DNA损伤反应从而加速肿瘤细胞周期,行使类似原癌基因的功能促进肿瘤生长进展[8]。TRIM28不仅是一个稳定的表观遗传基因,更是一个无处不在的过表达基因,其多种生物学功能及作用机制的相关研究是在癌症研究基础上进行的。ADDISON等[9]在细胞实验研究中观察到,乳腺癌细胞系中的TRIM28基因表达过高且其高表达有助于癌细胞寻找新的肿瘤微环境发生迁移。LIU等[10]通过克隆形成实验、RNA干扰技术等研究表明在非小细胞肺癌组织中TRIM28基因表达上调,且当TRIM28基因表达被siRNA阻断后,肺腺癌细胞生长受到抑制。FITZGERALD等[11]采用细胞及临床实验相结合的方式对TRIM28在结直肠癌组织中的表达情况进行研究,结果发现其在结直肠癌中高表达,并可通过降低其表达的方式,实现对结直肠癌细胞衍生及迁移的控制。但目前国内外罕见TRIM28基因在食管癌中表达情况的相关报道。本研究为回顾性研究,主要通过免疫组化技术检测TRIM28在136例ESCC组织中的表达情况,结果发现TRIM28在食管癌的进程中扮演促癌基因的角色,其阳性表达率高达91.2%,与之相比其在正常食管黏膜组织中的阳性率仅为24%,差异有统计学意义(P<0.05)。本研究还发现TRIM28表达程度越高ESCC患者的TNM分期也越高,且多伴有肿瘤浸润深达全层及淋巴结转移的发生,表明TRIM28与ESCC的恶性进程相关。本研究结果显示在ESCC中TRIM28表达水平显著上升,且其高表达与患者肿瘤转移恶化相关,这与上述前人研究其在宫颈癌、胃癌、结直肠癌、乳腺癌等肿瘤中表达上调的趋势基本一致,再次验证了TRIM28与肿瘤侵袭迁移的相关性,为寻找攻破肿瘤的作用靶点开辟新路径。
p16基因位于人染色体9p21上,最常见的抑癌基因之一,包含2个内含子及3个外显子[12]。肿瘤方面的相关实验研究表明,癌细胞株中p16基因发生突变或缺失,均促使p16蛋白合成受阻,从而造成细胞失控性增殖促进肿瘤衍生[13]。p16蛋白是介导细胞周期节律调控的基因表达产物,是搭建各种肿瘤衍生和细胞节律异常之间的桥梁物质之一。史恩溢等[14]研究发现p16基因在胃肠间质瘤组织中表达明显下调,且其表达随肿瘤的衍生恶化而降低。NA等[15]探究p16蛋白在卵巢肿瘤中的表达情况时发现,肿瘤组织中p16的表达强度明显低于正常卵巢组织,另外,存在淋巴结转移患者较无转移患者的p16蛋白表达强度更低。本研究结果显示,p16的阳性率在ESCC组织低于食管黏膜组织,且其表达与ESCC患者的TNM分期、有无淋巴结转移、浸润程度等相关,在TNM分期较高、有淋巴结转移且肿瘤浸润程度较深的患者组织标本中检测到p16表达强度均较弱,此结果与DEY等[16]的研究结果相一致。
本研究结果还显示:TRIM28与p16在ESCC组织中的表达呈负相关。p16在TRIM28阳性患者组织标本中的表达率低于其在TRIM28阴性患者组织标本中的表达率;此外,它们在ESCC组织中的定位将直接关系到其功能的执行情况,本研究发现二者的阳性信号均定位于胞核,它们通过介导癌细胞周期节律紊乱,加速细胞周期促使癌细胞失控性增殖,进而参与肿瘤衍生进程。在此进程中,p16基因执行抑癌功能的命令被阻断,而TRIM28基因通过修复DNA损伤反应加速肿瘤细胞周期,它们相互作用、相互影响,促进肿瘤细胞生长发挥类似原癌基因的功能,但具体机制还未研究清楚需进一步研究探讨。
综上所述,笔者认为TRIM28与p16参与调控ESCC的发生及恶化,同时二者表达情况还与ESCC患者的TNM分期、有无淋巴结转移、浸润程度等病理特征相关,有可能成为ESCC靶向生物治疗的重要靶点,并辅助ESCC早期诊断、临床治疗及患者预后评估,为攻破ESCC提供新思路、新依据。
[1]BEHRENS A,ELL C,LORDICK F.Perioperative and pallia⁃tive chemotherapy for esophageal cancer[J].Viszeralmedizin,2015,31(5):341.
[2]EROQLU A,AYDIN Y,ALTUNTAS B.The increasing inci⁃dence of esophageal squamous cell carcinoma in women in Turkey[J].Turk J Med Sci,2016,46(5):1443⁃1448.
[3]CUI Y,YANG S,FU X,et al.High levels of KAP1 expression are associated with aggressive clinical features in ovarian cancer[J].Int J Mol Sci,2015,16(1):363⁃377.
[4]ACOSTA F,KOJIMA Y,YANG M,et al.Histiocytic sarcoma with p16⁃overexpression presenting as uterine cervical mass[J].Ann Clin Lab Sci,2017,47(6):758⁃760.
[5]MOU H,YU L,ZHENG X,et al.p16 gene expression in pan⁃creatic cancer tissue and its importance in diagnosis[J].J Biol Regul Homeost Agents,2017,31(4):1043⁃1047.
[6]LIN D C,KOEFFLER H P.Genomic lesions drive the metasta⁃sis of esophageal squamous cell carcinoma[J].J Thorac Dis,2017,9(10):3523⁃3524.
[7]HATAKEYAMA S.TRIM family proteins:roles in autophagy,immunity,and carcinogenesis[J].Trends Biochem Sci,2017,42(4):297⁃311.
[8]CZERWINSKA P,SHAH P K,TOMCZAK K,et al.TRIM28 multi⁃domain protein regulates cancer stem cell population in breast tumor development[J].Oncotarget,2017,8(1):863⁃882.
[9]ADDISON J B,KOONTZ C,FUGETT J H,et al.KAP1 pro⁃motes proliferation and metastatic progression of breast cancer cells[J].Cancer Res,2015,75(2):344⁃355.
[10]LIU L,XIAO L,LIANG X,et al.TRIM28 knockdown increas⁃es sensitivity to etoposide by upregulating E2F1 in non⁃small cell lung cancer[J].Oncol Rep,2017,37(6):3597⁃3605.
[11]FITZGERALD S,SHEEHAN K M,OGRADY A,et al.Rela⁃tionship between epithelial and stromal TRIM28 expression pre⁃dicts survival in colorectal cancer patients[J].J Gastroenterol Hepatol,2013,28(6):967⁃974.
[12]WANG L J,YU X,ZHANG Z,et al.Prognostic significance of overexpressed p16(INK4A)in esophageal squamous cell car⁃cinoma:a meta⁃analysis[J].Biomark Med,2016,10(5):537⁃546.
[13]CARRONE A,RIQANELLI L,SAVONE D,et al.HPV⁃relat⁃ed vulvar diseases and perspectives of p16INK4a immunochem⁃istry:a review of the literature[J].Tumori,2017,103(6):511⁃515.
[14]史恩溢,王晓茹,李小宁,等.P16和CD44在胃肠间质瘤中的表达及其与预后的关系[J].实用医学杂志,2016,32(14):2333⁃2337.
[15]NA K,SUNG J Y,KIM H S,et al.Stromal p16 overexpres⁃sion in adult granulosa cell tumors of the ovary[J].Anticancer Res,2017,37(5):2437⁃2444.
[16]DEY B,RAPHAEL V,KHONGLAH Y,et al.Expression of Cyclin D1 and p16 in esophageal squamous cell carcinoma[J].Middle East J Dig Dis,2015,7(4):220⁃225.

