侧脑室内中枢神经细胞瘤影像表现及病理分析
陈慧 严静东 陈涛 雷贞妮 陈文
南方医科大学南方医院 1影像中心,2信息科(广州 510515)
中枢神经细胞瘤(central neurocytoma,CNC)是神经元起源肿瘤,临床发病率低,2016年WHO中枢神经系统肿瘤分类将其归属于神经元和混合为不确定的病变[1]。此肿瘤缺乏特征性临床表现,主要症状是头痛和梗阻性脑积水所产生的颅内压增高症状,故术前诊断较为困难,但其对放疗敏感,因而正确诊断对于临床治疗有重要意义。本研究搜集30例经病理证实的CNC,结合相关文献就其影像表现进行总结并分析其鉴别诊断,以提高对本病的认识及术前诊断率。
1 资料与方法
1.1 一般资料搜集2010-2017年间经本院手术病理证实的30例脑室内CNC患者的临床资料,其中男16例,女14例。年龄11个月~59岁,平均29.7岁。30例患者中,因头痛、头晕及视物模糊发现者25例,因脑出血发现者2例,因癫痫发现者1例,因体检偶然发现者2例。30例患者均行手术治疗且都经病理及免疫组化证实。
1.2 检查设备和方法CT采用GE LightSpeed16 CT及Siemens SOMATOM Definition双源CT,层厚5 mm,120 kV,64MAS横轴位扫描。MRI采用GE3.0T EXCITE HD磁共振行常规FSE T1WI、T2WI、Flair及T1WI增强扫描,扫描参数:T1WI TR/TE 2 600 ms/23 ms,T2WI TR/TE 5 100 ms/137 ms,层厚5 mm,层距0.5 mm,增强扫描采用高压注射器由前臂正中静脉注射Gd⁃DTPA,剂量为0.2 mL/kg,后行横轴位、冠状位、矢状位扫描,部分同时行1H MRS扫描。
2 结果
2.1 病灶部位、大小及形态30例病例均为单发病灶,27例(27/30)位于单侧脑室前角、体部或孟氏孔区,较大时透明隔受推压向对侧移位;1例(1/30)位于中线区双侧侧脑室;2例(2/30)位于单侧侧脑室后角,其中1例侵及相邻顶枕叶。病灶最大径3.1~7.2 cm,且形态不一,较小者为类圆形,较大者为不规则形。
2.2 CNC的影像学表现
2.2.1 CT所见11例行CT扫描病灶呈等或稍高密度,内部密度不均匀,可见囊变坏死、钙化等混杂密度,钙化呈点状(图1A箭头处)、斑片状或条片状,均伴有一侧或双侧侧脑室扩张积水(图1A⁃1B)。4例(4/11)较大病灶内可见出血。
2.2.2 MRI表现26例(26/28)呈囊实性病变,实性成分T1WI呈不均匀等或稍低信号,T2WI呈不均匀等、稍高信号或混杂信号,病灶中央及外周可见多发囊变、坏死,呈“皂泡样”或“丝瓜瓤样”,中间可见网状及条索状分隔,囊变多位于外周且较大,囊壁与透明隔及侧脑室壁粘连(图2A⁃2B)。矢状面上见病灶与侧脑室顶部幕状相连,6例(6/26)于矢状面可见典型“扇贝征”(图2F箭头处),DWI实性部分呈高或稍高信号,囊性、坏死部分低信号(图2C);尚有4例伴短T1出血信号(图3A)。增强扫描见病灶实性部分多呈轻中度强化,囊泡及钙化区多无强化,病灶内可见血管穿行(图2D⁃2F);另见1例囊泡可见环形强化;另有2例病灶实性部分呈明显强化。2例(2/28)较小病灶呈较均匀稍长T1、稍长T2信号改变。4例行1H MRS扫描病灶均可见Cho峰明显升高,Cr峰及NAA峰降低(图3C)。
2.3 病理检查送检组织镜下瘤细胞弥漫性分布,形成片状结构,胞质红染,瘤细胞圆形,大小较一致,核圆形,胞浆透明,似少突胶质细胞,部分瘤细胞围绕血管形成“假菊形团”结构(图2G箭头处),瘤细胞巢间散在分布无细胞区,即神经毡样结构,内多见点状钙化,可见分枝状薄壁毛细血管。免疫组化检测18例(18/30)GFAP阳性,26例(26/30)Neu⁃N 阳性,8例(8/26)oligo⁃2阳性,1例(1/20)EMA阳性,30例(30/30)Ki⁃67弱阳性,25例(25/27)Syn阳性。
3 讨论
3.1 临床表现与病理特征CNC以青壮年多见,多分布于20~40岁,本组患者平均年龄29.7岁,20~40岁占80%,无明显性别差异,与文献报道一致[2⁃4]。病程长短不一。由于肿瘤位于孟氏孔附近[5],患者主要表现为颅内压增高症状,具体为头痛、头晕、呕吐、视物模糊等,另有侵犯临近脑实质者可出现相应临床表现,如一侧肢体麻木或癫痫等症状[6]。CNC的组织病理学表现与少突胶质细胞瘤(oligodendroglioma,IVO)相似,两种肿瘤细胞弥漫、均匀,细胞核圆形,细胞质少,从病理鉴别较为困难,CHEN等[7]认为许多脑室内肿瘤被诊断为少突胶质细胞瘤,可能其实代表中枢神经细胞瘤。国内姜曙等[8]认为血管周围的“假菊形团”可作为CNC的特征性表现。免疫组化可以提高CNC的诊断价值,文献报道,一般来说,CNC对NeuN和Syn染色呈阳性表达,Olig2染色呈阴性表达,IVOs则相反[7⁃11,13,18],本研究数据分析前者阳性率可符合。30例中有18例观察到CNC表达GFAP,SEUNG等[12]认为这提示CNC来源于脑室或中央管周围具有双向分化即向神经元和神经胶质分化潜能的神经前体细胞。Ki⁃67均弱阳性表达,增值指数0.5%~7%,EMA仅1例阳性表达,提示肿瘤良性或低度恶性,并与此和室管膜细胞瘤和少突胶质细胞瘤鉴别。
3.2 CNC的影像学表现
3.2.1 CT表现病灶为单发类圆形或不规则形肿块,等或稍高混杂密度,边界不清,可见低密度囊变、坏死,部分可见出血,CT对于钙化显示具有明显优势,呈点状、斑片状及条带状高密度[4,7,12,14]。本组11例行CT检查的病例有10例出现钙化,均伴有一侧或双侧侧脑室扩张积水。
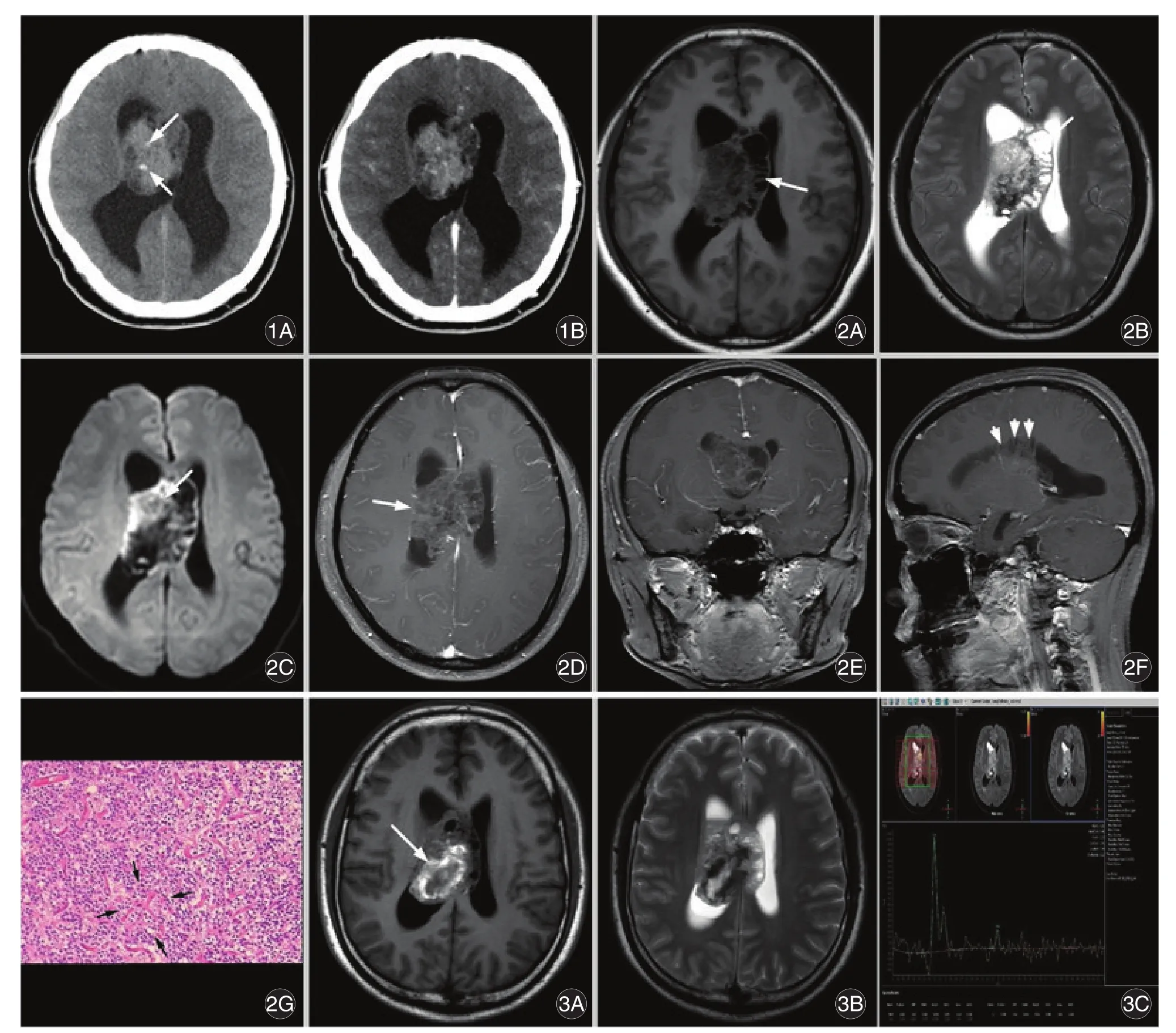
图1 影像及病理图片Fig.1 Image and pathology
3.2.2 MRI表现相对于CT来说,MRI具有独特的优越性,能较好的显示病变部位、边界、内部成分及与周围组织的关系。T1WI呈不均匀等或稍低信号,T2WI呈不均匀等、稍高或混杂信号,瘤内常见长T1长T2囊变、坏死区,被网状结构分隔成“皂泡样”或“丝瓜瓤样”,可见囊壁与透明隔及侧脑室壁粘连[3,5⁃7,15⁃17]。笔者观察 26 例病灶内较大、较多的囊变多位于外周,推测可能有两个原因:一是肿瘤周边小囊泡及坏死结构后的残腔与脑脊液相通,脑室内脑脊液积聚并进入囊腔内;二是脑室扩大牵拉与之粘连的囊壁。矢状面上见病灶与侧脑室顶部幕状相连,部分可见典型“扇贝征”[13],考虑为网状结构受侧脑室顶壁牵拉所致,为特征性表现之一。DWI实性部分呈高或稍高信号,囊性、坏死部分低信号,与王朝艳等[3]的研究结果一致。增强扫描病灶实性部分多呈轻中度强化[3,5,6,14⁃16],这与肿瘤富血供不相符,笔者考虑与瘤内多发囊变、坏死及纤维分隔有关。病灶内可见血管穿行,尚有2例病灶实性部分呈明显强化,囊变坏死及钙化区多无强化,另见一例囊变可见环形强化。本组研究仅4例行1H MRS检查,结果均可见Cho峰明显升高,Cr峰及NAA峰降低。另有文献报道CNC可见Gly峰,并认为这与免疫组化中出现的Syn有直接关系,有助于与其他脑室内肿瘤鉴别[5,13,17],本组研究中 4 例均未见 Gly峰出现,笔者计划就这方面进一步搜集病例及相关文献资料展开研究。
3.3 鉴别诊断本次研究的共有30例病例,较国内外大多数文献报道病例数量多,故统计学意义更大。术前诊断为CNC仅6例(20%),诊断为室管膜瘤7例,诊断为脉络丛乳头状瘤3例,诊断中枢神经细胞瘤与室管膜瘤相鉴别共10例,诊断为中枢神经细胞瘤与脉络丛乳头状瘤相鉴别共2例,另有2例诊断为星形细胞瘤及胶质瘤。由此可见,CNC的术前诊断率较低。主要与两种肿瘤鉴别。(1)室管膜瘤:笔者搜集了本院2010-2017年间经病理证实为幕上脑室内的室管膜瘤仅有4例,其余多位于第四脑室及髓内,由此笔者认为发生于侧脑室内的室管膜瘤较CNC更少见,4例病例为均为中青年,肿瘤均位于孟氏孔附近,3例病灶中央出现较大的囊变坏死,外周囊变少见,边界不清且不呈蜂窝状,增强扫描呈明显环形强化,另外1例较小者无囊变坏死,增强扫描明显均匀强化。(2)脉络丛乳头状瘤:笔者搜集了本院2010-2017年间经病理证实为侧脑室内的脉络丛乳头状瘤共15例,其余多位于第四脑室。多发生于10岁以内的儿童,侧脑室三角区及后角最常见,肿瘤呈分叶状或菜花状,钙化多见,囊变坏死少见,CT为稍高密度,内可见点状及斑片状钙化影,MRI显示病灶为较均匀长T1长T2信号,增强扫描可见明显均匀强化。
综上所述,侧脑室内的CNC发病部位及影像表现具有一定的特征性,多位于侧脑室前中部,CT显示钙化具有优势,MRI诊断价值更高,对于病灶内的成分及其与周围结构的关系显示更清,病灶内“皂泡样”或“丝瓜瓤样”囊变、病灶与侧脑室壁及透明隔粘连、矢状面上“扇贝征”均可作为CNC的特征性影像表现。DWI实性成分高信号,MRS则表现出明显增高的Cho峰及下降的Cr峰及NAA峰,强化多为轻中度强化,符合以上影像表现时应首先想到CNC的可能。NeuN和Syn染色阳性表达及Olig2染色阴性表达则进一步提供确诊依据。
[1]苏昌亮,李丽,陈小伟,等.2016年WHO中枢神经系统肿瘤分类总结[J].放射学实践,2016,31(7):570⁃579.
[2]DEDUSHI K,KABASHI S,UGURE M S,et al.Magnetic reso⁃nance imaging of a case of central neurocytoma[J].Acta In⁃form Med,2016,24(6):419⁃421.
[3]王朝艳,程敬亮,聂云飞,等.ADC联合DWI鉴别中枢神经细胞瘤与室管膜瘤的诊断价值[J].放射学实践,2015,30(10):1011⁃1015.
[4]PARK H K,STEVEN D C.Stereotactic radiosurgery for central neurocytoma:a quantitative systematic review[J].J Neuroon⁃col,2012,108:115⁃121.
[5]马秀华,薛鹏,吕富荣,等.MRI和1H⁃MRS诊断中枢神经细胞瘤[J].中国医学影像技术,2013,29(8):1272⁃1275.
[6]刘永康,戴玲玲,吴越菲,等.典型、不典型中枢神经细胞瘤的 MRI表现[J].临床放射学杂志,2014,33(8):1141⁃1146.
[7]CHEN C L,SHEN C C,LEE H,et al.Central neurocytoma:a clinical,radiological and pathological study of nine cases[J].Clin Neurol Neurosurg,2008,110(2):129⁃136.
[8]姜曙,程永忠.脑室内少突胶质细胞瘤与中枢神经细胞瘤的临床病理分析[J].中国临床神经外科杂志,2002,7(1):11⁃14.
[9]MATSUMOTO H,YOSHIDA Y.Primary intraventricular oligo⁃dendroglioma:a case report of the usefulness of Olig2 immuno⁃histochemistry for diagnosis[J].Neuropathology,2015,35(6):553⁃560.
[10]JAISWAL S,VIJ M,RAJPUT D,et al.A clinicopathological,im⁃munohistochemical and neuroradiological study of eight patients with central neurocytoma[J].J Clin Neurosci,2011,18:334⁃339.
[11]梅开勇,郝卓芳,欧阳小明,等.中枢神经细胞瘤临床病理特点及免疫组化分析[J].广东医学,2010,31(12):1564⁃1566.
[12]LEE S J,BUI T T,CHENG HAO JACKY CHEN,et al.Cen⁃tral neurocytoma:A review of clinical management and histo⁃pathologic features[J].Brain Tumor Res Treat,2016,4(2):49⁃57.
[13]XIAO X,ZHOU J,WANG J,et al.Clinical,radiological,path⁃ological and prognostic aspects of intraventricular oligodendro⁃glioma:comparison with central neurocytoma[J].J Neuro On⁃col,2017,135(1):57⁃65.
[14]DONOHO D,ZADA G.Imaging of central neurocytomas[J].Neurosurg Clin N Am,2015,26(1):11⁃19.
[15]DANIELDONOHO M D,GABRIELZADA M D.Imaging of central neurocytomas[J].Neurosurg Clin N Am,2015,26(1):11⁃19.
[16]MA Z L,LI Y L,SONG J L,et al.The typical and atypical MR imaging findings of central neurocytomas:Report on eigh⁃teen cases and review of the literature[J].Clin Neurol Neuro⁃surg,2016,146:18⁃23.
[17]TLILI⁃GRAIESS K,MAMA N,ARIFA H A,et al.Diffusion weighted MR imaging and proton MR spectroscopy findings of central neurocytoma with pathological correlation[J].J Neuro⁃radiol,2014,41(4):243⁃250.
[18]李自强,黄勇.中枢神经细胞瘤1例[J].实用医学杂志,2008,24(6):905.

