CD8+CIK细胞表面NKG2D及TCR抗原识别受体的功能分析
王耀玲,刘建华
(上海交通大学医学院附属第九人民医院妇产科,上海200011)
近年来,随着免疫卡控点(immune checkpoint)如程序性死亡受体1(programmed cell death protein 1,PD-1)封阻疗法在临床治疗恶性肿瘤取得成功之后,重建或增强抗肿瘤免疫机制的重要性正日益受到关注[1],其中过继细胞治疗(adaptive cell therapy,ACT)作为国内外广泛使用的一种免疫治疗手段,也迎来了一个发展新时期。
细胞因子诱导的杀伤细胞(cytokine induced killer cell,CIK细胞)是国内最常用的ACT方式[2],在多种类型的恶性肿瘤临床治疗中都被证明能够改善患者生存[3-4]。CIK细胞是经γ-干扰素(interferon-γ,IFN-γ)和CD3单克隆抗体(CD3 monocolonal antibody,CD3mAb)激活的一种杀伤性T细胞,其中CD3+CD8+细胞(包括CD56+和CD56-细胞)被认为是CIK细胞中抗癌活性最强的效应细胞亚群。此类CD8+CIK细胞虽然表达多克隆的T细胞受体(T cell receptor,TCR),但能够以人类白细胞抗原(human leukocyte antigen,HLA)非限制的方式杀灭癌细胞。这种免疫效应功能被认为是通过NKG2D(即CD314)抗原识别受体来介导的,如主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ类相关分子(MHC class Ⅰ chain-related molecules,MIC)A+的肿瘤患者多为CIK细胞治疗的获益者[5-6]。也有研究者认为,CD8+CIK细胞更类似经典的细胞毒T细胞(cytotoxic T lymphocytes,CTL),其抗癌效应取决于CD8+CIK细胞表面TCR与靶细胞表面相应HLA-抗原多肽复合物的特异性结合。显而易见,阐明CD8+CIK细胞表面TCR和NKG2D受体的功能有助于深化了解此类效应细胞的抗癌机制并为提高其临床疗效提供研究新思路。
本课题通过磁性细胞分选(magnetic-activated cell sorting system,MACS)技术富集了CD8+CIK细胞,表型分析揭示此类CIK细胞亚群同时表达CD3和NKG2D。在此基础上,以细胞激活表达CD137抗原、分泌IFN-γ和细胞杀伤活性作为评估标志,对CD8+CIK细胞表面上述受体的功能进行了初步分析。
1材料与方法
1.1材料
1.1.1细胞
K562细胞购自中国科学院上海生科院细胞资源中心,培养基用含10%胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养基、100U/mL青霉素及100μg/mL链霉素。CIK细胞用GT-T551培养基、1 000U/mL白介素-2(interleukin-2,IL-2)。培养条件为37℃,5% CO2。
1.1.2试剂
胎牛血清、RPMI 1640培养基(美国Hyclone公司),GT-T551培养基(日本Takara公司),MACS buffer、CD8免疫磁珠(德国Miltenyi公司),IL-2、抗人CD3单克隆抗体(北京同立海源生物科技有限公司),IFN-γ(上海凯茂生物医药有限公司),抗人NKG2D抗体、CD8-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、CD27-FITC、CD28-藻红蛋白(P-phycoerythrin,PE)、HLA-ABC-FITC、MICA/B-PE(美国BD公司),FITC-羊抗鼠IgG(美国Santa Cruz公司),CD3-别藻蓝蛋白(allophycocyanin,APC)、CD4-PE(MACS公司),NKG2D-PE(Biolegend公司),CD137-PE(eBioscience公司)。
1.1.3仪器
流式细胞仪:Accuri C6个人型流式细胞仪-ND,美国BD Biosciences公司;磁珠分选仪:磁珠分选起始套装,德国Miltenyi公司;离心机:L-550型,长沙湘仪离心机仪器有限公司;CO2细胞培养箱:3517-2型,美国SHELLAB公司;倒置生物显微镜:XDS-1B,重庆光电仪器有限公司;生物安全柜:BHC-1300IIA2,阿尔泰实验室设备(北京)有限公司。
1.2方法
1.2.1分离外周血多个核细胞
本研究经上海交通大学医学院附属第九人民医院伦理委员会批准,与志愿者签订书面知情同意书。肿瘤志愿者系本院收治并经病理检查确诊的9位卵巢癌患者。采集20mL外周静脉血,乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝。聚蔗糖-泛影葡胺(Ficoll-Hypaque)密度梯度离心法制备分离外周血多个核细胞(peripheral blood mononuclear cells,PBMCs)。
1.2.2 CIK细胞制备和培养
调整PBMC至1×106/mL,加入1 000U/mLIFN-γ,于含5% FBS的GT-T551培养基中培养1天。次日加入30ng/mLCD3抗体及1 000IU/mL IL-2刺激CIK细胞增殖。适当补充5% FBSGT-T551培养基和1 000U/mL IL-2,连续培养1周。
1.2.3 CD8+CIK细胞的磁性细胞分选(MACS)及培养
收集培养1周的CIK细胞,计数后400g离心10min,弃上清。细胞沉淀重悬于500mL MACS buffer中,加入20μLCD8免疫磁珠标记T细胞。室温放置30min后,加入5mL磷酸缓冲盐溶液(phosphate buffer saline,PBS),400g离心10min,弃上清。细胞沉淀重悬于500mL PBS中,按照生产商提供的操作手册,采用LS分离柱洗脱CD8-细胞,经3mL PBS洗涤3次后,加入5mLPBS,收集CD8+CIK细胞。将分选的CD8+CIK细胞经400g 离心5min,弃上清。用5% FBS-GT-T551培养基调整至1×106/mL。加入1 000U/mL IL-2后置于T25瓶中培养。间隔1~2天取样20μL计数活细胞后,调整细胞密度至5×105/mL并补充1 000U/mLIL-2,连续培养2周。
1.2.4 CD8+CIK细胞免疫表型检测
检测CD3、CD4、CD8、NKG2D、CD27、CD28的表达:5×106CD8+CIK细胞中加入PBS至3mL。400g×5min 离心,弃上清。加入500μL MACS buffer。流式细胞术(flow cytometry,FCM)管(6管)中加入100μL/管细胞及抗体。4℃避光温育30min。加入3mL/管PBS,400g×5min离心,弃上清。加入500μL/管PBS,流式细胞检测阳性细胞。
1.2.5激活CD3及NKG2D抗原受体诱导CD137表达
2mL PBS中加入2μL CD3抗体(1mg/mL),终浓度=1μg/mL,24孔板(3孔实验组和3孔对照组)中分别加入500μL/孔CD3稀释抗体和500μL/孔PBS,37 ℃温育4h。收集CD8+CIK细胞,计数,5%FBS GT-T551培养基调整至2×106/mL,吸净24孔板中上清,每孔加入500μL CD8+CIK细胞(1×106/孔),培养3天。间隔24h,分别收集1孔实验组及对照组细胞,置于FCM管中,加入2mL/管PBS,400g×5min,弃上清。加入200μL/管MACS buffer,均分2管(100μL/管),荧光抗体标记,4 ℃避光温育30min,加入3mL/管 PBS,400g×5min 离心,弃上清,加入500μL/管PBS,检测CD8+CD137+细胞百分比。
24孔板(6孔)中A、B孔加入500μL/孔 PBS,C、D孔CD3抗体包被(1μg/mL),E、F孔NKG2D抗体包被(10μg/mL),操作同上,A、C、E管不加抗体,B、D、E管加入50μL/管叶绿素蛋白(peridininchorophyll protein,PerCP)-CD8抗体和5μL/管PE-CD137抗体。检测CD8+CD137+细胞百分比。
1.2.6激活CD3及NKG2D受体诱导IFN-γ表达
24孔板(A~F共6孔)如上进行抗体包被、CIK细胞制备。加入500μL/孔 CD8+CIK细胞(1×106/孔),37℃温育1h。配置60μg/mL布雷菲德菌素A(Brefeldin A,BFA)溶液,加入100μL/孔(终浓度=10μg/mL),37℃温育过夜。FCM检测CD8+IFN-γ+细胞。
1.2.7靶细胞K562细胞表型检测
K562细胞重悬于MACS buffer中。FCM管内加入100μL/管细胞(6×105/管)。实验组加入20μL/管MICA/B抗体,对照组不加抗体。4℃避光温育30min。加入3mL/管PBS离心洗涤1次。细胞重悬于100μL MACS buffer中。加入5μL/管FITC-羊抗鼠IgG。4℃避光温育30min。加入3mL/管PBS离心洗涤1次。细胞重悬于500μL PBS中,上机检测。FCM管内加入100μL/管K562细胞(6×105/管)。实验组加入5μL/管FITC-HLA-ABC抗体,对照管不加抗体。4℃避光温育30min。加入3mL PBS,400g离心5min,弃上清。细胞沉淀重悬于500μLPBS。以对照组细胞为基准,流式细胞检测实验组中HLA+细胞比例。
1.2.8 NKG2D的抗原识别及细胞杀伤活性检测
收集K562细胞,计数。15mL离心管中加入4×106细胞,加入PBS至10mL。400g×10min离心,弃上清。加入2mL PBS及2μL羧基荧光素双乙酸盐-琥珀酰亚胺酯(carboxyfluoresceindiacetate,succinimidyl ester,CFSE),室温放置5min。加入2mLFBS,摇匀,终止CFSE蛋白标记反应。加入6mLPBS,400g×10min离心,弃上清。加入1mL 5%FBS GT-T551,计数,调整至2×106/mL。FCM管(2管)中加入500μLK562细胞,分为对照管和实验管。实验管中加入20μLNKG2D-Fc重组蛋白。室温放置30min。收集CD8+CIK细胞,计数。取4×107细胞,400g×10min离心,弃上清。加入1mL 5%FBSGT-T551,调整至4×107/mL。FCM管(7管)A~D管加入对照组K562细胞,E~G管加入实验组K562细胞,C、D、F、G管另加CD8+CIK细胞,C、F管E:T(效靶比)=20:1,D、G管E:T=10:1。400g×5min离心。37℃温育4h。B-G管进行PI染色。室温放置15min。加入3mL/管PBS,400g×5min离心,弃上清。加入400μL/管PBS。FCM检测。以B管为对照组,C、D管是实验组,再以E管为对照组,F、G管为实验组,特异性杀伤%=[(实验组PI+%-对照组PI+%)/(100%-对照组PI+%)]×100%。
2结果
2.1 CD8+CIK细胞表达NKG2D受体
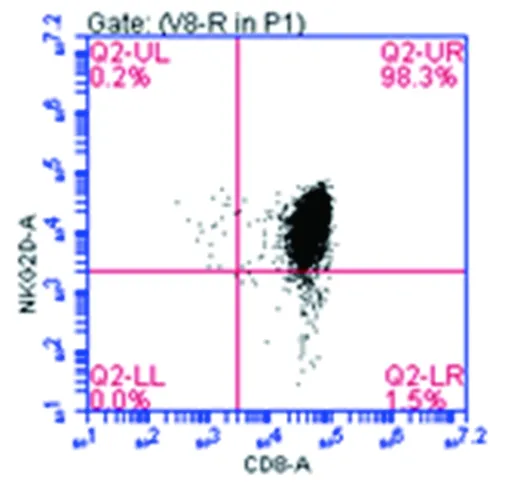
9例卵巢癌志愿者血样用于制备CD8+CIK细胞。实验采用MACS技术从培养2周左右的CIK细胞中获得了CD8+细胞亚群,平均得率为48.4%,平均细胞数为48×106。流式细胞检测显示,分选后的CD8+CIK细胞中CD3+CD8+细胞所占百分比平均为98.5%,CD8+NKG2D+细胞平均达到97.0%,见表1。图1列举了CD8+CIK细胞制备过程中的代表性检测结果(D3供体),如图1A所示,PBMC中CD8+细胞占24.2%,该细胞群中NKG2D阳性率为16.3%。CIK培养后CD8+细胞比例增至88.1%,这些CD8+CIK细胞均表达NKG2D,但其中仍含10%左右的CD8-细胞见图1B。MACS分选去除CD8-细胞后获得了高度均质性的CD8+CIK细胞,其中CD3+CD8+细胞和CD8+NKG2D+细胞分别为99.2%和98.3%,见图1C。

表1 CD8+CIK细胞的纯度与表型(%)



注:A组为PBMC免疫表型特征,B组为CIK细胞分选前表型,C组为CD8+CIK表型。
图1 CD8+CIK细胞表达NKG2D
Fig.1 Expression of NKG2D on surface of CD8+CIK cells
2.2激活CD3及NKG2D受体诱导CD137表达
将CD3抗体包被在培养板中,加入CD8+CIK细胞培养24h、48h和72h后检测CD137表达作为评估细胞激活的标志。图2结果显示,CD3抗体刺激CD3-TCR抗原受体复合物24h即已明显激活CD8+CIK细胞,CD137阳性率可以达到83.1%,但延长培养时间并不能进一步提高CD137+细胞比例。
实验选择培养24h作为观察点评估了NKG2D抗体的激活功能。结果显示,对照组(无抗体包被)细胞中检测不到CD137表达(见图3A、B),CD3抗体组中CD137阳性率为88.8%(见图3C、D),而NKG2D抗体组也未检测到CD137(见图3E、F),提示在CD8+CIK细胞中,NKG2D抗原受体可能并不提供有效的激活信号。

注:A、B、C分别为CD3抗体包被在24h、48h和72h后CD8和CD137的表达。
图2激活CD3诱导CD137表达
Fig.2 Expression of CD137 after activating CD3



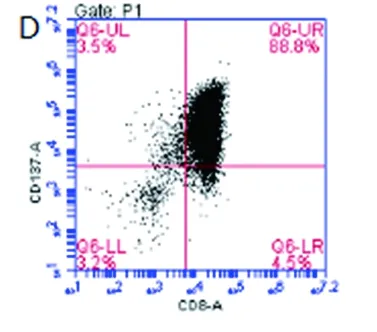

注:A、B为对照组,C、D为CD3抗体包被组,E、F为NKG2D抗体包被组;A、C、E未加荧光抗体作为对照。
图3激活CD3及NKG2D诱导CD137表达
Fig.3 Expression of CD137 after activating CD3 and NKG2D
2.3激活CD3及NKG2D受体诱导IFN-γ表达
CD8+T细胞激活后除了表达CD137外,还能分泌IFN-γ。据此检测了NKG2D抗体对CD8+CIK细胞分泌IFN-γ的影响。实验采用细胞内细胞因子染色(intracellular cytokine staining)技术进行检测,如图4所示,CD3抗体刺激后24h,约50%的CD8+CIK细胞呈IFN-γ染色阳性(见图4B、C),而NKG2D抗体刺激后,IFN-γ阳性率(4.8%和5.6%)高于对照组(2.9%),但明显低于CD3抗体,说明抗体刺激NKG2D受体能够轻度诱导CD8+CIK细胞表达IFN-γ。
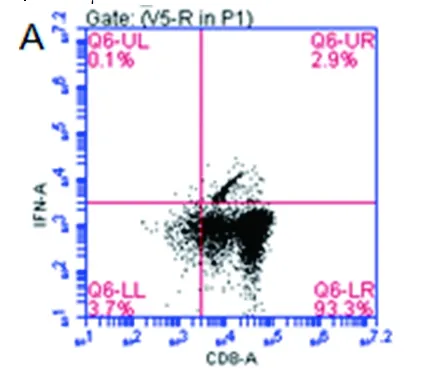
注:A为对照组,B、C为CD3抗体包被组,D、E为NKG2D抗体包被组。
图4激活CD3及NKG2D受体诱导IFN-γ表达
Fig.4 Inducing expression of IFN-γ after activating CD3 and NKG2D
2.4 NKG2D配体诱导IFN-γ表达
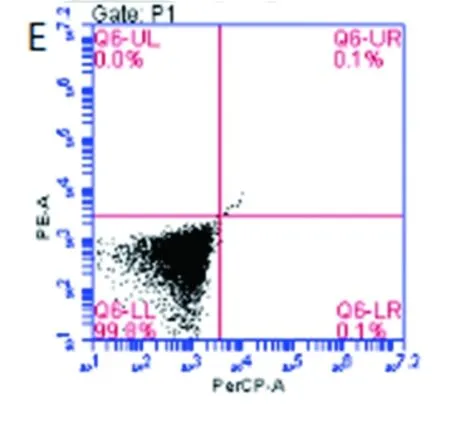
NKG2D属于C型凝集素样表面受体,其识别的主要配体是靶细胞表面的HLA-Ⅰ类抗原相关分子即MICA和MICB。据此我们评估了此类NKG2D配体对CD8+CIK细胞IFN-γ分泌能力的影响。实验选择K562白血病细胞作为刺激细胞,图5结果显示,K562细胞表面不表达HLA-Ⅰ类分子因而不会激活CD8+CIK细胞表面CD3-TCR受体,但MICA/B抗原阳性率为99.7%,所以K562细胞能够被CD8+CIK细胞表面的NKG2D受体识别。
图6结果显示,CD8+CIK细胞经CD3抗体刺激24h后IFN-γ检测阳性率为41.9%,但与K562细胞按1:1比例共培养后阳性率仅为0.5%。由此说明,NKG2D配体也不能明显刺激CD8+CIK细胞分泌IFN-γ。

图5 K562细胞表面HLA-ABC及MICA/B抗原表达
Fig.5 Expressions of HLA-ABC and MICA/B antibodies on the surface of K562 cells




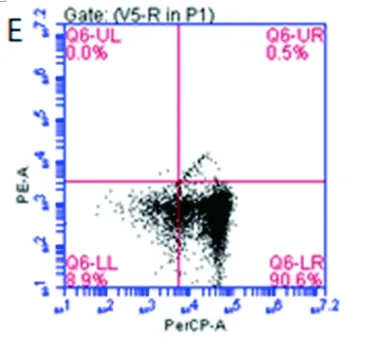

注:A、B为对照,C、D为CD3抗体包被组,E、F为K562细胞共培养组。
图6 K562细胞共培养诱导IFN-γ表达
Fig.6 Expression of IFN-γ induced by K562 cells co-culture
2.5 CD8+CIK细胞的HLA非限制性杀伤活性
CIK细胞具有HLA限制及非限制性的抗癌效应,其中前者通过TCR识别靶细胞表面与HLA分子结合的抗原表位(epitopes),而后者被认为主要通过NKG2D受体的MICA/B抗原识别机制。CD8+细胞是CIK细胞中的主要效应细胞,此类CIK细胞激活后有可能通过NKG2D-MICA/B相互作用识别靶细胞从而发挥免疫攻击效应。
实验采用CD3抗体激活的CD8+CIK细胞作为效应细胞,K562细胞作为靶细胞,并用NKG2D-Fc重组蛋白与靶细胞预温育的方式封阻MICA/B,观察效应细胞的杀伤活性。图7结果显示,当效靶比为20:1时,CD8+CIK细胞对K562细胞的杀伤活性为16.89%,封阻MICA/B后杀伤活性降至13.44%。但效靶比为10:1时,封阻MICA/B对CD8+CIK细胞的杀伤活性没有明显影响。实验结果提示,CD8+CIK细胞具有HLA非限制性的抗癌功能,但NKG2D受体在其抗原识别过程中的作用比较有限。

图7 NKG2D-Fc重组蛋白封阻NKG2D后CD3包被的CD8+CIK细胞的杀伤活性
Fig.7 Cytotoxicity of CD3 antigen-coated CD8+CIK cells after NKG2D blocked by NKG2D-Fc recombinant protein
3讨论
3.1 TCR和NKG2D在CD8+CIK细胞激活和肿瘤杀伤两方面的作用
CIK细胞是一类主要由IFN-γ和CD3抗体多克隆激活之后能活跃增殖并且具有抗癌功能的杀伤T细胞,是如今过继性肿瘤细胞免疫治疗中临床应用最多的效应细胞。资料表明,CIK细胞治疗联合化疗等其他治疗手段可以改善恶性肿瘤患者的预后[7]。然而,CIK细胞制剂存在着明显的个体差异,同时其杀伤活性通常低于抗原特异性激活的细胞毒T淋巴细胞(CTL),抗原识别机制不同是造成这种抗癌能力有所差异的原因之一;此外,肿瘤细胞表面的抗原表达亦存在明显的个体差异,这就为研究和利用CIK细胞不同的肿瘤抗原识别和杀伤机制提出了要求。本研究通过实验和总结,对TCR和NKG2D在CD8+CIK细胞的激活和对肿瘤细胞的杀伤两个方面的功能进行初步分析。
CD137分子与其配体结合之后为T细胞的活化提供第二信号,CD137主要在活化的T细胞表面表达[8],因此可将CD137分子作为T细胞活化的标志。CD8+T细胞激活后除了表达CD137外,还能分泌IFN-γ。本实验首先分别利用CD3抗体和NKG2D抗体来刺激TCR和NKG2D受体,以CD137的表达作为激活标志,结果证明刺激TCR可以活化CD8+CIK细胞,但刺激NKG2D抗原识别受体却不能激活CD8+CIK细胞。而采用NKG2D抗体或配体(K562细胞提供)刺激NKG2D受体仅能轻度诱导CD8+CIK细胞表达IFN-γ。因此活化CD8+CIK细胞的主要信号在TCR-CD3复合体上而非NKG2D上。
CD3抗体刺激T淋巴细胞活化(即包被)的原理是高密度、固相结合的CD3抗体能引起T细胞上TCR-CD3复合体的交联而产生活化信号,来刺激T细胞的活化和增殖。高浓度CD3单抗包被可以达到迅速刺激T细胞活化与增殖的目的,但活化的同时诱导的凋亡作用(activation induced apoptosis,AICD)也很明显[9]。根据前期实验并参考文献,本研究选择1μg/mL浓度的CD3单抗进行包被。
K562细胞表型检测结果与资料[10]反映的HLA-Ⅰ类分子(-)、MICA/B(+)表型一致,所以K562细胞不能被TCR识别、只能被NKG2D识别,即TCR与K562细胞无法相互作用,CD8+CIK细胞对K562细胞的杀伤效应只能通过HLA非限制性的途径发挥。
实验在刺激TCR使CD8+CIK细胞活化的基础上封阻NKG2D与MICA/B的相互作用后,发现CD8+CIK细胞的杀伤活性部分受到抑制。可见CD8+CIK细胞能以HLA非限制的方式杀伤靶细胞,这种杀伤效应可由NKG2D介导,但其作用比较有限。
由此总结,TCR能够提供活化信号激活CD8+CIK细胞;而NKG2D不能提供有效的激活信号,它只能与其配体相互作用从而介导HLA非限制的抗癌功能,故当靶细胞表面没有TCR可识别的抗原表达或靶抗原未能与之结合(靶细胞表面HLA阴性、HLA不相合)时,可由NKG2D识别相应靶抗原即NKG2D配体,相当于在效应细胞与靶细胞之间架桥使二者结合起来,并转导信号至CIK细胞内部,产生杀伤效应。然而,NKG2D受体在其抗原识别过程中的作用比较有限,CIK细胞主要通过TCR进行抗原识别,启动免疫应答。
一方面,CD8+CIK细胞表面表达多克隆的TCR,能够识别结合靶细胞表面HLA-抗原多肽复合物产生活化信号,经过CD3分子将刺激信号转导至T细胞内部,而激活CD8+CIK细胞,启动免疫应答。另一方面,CD8+CIK细胞上的NKG2D受体能以HLA非限制的方式识别肿瘤细胞表面的NKG2D配体,即MICA、MICB和UL-16结合蛋白(UL-16 binding proteins,ULBPs),其抗癌机制是NKG2D-NKG2DL相互作用后,招募衔接蛋白(adaptor protein,DAP)10而激活下游的Grb2-vav-SOS1及PI3k-AKT信号通路,通过脱颗粒效应即促使CD8+CIK细胞释放穿孔素和颗粒酶,引起靶细胞凋亡。据此可知,CD8+CIK细胞兼有TCR和NKG2D抗原识别受体的表达,并能够通过此二者分别以HLA限制及非限制的方式发挥免疫效应功能,以前者的作用为主。
3.2探究CD8+CIK细胞抗癌特别是卵巢癌的意义
所有NKG2D配体分子在正常成年组织细胞表面均很少表达,但可表达于许多肿瘤细胞表面。现已发现在人体肿瘤中,NKG2D配体在乳腺癌、肺癌、卵巢癌、结肠癌、肾癌、前列腺癌、胶质瘤、黑色素瘤和白血病中皆有明显表达。而CD8+CIK细胞均表达NKG2D受体。本研究显示CD8+CIK细胞上NKG2D诱导的免疫效应相对有限,NKG2D介导的抗原识别和杀伤效应仍有待进一步探究利用。
那么,CD8+CIK细胞治疗卵巢癌的价值何在?①卵巢癌作为一种高度恶性的女性生殖系统肿瘤,死亡率居于妇科恶性肿瘤之首,多种治疗方法效果都不尽如人意,需要探索更加有效的辅助治疗方式,资料表明,CIK细胞治疗联合化疗等其他治疗手段可以改善恶性肿瘤患者的预后;②正常卵巢不表达NKG2D配体,但NKG2D配体不同程度地广泛表达于卵巢癌,McGilvray等[11]研究发现,大多数卵巢肿瘤以中至高强度表达一种或多种配体,故可将其作为治疗靶点;③易发生腹腔转移是卵巢癌的生物学特征之一和严重威胁患者生存的风险因子,利用CD8+CIK细胞控制卵巢癌腹腔转移的优势在于腹腔作为一个闭合空间,输注的免疫细胞更容易发挥抗癌效应,且以腹水的产生和细胞学检测为指标,临床观察时间较短、疗效评估也更加客观方便;④从免疫学的角度,转移的卵巢癌细胞上免疫相关分子的表达与预后密切相关,研究还发现ULBP2和视黄酸早转录物1E(retinoic acid early transcript 1E,RAET1E)阳性表达者预后差[11],故将分选的CD8+CIK细胞(均表达NKG2D)注入封闭的腹腔内,靶向杀灭此类配体阳性的细胞将能改善患者的生存;⑤卵巢癌与其他恶性肿瘤一样具有异质性,加之不同患者癌细胞表面的各种癌抗原和HLA-Ⅰ类分子等表型特征存在明显的个体差异,故CIK细胞通过不同的抗原识别机制和免疫杀伤效应发挥抗肿瘤免疫作用的效果亦表现出很大的差别,这就需要更加个体化、针对性地输注患者所需的免疫细胞进行治疗,若条件允许,必要时还可对患者的癌细胞进行免疫表型检测。因此靶向肿瘤细胞的精准免疫治疗在卵巢癌上具有很大的临床应用价值。
CD8+CIK细胞上两类抗原识别受体TCR和NKG2D的抗原识别机制和介导免疫杀伤效应的作用机理,有待进一步研究,从而为提高这种过继性细胞免疫治疗对包括卵巢癌在内恶性肿瘤的临床疗效提供理论依据,拓展更大的、潜在的临床应用前景。
[参考文献]
[1]Kleponis J,Skelton R,Zheng L.Fueling the engine and releasing the break: combinational therapy of cancer vaccines and immune checkpoint inhibitors[J].Cancer Biol Med,2015,12(3):201-208.
[2]刘军权,朱云,陈复兴,等.不同刺激因子对人CIK细胞功能影响[J].中国实验血液学杂志,2013,21(4):1021-1026.
[3]童刚领,农巧红,秦洁,等.自体CIK 细胞治疗对恶性肿瘤患者免疫功能和生活质量的影响[J].中国肿瘤生物治疗杂志,2015,22(4):504-508.
[4]Wang X M,Yu W W,Li H,etal.Can the dual-functional capability of CIK cells be used to improve antitumor effects?[J].Cell Immunol,2014,287(1):18-22.
[5]Chen Y, Lin G, Guo Z Q,etal. Effects of MICA expression on the prognosis of advanced non-small cell lung cancer and the efficacy of CIK therapy[J]. PLoS One,2013,8(7):e69044.
[6]Chen Y, Lin W S, Zhu W F,etal. Tumor MICA status predicts the efficacy of immunotherapy with cytokine-induced killer cells for patients with gastric cancer[J]. Immunol Res,2016,64(1):251-259.
[7]Li J J,Gu M F,Pan K,etal.Autologous cytokine-induced killer cell transfusion in combination with gemcitabine plus cisplatin regimen chemotherapy for metastatic nasopharyngeal carcinom[J].J Immunother,2012,35(2):189-195.
[8]杨琳,郭明秋,陈立茵.CD137和CD28分子对衰老T细胞bcl-2表达的调控[J].南方医科大学学报,2007,27(9):1427-1430.
[9]孙志亚,何静,陈民佳,等.不同组合CD3、CD28抗体对CIK细胞诱导培养的探索研究[J].重庆医学,2015,44(22):3096-3098.
[10]何金媛,贾祝霞,蔡晓辉,等.NKG2D在细胞因子诱导的杀伤性细胞(CIK)抗血液肿瘤细胞的作用[J].中国实验血液学杂志,2013,21(6):1380-1384.
[11]McGilvray R W, Eagle R A, Rolland P,etal.ULBP2 and RAET1E NKG2D ligands are independent predictors of poor prognosis in ovarian cancer patients [J]. Int J Cancer,2010,127(6):1412-1420.

