宫颈沙眼衣原体感染与不良妊娠结局关系的Meta分析
(首都医科大学公共卫生学院儿少卫生与妇幼保健学系,北京100069)
沙眼衣原体(chlamydia trachomatis,CT)是女性生殖道感染常见的病原体,不仅可以引起育龄妇女生殖系统的各种炎症,而且可使其产生不良孕产结局,并通过母婴传播使新生儿发病。目前国内外很多研究涉及孕妇宫颈CT感染与不良妊娠结局之间的关系,但是结论不尽相同[1-22]。有些研究表明,孕妇宫颈CT感染和胎膜早破[1-13,17]、早产[1-7,9,11,15-16,20]、低出生体重儿[1-4,6,13,15]、新生儿肺炎[3-4,6,12,15,19]、新生儿结膜炎[4-7,15,21]、新生儿感染[2,8,10,13-14]、产褥病率[3,5-7,12]的发生有紧密联系。而另一些研究则认为孕妇宫颈CT感染和胎膜早破[22]、早产[8,10,18]、低出生体重儿[5,16]、新生儿肺炎[5,7]无明显联系。为了更全面的了解我国情况,本文通过对过去20年间国内已发表的相关文献进行综合再分析,以探讨宫颈CT感染与孕妇不良妊娠结局之间的关联强度,为保证孕产妇安全和婴幼儿健康提供依据。
1资料与方法
1.1资料检索
通过计算机检索中国期刊全文数据库(china national knowledge infrastructure,CNKI)、中文科技期刊全文数据库(维普)、万方-数字化期刊全文库,并辅以文献追溯的方法,收集国内公开发表的所有关于CT感染与妊娠结局关系的研究。检索词包括:“沙眼衣原体”“妊娠结局”。 检索年限为1997年1月1日至2017年9月10日。
1.2 纳入与排除标准
纳入标准:①国内公开发表、并提供原始数据的包含CT感染与妊娠结局关系的研究。②研究对象为产前检查或住院待产的正常孕妇,排除妊娠并发症、合并症及孕期使用抗生素的孕妇。根据宫颈分泌物检测结果将研究对象分为CT阳性组与CT阴性组,对两组研究对象随访至妊娠结束,详细记录其妊娠结局及新生儿情况。③标本均取自宫颈分泌物,CT检测均采用聚合酶链反应(polymerase chain reaction,PCR)技术。
排除标准:①未设对照组;②重复报告或资料雷同、质量较差等无法利用的文献;③综述和摘要等。
1.3统计学方法
分析采用Rev Man 5.3.5软件,计算优势比(odds ratio,OR)及其95%CI作为效应量表示结果。首先对纳入原始文献进行异质性检验,如果P>0.05,可认为多个独立研究具有同质性,选择固定效应模型分析;如果P<0.05,可认为多个研究有异质性,使用敏感性分析或分层分析等异质性处理方法后,仍不具有同质性时则选择随机效应模型分析。Meta分析结果以森林图展示,并以漏斗图来估计发表偏倚是否存在。
2结果
2.1文献基本情况
共检索125篇相关文献,均为中文文献。根据文献的纳入和排除标准,对本次研究所收集到的文章进行评价,通过严格地筛选后,共有15篇文献[1-15]纳入Meta分析中,累计孕妇宫颈CT阳性者903例,CT阴性者3 682例。
2.2宫颈沙眼衣原体感染与不良妊娠结局关系的Meta分析
2.2.1宫颈沙眼衣原体感染与胎膜早破的关系
在纳入的13篇文献[1-13]中,CT阳性组(794例)与CT阴性组(3 438例)发生胎膜早破的例数分别为253例和213例。各研究间有统计学异质性(P<0.00001,I2=76.00%),经敏感性分析等异质性分析和处理后,仍然不具有同质性,故选择随机效应模型进行Meta分析。结果显示,两组间胎膜早破发生差异有统计学意义(OR=7.38,95%CI:4.41~12.36,P<0.00001),见图1。
2.2.2宫颈沙眼衣原体感染与早产的关系
在纳入的12篇文献[1-11,15]中,CT阳性组(802例)与CT阴性组(3 388例)发生早产的例数分别为136例和126例。各研究间无统计学异质性(P=0.32,I2=13.00%),故采用固定效应模型进行Meta分析。结果显示,两组间早产发生差异有统计学意义(OR=4.17,95%CI:3.14~5.54,P<0.00001),见图2。

图1 宫颈沙眼衣原体感染与胎膜早破关系的Meta分析
2.2.3 宫颈沙眼衣原体感染与低出生体重儿的关系
在纳入8篇文献[1-6,13,15]中,CT阳性组(607例)与CT阴性组(1 664例)发生低出生体重儿的例数分别为100例和73例。各研究间无统计学异质性(P=0.45,I2=0.00%),故采用固定效应模型进行Meta分析。结果显示,两组间低出生体重儿发生差异有统计学意义 (OR=4.12,95%CI:2.92~5.80,P<0.00001),见图3。

图3宫颈沙眼衣原体感染与低出生体重儿关系的Meta分析
Fig.3 Meta-analysis of the relationship between cervical CT infection and low birth weight infants
2.2.4 宫颈沙眼衣原体感染与新生儿肺炎的关系
在纳入的7篇文献[3-7,12,15]中,CT阳性组(414例)与CT阴性组(1 250例)发生新生儿肺炎的例数分别为60例和22例。各研究间无统计学异质性(P=0.22,I2=27.00%),故采用固定效应模型进行Meta分析。结果显示,两组间新生儿肺炎发生差异有统计学意义 (OR=8.07,95%CI:4.52~14.41,P<0.00001),见图4。

图4宫颈沙眼衣原体感染与新生儿肺炎关系的Meta分析
Fig.4 Meta-analysis of the relationship between cervical CT infection and neonatal pneumonia
2.2.5 宫颈沙眼衣原体感染与新生儿结膜炎的关系
在纳入的5篇文献[4-7,15]中,CT阳性组(299例)与CT阴性组(1 015例)发生新生儿结膜炎的例数分别为46例和2例。各研究间无统计学异质性(P=0.95,I2=0.00%),故采用固定效应模型进行Meta分析。结果显示,两组间新生儿结膜炎发生差异有统计学意义(OR=26.69,95%CI:9.07~78.49,P<0.00001),见图5。
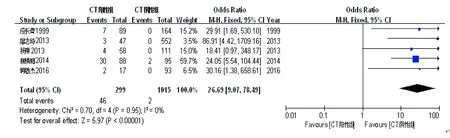
图5宫颈沙眼衣原体感染与新生儿结膜炎关系的Meta分析
Fig.5 Meta-analysis of the relationship between cervical CT infection and neonatal conjunctivitis
2.2.6 宫颈沙眼衣原体感染与新生儿感染的关系
在纳入的5篇文献[2,8,10,13-14]中,CT阳性组(185例)与CT阴性组(594例)发生新生儿感染的例数分别为57例和11例。各研究间无统计学异质性(P=0.06,I2=56.00%),故采用固定效应模型进行Meta分析。结果显示,两组间新生儿感染发生差异有统计学意义(OR=22.58,95%CI:11.45~44.56,P<0.00001),见图6。
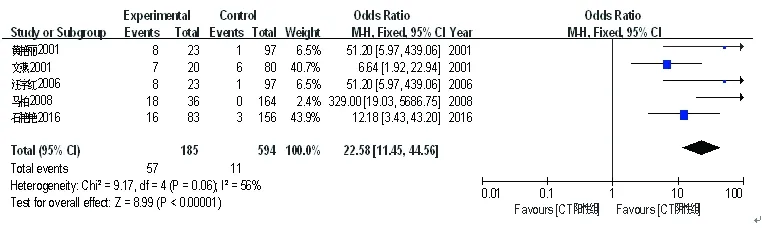
图6宫颈沙眼衣原体感染与新生儿感染关系的Meta分析
Fig.6 Meta-analysis of the relationship between cervical CT infection and neonatal infection
2.2.7 宫颈沙眼衣原体感染与产褥病率的关系
在纳入的5篇文献[3,5-7,12]中,CT阳性组(267例)与CT阴性组(975例)发生产褥感染的例数分别为34例和15例。各研究间无统计学异质性(P=0.17,I2=38.00%),故采用固定效应模型进行Meta分析。结果显示,两组间产褥感染发生差异有统计学意义(OR=5.58,95%CI:2.90~10.76,P<0.00001),见图7。
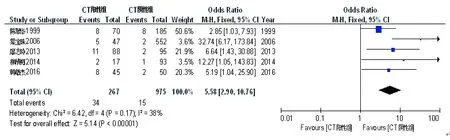
图7宫颈沙眼衣原体感染与产褥病率关系的Meta分析
Fig.7 Meta-analysis of the relationship between cervical CT infection and puerperal morbidity
2.3发表偏倚
对纳入研究的文献分别进行漏斗图分析,其中包括宫颈CT感染与胎膜早破13篇、早产12篇、低出生体重儿8篇、新生儿肺炎7篇、新生儿结膜炎5篇、新生儿感染5篇、产褥感染5篇,发现漏斗图基本呈对称分布,说明发表偏倚较小,纳入的文献较为合理,符合本次研究要求。以早产为例[1-11,15],见图8。

图8纳入12篇文献的漏斗图(早产)
Fig.8 Funnel plot of 12 collected literatures (premature delivery)
3讨论
3.1宫颈沙眼衣原体感染与不良妊娠结局的关系
由于CT检测方法、质量及地区不同,文献报道孕妇CT感染率差异很大。国内外报道PCR法检测孕妇宫颈分泌物CT阳性率为3.9%~35.9%不等[1-16,19,23]。本研究利用Meta分析研究我国宫颈CT感染与不良妊娠结局的关系,结果显示孕妇宫颈CT阳性组中,胎膜早破、早产、低出生体重儿、新生儿肺炎、新生儿结膜炎、新生儿感染和产褥病率的发生率都明显高于CT阴性组,差异有统计学意义,与国外报道结果一致[16,19-21]。
CT感染妊娠期生殖道后分泌脓性粘液,使多形核白细胞数量增加,破坏了邻近羊膜上的溶酶体膜,释放出磷酯酶A2,促进了胎膜上的花生四烯酸转化为前列腺素,诱发宫缩;溶酶体酶的释放对羊膜绒毛膜细胞产生直接的细胞毒性作用,导致胎膜破坏;CT在羊膜细胞上可以增殖,其独特的生活周期使细胞不断被破坏,而减弱膜的张力,导致破裂,因此,胎膜早破[17]及早产[16,20]发生率增加。孕妇宫颈分泌物CT的上行感染不但会感染胎膜,还会感染羊水、胎盘,从而引起新生儿感染,常见感染部位是眼结膜[21]与鼻咽部。CT如果损害胎盘正常的物质循环将会导致新生儿营养不良,出现低体重儿。当CT黏附于宿主细胞中,对新生儿呼吸道纤毛运动产生影响,会导致黏膜表面出现大量炎性细胞渗出物,从而引发新生儿肺炎[19]。
3.2孕前、孕早期常规筛查临床意义
孕妇宫颈CT感染可造成胎膜早破、早产、低出生体重儿、新生儿肺炎、新生儿结膜炎、新生儿感染及产褥感染等不良妊娠结局,对围产儿及孕产妇造成了很大的损害。但由于孕妇CT感染大多数无症状[24],只凭临床症状诊断将漏诊大部分患者,因此,借助实验室检测孕妇是否患有CT感染十分必要,PCR技术简便、迅速、特异性与灵敏度高,应在孕前、孕早期常规筛查[25-31]以便早期诊断,及时规范治疗,从而改善妊娠结局[20],并对降低孕妇及新生儿患病率和致残率有重要意义。
为了考察结论的稳定性,本资料进行了漏斗图分析和敏感性分析,进而判断结果的稳定性和强度。漏斗图基本对称,而敏感性分析结果的OR值均>1,且具有统计学意义(P<0.01),说明此次研究结果比较稳定可靠。但也存在一定局限性:纳入研究均为中文文献且数量偏少,缺乏灰色文献,可能会漏掉阴性结果的研究而产生发表偏倚。因此,需要进行更多高质量流行病学研究,获得更严谨、更客观的临床证据,进一步综合评价CT感染与不良妊娠结局的关系,为临床制订预防、诊断及干预措施提供理论依据。
[参考文献]
[1]韩威婷,贺杉芝.沙眼衣原体、解脲支原体感染对妊娠结局及其新生儿的影响及护理[J].中国性科学,2013,22(9):62-64.
[2]石艳艳,罗红权,李宁,等.解脲支原体及沙眼衣原体感染对妊娠结局的影响[J].湖南中医药大学学报,2016,36(S2):941-942.
[3]梁宝珠.解脲支原体沙眼衣原体与妊娠结局的关系[J].河北医学,2006,12(5):401-402.
[4]杨萍.孕期沙眼衣原体感染对母婴影响的研究[J].河北医药,2013,35(12):1820-1821.
[5]廖志玲,丘耿娴,刘俊锋,等.荧光定量PCR检测943例妊娠期妇女沙眼衣原体结果分析[J]. 现代医院,2013,13(11):65-66.
[6]柳清梅.妊娠期生殖支原体、衣原体感染对妊娠结局的影响[J].河南科技大学学报(医学版),2014,32(2):125-127.
[7]韩敏杰.荧光定量PCR 检测妊娠期妇女沙眼衣原体的结果分析[J].医疗装备,2016, 29(12):22-23.
[8]汪宇红.沙眼衣原体感染与妊娠结局的临床观察[J].中华临床医学卫生杂志,2006,4(7): 70-71.
[9]郭彩琴,陈道桢,许飞,等.育龄妇女沙眼衣原体感染与不良孕产结局的关系[J].中国妇幼保健,2011,26(33):5142-5143.
[10]黄艳丽.沙眼衣原体感染与妊娠结局的临床观察[J].中华医院感染学杂志,2001,11(2): 111-112.
[11]郭英花,刘颖.沙眼衣原体及解脲支原体感染与胎膜早破、早产的关系[J].中日友好医院学报,2002,16(1):11-13.
[12]陈翠华,陈士岭.孕期宫颈沙眼衣原体感染对母婴的影响[J].第一军医大学学报,1999, 19(5):470-471.
[13]马柏,富艳辉.足月妊娠孕妇宫颈沙眼衣原体感染与妊娠结局关系的探讨[J].中国冶金工业医学杂志,2008,25(2):183-184.
[14]文燕.孕妇沙眼衣原体感染妊娠结局比较[J].四川医学,2001,22(5):476-477.
[15]应长青,王滨有,郑冬梅,等.孕妇沙眼衣原体感染与妊娠结局及新生儿发病的关系[J].中华妇产科杂志,1999,34(6):348-350.
[16]Rours G I,Duijts L,Moll H A,etal.Chlamydia trachomatis infection during pregnancy associated with preterm delivery: a population-based prospective cohort study[J].Eur J Epidemiol,2011,26(6):493-502.
[17]荣蓉,万春花.胎膜早破与孕妇生殖道 UU和 CT感染的关系[J].中国妇幼健康研究,2013,24(6):899-901.
[18]Rantsi T,Joki-Korpela P, Wikström E,etal.Population-based study of prediagnostic antibodies to chlamydia trachomatis in relation to adverse pregnancy outcome[J].Sex Transm Dis,2016,43(6):382-387.
[19]Borborema-Alfaia A P,Freitas N S, Astolfi Filho S,etal.Chlamydia trachomatis infection in a sample of northern Brazilian pregnant women: prevalence and prenatal importance[J].Braz J Infect Dis,2013,17(5):545-550.
[20]Folger A T.Maternal Chlamydia trachomatis infections and preterm birth:the impact of early detection and eradication during pregnancy[J].Matern Child Health J,2014,18(8):1795-1802.
[21]Balla E,Petrovay F,Erdösi T,etal. Distribution of chlamydia trachomatis genotypes in neonatal conjunctivitis in Hungary[J]. J Med Microbiol,2017,66(7):915-918.
[22]Nakubulwa S,Kaye D K,Bwanga F,etal.Genital infections and risk of premature rupture of membranes in Mulago Hospital, Uganda: a case control study[J].BMC Res Notes,2015,8:573.
[23]Wangnapi R A,Soso S,Unger H W,etal.Prevalence and risk factors for Chlamydia trachomatis, Neisseria gonorrhoeae and Trichomonas vaginalis infection in pregnant women in Papua New Guinea[J].Sex Transm Infect,2015,91(3):194-200.
[24]Moodley D,Moodley P,Sebitloane M,etal.High prevalence and incidence of asymptomatic sexually transmitted infections during pregnancy and postdelivery in KwaZulu Natal, South Africa[J].Sex Transm Dis,2015,42(1):43-47.
[25]Rours G I,Smith-Norowitz T A,Ditkowsky J,etal.Cost-effectiveness analysis of Chlamydia trachomatis screening in Dutch pregnant women[J].Pathog Glob Health,2016,110(7-8):292-302.
[26]Angelova M,Kovachev E,Tsankova V,etal.Role and importance of chlamydia trachomatis in pregnant patients[J].Open Access Maced J Med Sci,2016,4(3):410-412.
[27]Medline A,Joseph Davey D,Klausner J D.Lost opportunity to save newborn lives: variable national antenatal screening policies for Neisseria gonorrhoeae and Chlamydia trachomatis[J].Int J STD AIDS,2017,28(7):660-666.
[28]Ahmadi A,Khodabandehloo M,Ramazanzadeh R,etal.The relationship between chlamydia trachomatis genital infection and spontaneous abortion[J]. J Reprod Infertil,2016,17(2):110-116.
[29]Sethi S,Roy A,Garg S,etal.Detection of Chlamydia trachomatis infections by polymerase chain reaction in asymptomatic pregnant women with special reference to the utility of the pooling of urine specimens[J].Indian J Med Res,2017,146(Suppl 1):S59-S63.
[30]Nateghi Rostami M,Hossein Rashidi B,Aghsaghloo F,etal.Comparison of clinical performance of antigen based-enzyme immunoassay (EIA) and major outer membrane protein (MOMP)-PCR for detection of genital Chlamydia trachomatis infection[J].Int J Reprod Biomed (Yazd),2016,14(6):411-420.
[31]Bristow C C,Mathelier P,Ocheretina O,etal.Chlamydia trachomatis, Neisseria gonorrhoeae, and Trichomonas vaginalis screening and treatment of pregnant women in Port-au-Prince, Haiti[J].Int J STD AIDS,2017,28(11):1130-1134.

