干旱预处理对盐胁迫下水稻幼苗抗氧化酶活性及AsA-GSH循环的影响
张韫璐, 王 琦, 王金缘, 王宇楠, 刘凯月, 耿梦恬, 郭晴雪, 马莲菊
(沈阳师范大学生命科学学院,辽宁沈阳 110034)
土壤盐碱化是干旱和半干旱地区的主要非生物胁迫,极大地限制着作物生长和产量提高[1]。工厂排出的废水污染、化学肥料的乱施乱放和日光温室的大面积生产等导致土壤盐渍化愈加严重,盐渍土已严重危害了人们赖以生存的地球环境[2],而且土壤含盐量高,会使植物生长发育受到不良影响,如光合作用减弱、膜伤害增加、呼吸代谢紊乱,甚至导致植物死亡[3-4]。
采用PEG预处理植物种子或幼苗,可以有效增强其抗逆性,缓解其在逆境胁迫下受到的伤害。如用不同浓度PEG预处理翅果油树种子,可以提高翅果油树种子的活力指数和发芽速度[5]。用一定浓度PEG预处理刺槐种子,可以提高其抗盐能力[6]。PEG预处理过的青稞种子的发芽率和生根率均提高,并且对青稞幼苗的生长发育也起到了促进作用[7]。然而,关于PEG预处理对盐胁迫下水稻幼苗的影响方面的研究较少,因此本试验采用PEG预处理水稻幼苗,从抗氧化酶活性及AsA-GSH循环中关键酶活性和抗氧化剂含量等方面进行研究,探讨其对盐胁迫下水稻幼苗的影响。
1 材料与方法
1.1 试验材料及处理
试验于2015年在沈阳师范大学进行,供试材料为盐粳48水稻。选取大小一致、种皮完好且饱满的种子,用3% H2O2浸泡10 min后,放入28 ℃恒温箱浸种24 h,用蒸馏水反复冲洗后催芽24 h,播种于600 mL带纱网的塑料烧杯上,利用Hoagland营养液在光照培养箱内培养,定期更换营养液。培养7 d后进行以下处理:(1)对照,用完全营养液培养作为对照;(2)盐胁迫,先用完全营养液培养6 d,后用100 mmol/L NaCl进行盐胁迫处理3 d;(3)10% PEG预处理,开始用含10% PEG的营养液培养3 d,然后用完全培养液培养3 d,最后用含100 mmol/L NaCl的营养液进行盐胁迫3 d。每处理重复3次。
1.2 测定方法
叶绿素含量测定参考张志良的方法[9]。超氧化物歧化酶(SOD)活性测定采用氯化硝基四氮唑(NBT)光氧化还原法[8];过氧化物酶(POD)活性测定采用愈创木酚法[9];过氧化氢酶(CAT)活性测定采用紫外分光光度计法[9];抗坏血酸过氧化物酶(APX)活性测定参考Nakano等的方法[10];谷胱甘肽还原酶(GR)活性测定参考Ma等的方法[11];抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量的测定参照吴强盛等的方法[12]。
1.3 数据处理
采用SPSS 16.0对水稻幼苗不同处理下的抗氧化酶活性、AsA-GSH中关键酶活性和抗氧化剂含量进行LSD-单因素最小显著性差异分析(Least-Significant Difference,One-Way ANOVA,P<0.05),比较不同处理之间的差异性,并用Microsoft Excel制作图表。
2 结果与分析
2.1 PEG预处理对盐胁迫下水稻幼苗叶绿素含量的影响
叶绿素a分子不仅可以摄取和传送光能,并且可以将光能转变成其他能供给植物生长发育,因此也有光能的“捕捉器”之称。叶绿素b的功能则是将摄取的光能准确快速地传送给反应中心色素。从图1可以看出,在盐胁迫下,叶绿素a和叶绿素b含量分别比对照减少18.49%和14.29%,而PEG预处理水稻幼苗的叶绿素a含量和叶绿素b含量分别比盐胁迫高52.07%和77.09%。

2.2 PEG预处理对盐胁迫下水稻幼苗SOD、POD和CAT活性的影响
植物体内的抗氧化酶主要包括SOD、POD和CAT,可以有效清除植物体内的活性氧,减轻植物在逆境下受到的伤害。从图2可以看出,盐胁迫下的SOD、CAT活性与对照相比显著降低(P<0.05),POD活性则显著增高。在PEG预处理下,SOD、POD、CAT活性均高于盐胁迫,分别比盐胁迫高9.93%、6.04%、62.17%。
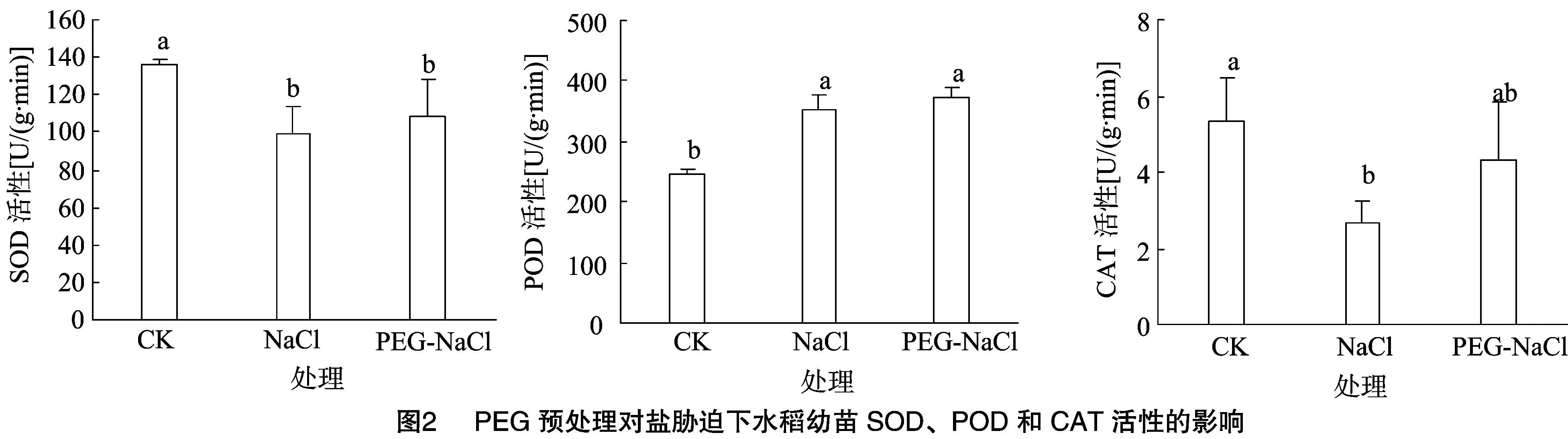
2.3 PEG预处理对盐胁迫下水稻幼苗AsA-GSH循环中相关酶活性的影响
APX和GR是AsA-GSH循环中的关键酶,在活性氧的清除过程中起重要作用。从图3可以看出,盐胁迫下的APX和GR活性均降低,分别比对照低22.23%和33.33%,GR活性降幅更为显著。PEG预处理APX和GR活性均高于盐胁迫,其中APX活性比盐胁迫高85.72%,差异显著,GR活性比盐胁迫高16.68%。

2.4 PEG预处理对盐胁迫下水稻幼苗AsA-GSH循环中非酶类抗氧化剂的影响
AsA和GSH是植物体内重要的非酶类抗氧化剂,并且也是植物细胞中主要的氧化还原缓冲剂,对AsA活性的保持起着重要作用[13]。从图4可以看出,盐胁迫显著降低了AsA的含量。PEG预处理下,AsA含量较盐胁迫提高98.51%,差异显著,GSH含量比盐胁迫高14.29%。
3 讨论
利用外源物质预处理可以减缓逆境胁迫对植物的伤害,如脱落酸预处理可以提高橡胶树芽接苗期抗寒性[14],蔗糖预处理可以有效增加盐胁迫下水稻幼苗的总氮量并提高氮代谢关键酶的活性[15]。PEG作为模拟干旱的一种高分子渗压剂,也常作为外源物质用于增强植物的抗逆性[5-7]。
盐胁迫影响植物叶片内叶绿素含量的变化主要是因为其减慢光合速率,使光合作用受抑制,导致叶绿素含量降低,最终使植物生长发育受影响。本研究表明,在PEG预处理下,叶绿素a和叶绿素b含量均高于盐胁迫处理,说明PEG预处理缓解了盐胁迫对水稻幼苗叶绿素的伤害,从而改善水稻幼苗在盐胁迫下的生长状况。
植物体内有清除活性氧的机制,在逆境条件下,植物体内会产生过多的活性氧,如果超出了植物自我调节的程度,就会因无法清除从而堆积在机体内,活性氧的消除工作主要是由抗氧化酶系统来完成,主要包括SOD、POD、CAT、APX和GR。研究表明,在盐胁迫下水稻幼苗的POD活性有所上升,这与Garg等的研究结果[16]基本一致,说明在一定胁迫内,植物能够通过提高酶活性来抵抗逆境造成的伤害。而SOD和CAT的含量则有所下降,可能是因为该胁迫程度不足以使SOD和CAT迅速启动防御机制,而活性氧的产生又消耗掉了一部分SOD和CAT[17]。在PEG预处理下,水稻幼苗的SOD、POD、CAT活性均高于盐胁迫,说明PEG预处理可以缓解盐胁迫对抗氧化酶活性的影响,使其更有效地清除活性氧(ROS),提高水稻幼苗对盐胁迫的抵抗能力。APX作为存在于植物体内清除H2O2的关键酶,可将AsA氧化为DHA,同时又可以将H2O2还原为H2O,从而保护植物体免受ROS伤害。而GR则可以促使GSH再生,因此植物体内的GR活性也是代表其抗氧化能力的重要标志之一[18]。本试验结果表明,PEG预处理下APX和GR活性较盐胁迫均有所增高,说明PEG预处理可以提高盐胁迫下APX和GR活性,从而更好地保护植物免受盐胁迫所带来的伤害。
AsA和GSH是AsA-GSH循环中2种重要的非酶类抗氧化剂,其含量能反映出植物体对盐胁迫的抵抗程度。研究表明,盐胁迫下AsA和GSH含量均有所减少,这与颜志明等在甜瓜方面的研究结果[19]相吻合,原因可能是其参与自由基清除反应的同时部分被氧化的结果[20],也有可能是因为逆境下AsA与GSH合成能力下降所导致的[21]。但本试验中PEG预处理的AsA、GSH含量高于盐胁迫,说明PEG预处理可以提高盐胁迫下AsA和GSH的含量,减轻盐胁迫对水稻幼苗的伤害。PEG可能是通过影响水稻幼苗中ROS的积累和信号转导途径,调节相关蛋白基因的表达,从而增强其对盐胁迫的抗性。
参考文献:
[1]Allakhverdiev S I,Sakamoto A,Nishiyama Y,et al. Ionic and osmotic effects of Nacl-induced inactivation of photosystems Ⅰ and Ⅱ inSynechococcussp.[J]. Plant Physiology,2000,123(3):1047-1056.
[2]王春裕. 论盐渍土之种稻生态改良[J]. 土壤通报,2002,33(2):94-95.
[3]李海波,陈温福,李全英. 盐胁迫下水稻叶片光合参数对光强的响应[J]. 应用生态学报,2006,17(9):1588-1592.
[4]沙汉景. 外源脯氨酸对盐胁迫下水稻耐盐性的影响[D]. 哈尔滨:东北农业大学,2013.
[5]袁丽环,闫桂琴,朱志敏. PEG预处理和低温促进翅果油种子萌发的研究[J]. 中国农学通报,2009,25(10):112-115.
[6]曹帮华,毛培利,牟洪香. PEG预处理对刺槐种子抗盐性的影响[J]. 种子,2004,23(3):19-21.
[7]姚晓华,吴昆仑. PEG预处理对青稞种子萌发、幼苗生长和抗旱性的影响[J]. 中国农业大学学报,2013,18(6):80-87.
[8]朱广廉. 植物生理学实验[M]. 北京:北京大学出版社,1988.
[9]张志良. 植物生理学实验指导[M]. 北京:高等教育出版社,2009.
[10]Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[11]Ma F,Cheng L. The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J]. Plant Science,2003,165(4):819-827.
[12]吴强盛,邹英宁,夏仁学. 水分胁迫下丛枝菌根真菌对红橘叶片活性氧代谢的影响[J]. 应用生态学报,2007,18(4):825-830.
[13]Shalata A,Mittova V,Volokita M,et al. Response of the cultivated tomato and its wild salt-tolerant relativeLycopersiconpennelliito salt-dependent oxidative stress:the root antioxidative systetem[J]. Physiologia Plantarum,2001,112(4):487-494.
[14]王纪坤,张盈盈,王立丰,等. 脱落酸预处理提高橡胶树芽接苗期抗寒性的研究[J]. 热带农业工程,2016,40(3):16-20.
[15]王志强,丁 立,徐晋豫,等. 蔗糖预处理对盐胁迫小麦幼苗氮同化的影响[J]. 河南农业大学学报,2008,42(3):268-272.
[16]Garg N,Chandel S. Role of arbuscular mycorrhiza in arresting reactive oxygen species (ROS) and strengthening antioxidant defense inCajanuscajan(L.) Mill sp. nodules under salinity (NaCl) and cadmium (Cd) stress[J]. Plant Growth Regul,2015,75(2):521-534.
[17]陈 涛,王贵美,沈伟伟,等. 盐胁迫对红麻幼苗生长及抗氧化酶活性的影响[J]. 植物科学学报,2011,29(4):493-501.
[18]陈坤明,宫海军,王锁民. 植物抗坏血酸的生物合成、转运及其生物学功能[J]. 西北植物学报,2004,24(2):329-336.
[19]颜志明,孙 锦,郭世荣,等. 外源脯氨酸对盐胁迫下甜瓜幼苗根系抗坏血酸-谷胱甘肽循环的影响[J]. 植物科学学报,2014,32(5):502-508.
[20]王 娟,李德全. 水分胁迫对玉米根系AsA-GSH循环及H2O2含量的影响[J]. 中国生态农业学报,2002,10(2):94-96.
[21]Song X S,Hu W H,Mao W H,et al. Response of ascorbate peroxidase isoenzymes and ascorbate regeneration systemto abiotic stresses inCucumissativusL.[J]. Plant Physiology Biochemistry,2005,43(12):1082-1088.

