甜菜幼苗叶片渗透调节系统及部分激素对干旱胁迫的响应
李国龙, 孙亚卿, 邵世勤, 张永丰
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010018; 2.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
干旱是对植物影响较大的逆境生态因子,也是农业可持续发展的一个重要制约因素[1-3]。干旱胁迫使植物细胞分裂,细胞增长被显著抑制,植株生长缓慢;使植物体内活性氧代谢平衡被破坏,大量自由基在细胞内产生,膜质过氧化程度加剧,使膜系统受到损伤甚至损坏,严重时导致细胞组织解体[4-6]。植物对干旱胁迫的响应机制一直是植物生理生态学研究的热点,特别是近年来,随着分子生物学思想和方法的不断渗入,推动该领域的研究与探索步入一个充满活力的新阶段[7]。目前,围绕干旱胁迫下植物表观形态及生理生化应答机制的研究较多[8-12]。然而,植物抗旱性是受多个基因控制的复杂数量性状,涉及细胞渗透调节能力、内源激素调控能力、膜质抗氧化能力、蛋白质抗脱水能力等诸多途径,因此,进一步深入研究植物耐旱性的生理响应机制,明确起关键作用的主效途径,可为下一步有目的地开展抗旱基因组、蛋白组及代谢组研究提供依据。
甜菜(BetavulgarisL .)是我国重要的糖料作物和经济作物之一,其种植区域主要分布在我国东北、西北和华北广大地区,该区域可利用水资源相对匮乏,周期性或难以预期的干旱已成为限制甜菜生产的主要因素[13-14]。除了依赖高效节水的现代化农业灌溉措施来解决这一问题,最大限度地挖掘甜菜自身的抗旱潜力、培育甜菜抗旱新品种是另一条有效途径。而明确不同抗旱性甜菜对干旱的生理响应差异,阐明其抗旱的主要生理途径,明确抗旱相关的重要生理指标,对抗旱甜菜品种的筛选和培育有重要的现实意义。为此,本试验对甜菜幼苗进行不同程度的水分处理,分析不同程度水分亏缺及复水后甜菜幼苗在可溶性糖、可溶性蛋白、脯氨酸、甜菜碱等渗透调节系统及脱落酸、生长素等部分内源激素方面的生理响应,探讨相关生理参数与甜菜抗旱性的关系,以期为进一步研究甜菜对干旱胁迫的响应机制和筛选甜菜耐旱性品种提供参考依据。
1 材料与方法
1.1 材料培养与处理
供试材料为强抗旱品种HI0466(瑞士先正达公司选育)和弱抗旱性品种KWS9454(德国KWS公司选育),品种抗旱性鉴定工作已经得以开展[15]。本试验于2016年4—10月在内蒙古农业大学甜菜生理研究所进行。采用室内盆栽试验,选取相同规格60 cm×40 cm×20 cm的培养箱,每箱装入 35 kg 试验田表土并伴入适量的缓释肥料。土壤田间持水量、永久萎蔫系数分别为21%、7.5%,土壤pH值为6.8。幼苗培育在人工气候室进行,气候室参数设置为温度25 ℃,光—暗周期 14 h—10 h。每箱留健壮幼苗30株,在幼苗生长至6张真叶时开始进行胁迫处理。对照每箱浇灌6.5 L水,使土壤含水量维持在饱和含水量的75%~80%,每天06:00通过称质量法对土壤含水量进行监测;胁迫处理停止浇水,胁迫持续5 d后复水至对照水平。分别于处理后第1、3、5天(分别记作T1、T2、T3)和复水后第1、2天(分别记作T4、T5)取对照和处理植株长势一致的完全展开的第3、4张叶进行相关生理指标的测定。
1.2 测定项目与方法
可溶性糖含量的测定采用蒽酮比色法[16];游离脯氨酸含量的测定采用茚三酮法[16];可溶性蛋白质含量的测定采用考马斯亮蓝G-250法[17];甜菜碱含量的测定采用化学比色法[18];K+含量的测定采用火焰光度计法[19];吲哚-3-乙酸(简称IAA)、脱落酸(简称ABA)含量的测定采用酶联吸附免疫分析法[18];叶水势的测定采用压力室法,利用ZLZ-A型植物水分测定仪在09:00测定[20];
1.3 数据处理
试验数据采用Excel 2007和SPSS 13.0进行分析与处理。其中图表制作采用Excel 2007,而不同处理间差异显著性分析及主成分分析采用SPSS 13.0,图中数据均为3次重复的平均值。
2 结果与分析
2.1 水分胁迫下甜菜幼苗叶片渗透调节能力的响应
2.1.1 甜菜幼苗叶片可溶性糖含量对水分胁迫的响应 水分胁迫下植物体内可通过增加细胞原生质浓度来起到抗脱水作用,可溶性糖就属于该类物质的一种。从图1可以看出,在正常供水条件下,不同抗旱性甜菜叶片可溶性糖含量变化基本趋于稳定,波动不大,不同抗旱性品种间差异不显著。在胁迫第1天时,与对照差异不显著;随着胁迫程度增加,不同抗旱性品种甜菜叶片可溶性糖含量均表现出升高趋势,但是抗旱品种HI0466增幅较明显,在胁迫第3、5天时,其可溶性糖含量分别较对照提高1.53、2.97倍,而弱抗旱品种KWS9545分别仅较对照提高了0.76、1.19倍,不同抗旱品种间差异显著。复水后2个品种叶片可溶性糖含量均呈下降恢复趋势,但在复水2 d内均未恢复到正常对照水平。
2.1.2 甜菜幼苗叶片可溶性蛋白含量对水分胁迫的响应 干旱胁迫下植物常会作出增加蛋白合成量或新合成某些蛋白的适应性调节反应,该类蛋白的产生与植物的干旱胁迫时间、强度及物种的类型、器官相关[21-25]。由图2可知,在正常供水条件下,不同抗旱性品种甜菜叶片可溶性蛋白含量变化平稳,不同品种间不存在显著差异。在水分胁迫处理下,不同抗旱性品种可溶性蛋白质含量变化均表现为先升高后降低的趋势。在胁迫前几天,水分胁迫诱导使2个供试品种可溶性蛋白质含量均明显升高,但抗旱性强的品种HI0466可溶性蛋白质含量增幅较大,在胁迫第3天时最大值时提高为弱抗旱品种KWS9554的1.15倍,品种间差异显著;当胁迫持续到第5天时,可能由于胁迫程度加剧,2个品种叶片可溶性蛋白质含量均开始下降,但是不同抗旱性品种下降幅度明显不同,抗旱品种HI0466可维持较低的降幅而保持相对较高的可溶性蛋白质含量,而弱抗旱品种KWS9554可溶性蛋白质含量迅速下降至较低水平;复水2 d后可溶性蛋白质含量均可逐步恢复到对照水平。
2.1.3 甜菜幼苗叶片游离脯氨酸含量对水分胁迫的响应 作为植物体内水溶性最大的氨基酸,脯氨酸一方面可降低细胞渗透势,起到渗透调节作用,另一方面在保护大分子物质稳定性方面有一定作用。大量研究表明,干旱会使植物体内游离脯氨酸大量累积。在本研究中,在正常供水条件下,不同抗旱性甜菜品种叶片脯氨酸含量维持在稳定的低水平状态;在水分胁迫处理下,供试甜菜叶片脯氨酸含量均呈现出逐渐增加的趋势,但增加幅度明显不同,强抗旱品种HI0466增幅显著,在胁迫第1、3、5天时分别提高到弱抗旱材料KWS9454的1.98、1.54、1.90倍,表现为水分胁迫下不同抗旱性品种间脯氨酸含量差异显著;在复水后,供试材料叶片脯氨酸含量开始逐渐降低(图3)。
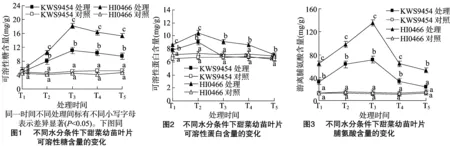
2.1.4 甜菜幼苗叶片甜菜碱含量对水分胁迫的响应 甜菜碱是植物体内另一类理想的亲和性渗透物质,在抗逆中具有渗透调节、稳定生物大分子的作用。由图4可知,在正常供水条件下,不同抗旱性品种甜菜叶片甜菜碱含量(干质量)在 0.5~1.0 μmol/g范围内波动,变化趋势比较稳定。在水分胁迫下,不同品种甜菜碱含量出现不同程度的积累。抗旱品种HI0466在胁迫程度较轻时其叶片甜菜碱含量未出现及时响应,以至在胁迫第1天时其叶片甜菜碱含量仍维持在对照水平,但弱抗旱材料KWS9454略有升高。随着胁迫的进行,在胁迫第3~5天内,2个供试材料的叶片甜菜碱含量均表现为快速大量累积并达到最大值,但累积幅度差异显著。抗旱材料HI0466的增幅明显高于KWS9454,在胁迫第3、5天时,抗旱材料HI0466叶片甜菜碱含量分别提高到KWS9454的1.64、1.41倍,不同抗旱性品种间差异显著。复水解除胁迫后,不同品种组织内的甜菜碱含量开始缓慢下降,但在复水2 d后仍保持相对较高的水平,未能在短时间内恢复到对照水平。
2.1.5 甜菜幼苗叶片K+含量对水分胁迫的响应 作为离子渗透调节物质,K+可通过调节液泡的渗透势来维持细胞膨压等生理过程。图5表明,在正常供水情况下,叶片K+含量变化较平缓,品种间无明显差异。在水分胁迫第1天时各组别K+含量无显著变化,基本维持在对照水平。进一步胁迫条件下,供试2个品种叶片K+含量均开始快速升高,在胁迫第5天时K+含量均达到最高值,但在整个胁迫过程中,不同品种间变化幅度接近,不同抗旱性品种间差异不显著。复水后,各处理K+含量均快速下降并恢复到对照水平。
2.1.6 甜菜幼苗叶片水势对水分胁迫的响应 植物细胞的水势对干旱等逆境胁迫较为敏感,且植物细胞的渗透调节作用是植物增强抗逆性、适应环境的基础[26]。从图6可以看出,不同抗旱性品种在正常水分条件下水势变化稳定,无明显差别;在水分胁迫条件下,2个甜菜品种水势均呈现下降趋势。在胁迫第1天时,不同抗旱性品种下降幅度相近,差异不显著;随着胁迫程度进一步加大,抗旱品种HI0466水势下降幅度增加,且2个品种间差异显著。这可能与抗旱品种HI0466细胞内大量渗透调节物质的快速大量累积有关,使其渗透势维持在较低的水平,在胁迫第5天时叶片水势达到最低值。抗旱品种HI0466维持较低渗透势可避免细胞内水分的大量流失,提高其保水能力,增强抗旱性。在复水2 d后,水势均可再次快速上升并接近对照水平。
2.2 水分胁迫下甜菜幼苗叶片内源激素的响应
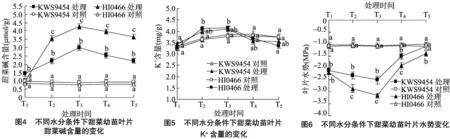
2.2.1 甜菜幼苗叶片IAA含量对水分胁迫的响应 IAA作为促进植物生长的关键内源激素,主要由植物顶端分生组织和正在生长的叶片来合成,并通过极性的方式运输到其他组织器官,其含量与生长的各组织之间保持一种互动的平衡反馈关系。由图7可以看出,本研究中在正常水分条件下,不同抗旱性甜菜品种叶片IAA含量均维持稳定,且HI0466略高于KWS9454。在水分胁迫下,抗旱材料HI0466叶片在胁迫第1天 时的IAA含量未发生明显变化,而弱抗旱材料KWS9454叶片IAA含量显著降低。随着胁迫的持续,不同品种叶片IAA含量均表现为逐渐降低,在胁迫第5天时均达到最低值,但不同抗旱性品种降低幅度明显不同,弱抗旱材料KWS9454降低幅度显著高于抗旱材料HI0466,在胁迫第3、5天分别较抗旱材料HI0466低20.91%、27.24%,不同抗旱性品种间叶片IAA含量差异显著。复水2 d后不同抗旱性品种甜菜叶片IAA含量均有较大幅度的升高,HI0466基本可恢复到对照水平,但KWS9454的恢复速度较慢。
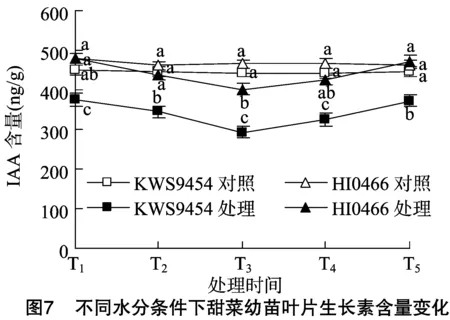
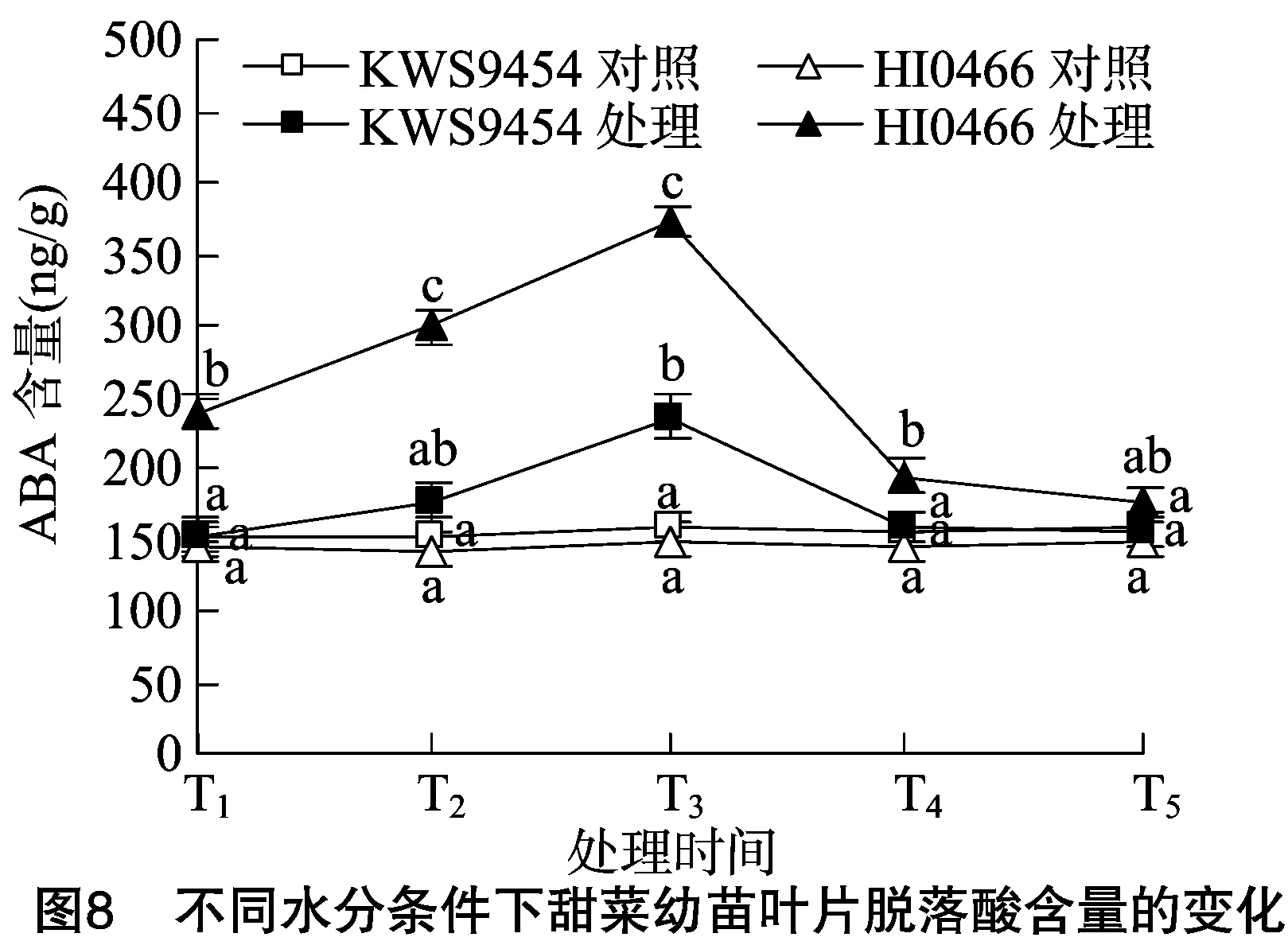
2.2.2 甜菜幼苗叶片ABA含量对水分胁迫的响应 脱落酸参与植物对多种逆境的响应,诸多研究表明,干旱会诱导植物体内源ABA的响应,引发植物的水分亏缺反应,通过调节气孔、调整保卫细胞离子通道、降低钙调素蛋白的转录水平等方面的影响,增加逆境存活机会[27-29]。由图8可以看出,在水分充足的条件下,不同抗旱性甜菜叶片内ABA含量稳定。在水分胁迫下,不同抗旱性甜菜叶片的ABA含量响应明显不同,其中抗旱品种HI0466的响应迅速,在胁迫第1天时,叶片的ABA含量就快速升高。在随后的胁迫过程中,供试品种叶片的ABA含量均出现不同程度的响应增加,在胁迫第5天时,叶片ABA含量均达到最高值,但同样表现出抗旱品种HI0466的响应显著,叶片ABA含量增加幅度较大,含量较高,在水分胁迫下,不同抗旱性品种间叶片ABA含量差异显著。复水 2 d 后叶片ABA含量均有较大幅度的下降,并与对照水平接近。
2.3 甜菜抗旱性鉴定指标的评价
由于不同指标对抗旱性贡献的权重各异,甜菜不同抗旱性品种在不同水分状况下各单项生理指标的响应不尽相同,且各指标间关系复杂,以单一指标对甜菜抗旱性进行评价结果片面,应对其进行综合分析评价。利用SPSS 13.0软件对8项生理指标进行主成分分析,由表1可以看出,主成分分析特征值中2个成分的累积贡献率达到76.153%,具有较强的代表性,提取的2个主成分基本上代表了8个原始指标的绝大部分信息。其中决定第一主成分大小的主要有脯氨酸含量、甜菜碱含量、细胞水势3个生理指标,系数分别为0.960、0.900、-0.908,这3个指标属于渗透调节系统;决定第二主成分大小的主要有ABA含量,系数为0.968,该指标属于内源激素调控系统。因此,通过主成分分析表明,在甜菜苗期,脯氨酸含量、甜菜碱含量、细胞水势、ABA含量均可作为甜菜抗旱性的鉴定指标。
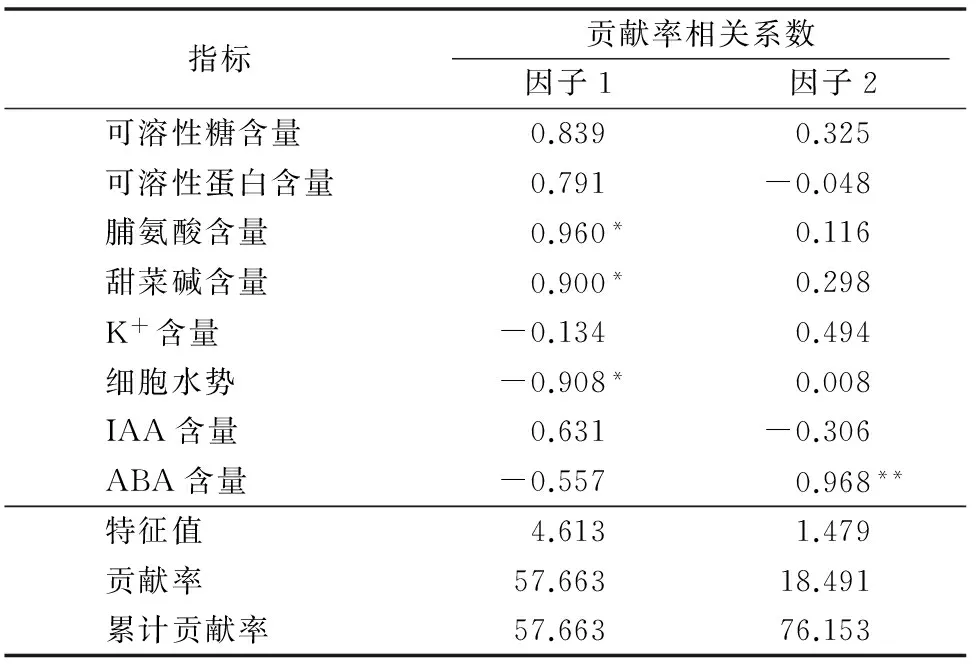
表1各生理指标主成分的特征向量贡献率
注:“*”表示各指标间差异显著(P<0.05);“**”表示各指标间差异极显著(P<0.01)。
3 讨论与结论
渗透调节是植物抵御干旱逆境的一种重要方式,也是植物在干旱胁迫下诱导保护性应答的一种重要生理机制[30-31],目前已有关于多种作物的大量研究报道,出现2种不同的观点,一种认为渗透调节参与作物的抗旱,渗透调节能力较高的作物具有较强的抗旱性。如对高粱、小麦、玉米的研究结果表明,抗旱性强的品种其渗透调节能力可在干旱胁迫下维持较高的水平[32-34]。另一种则认为渗透调节能力与作物品种抗旱性间不存在显著相关关系,如Jones在研究高粱时发现,水分胁迫下不同抗旱性高粱品种的渗透调节能力没有表现出明显差异[35]。本研究对抗旱性差异明显的2个典型甜菜品种在苗期不同程度水分胁迫下其渗透调节能力变化的分析表明,甜菜苗期的渗透调节能力与其品种抗旱性强弱间存在相关性,抗旱能力强的甜菜品种其渗透调节能力也相对较强,这与第一种研究的观点一致。同时本试验结果也表明,渗透调节能力在甜菜苗期的作用与胁迫程度有关,在不同胁迫程度下其渗透调节能力表现不同。在胁迫程度较轻时,不同抗旱性甜菜渗透调节能力维持相对平缓的状态,品种间差异不显著。随着胁迫程度的增加,在中度甚至重度胁迫时,抗旱品种的渗透调节才出现显著增强的趋势。这可能由于不同品种的抗旱机制存在差异,导致在响应不同干旱胁迫时其渗透调节能力存在一定的局限性。渗透能力的强弱主要依赖于渗透调节物质的变化。渗透调节物质主要包括可溶性糖、可溶性蛋白、脯氨酸、甜菜碱、K+、Na+等[36]。近年来国内外诸多学者对小麦、高粱、水稻、鹰嘴豆等许多作物的研究表明,干旱胁迫下细胞内会通过不断累积如脯氨酸、可溶性糖、K+等渗透调节物质的响应,降低细胞渗透势,提高保水能力,维持细胞膨压,从而增强作物对干旱的耐受性,但不同作物在渗透调节物质积累方面存在一定差异[37-40]。从本研究的结果来看,在干旱胁迫下,抗旱能力强的甜菜苗期渗透调节物质的响应主要体现在脯氨酸、甜菜碱和可溶性糖的积累,进而使甜菜细胞渗透势维持在较低水平,有效地提高了保水能力,减少了水分的散失,提高了甜菜对水分胁迫的耐受性。其可能原因在于不同抗旱性甜菜存在不同的等位基因,在水分胁迫下控制上述渗透调节物质的基因存在表达差异,造成其代谢过程和强度不同。
已有研究证实,植物激素对应答水分胁迫起重要的调控作用,对外界胁迫因子的反应极其敏感,在水分胁迫下呈现不同的响应机制[41-42]。在对小麦、大麦、水稻、玉米、豌豆等的研究中发现,干旱胁迫下ABA、IAA含量均出现不同程度的响应,但规律不尽一致[43-47]。本研究结果表明,干旱胁迫下抗旱甜菜品种叶片ABA含量随胁迫程度的增加而增加,IAA含量则相反,且水分胁迫程度较大时抗旱品种增幅显著,并在复水后可产生补偿效应。ABA作为“胁迫激素”,在干旱刺激下在抗旱品种内大量合成并在地上部分累积,可能对促进抗旱品种气孔关闭、减少水分散失起到重要作用。当然,植物激素在生长过程中的调控作用除了表现在其绝对含量外,激素间的相对平衡也非常重要。抗旱性强的品种在水分胁迫下各激素间消长协调平衡能力较好,也可能是它们在胁迫中受抑制较小的另一原因。而有关胁迫条件下各激素间协调平衡的复杂关系及其相关机制,还应进一步研究。
作物的抗旱性是由多个因素交互形成的一种综合性状,不同抗旱生理指标对作物干旱胁迫的响应敏感程度不同[48-49],因此采用某种单一指标对抗旱性进行评价时结果将会片面单一,应通过综合评价方法对抗旱相关生理指标进行系统评价才更具有实际意义。目前报道的抗旱性综合评价方法主要有主成分分析法、隶属函数法、灰色关联分析法、聚类分析法等[50-52]。本研究通过主成分分析法对8个甜菜品种的抗旱指标进行了综合评价,其中在隶属的2个主成分中,脯氨酸含量、甜菜碱含量、细胞水势、ABA含量对干旱胁迫最为敏感,对抗旱性的贡献率也最大,可作为甜菜苗期抗旱性评价的有效参考指标。
参考文献:
[1]黄玉兰,殷奎德,向君亮,等. 干旱胁迫下植物生理生化及DNA甲基化的研究进展[J]. 玉米科学,2016(2):96-102.
[2]Schindler U,Steidl J,Müller L,et al. Drought risk to agricultural land in Northeast and central Germany[J]. Journal of Plant Nutrition & Soil Science,2007,170(3):357-362.
[3]山 仑. 植物抗旱生理研究与发展半旱地农业[J]. 干旱地区农业研究,2007,25(1):1-5.
[4]Nogués I,Llusià J,Ogaya R,et al. Physiological and antioxidant responses ofQuercusilexto drought in two different seasons[J]. Plant Biosystems,2014,148(2):268-278.
[5]邵惠芳,陈 征,许嘉阳,等. 两种烟草幼苗叶片对不同强度干旱胁迫的生理响应比较[J]. 植物生理学报,2016(12):1861-1871.
[6]Ma X,Xin Z,Wang Z,et al. Identification and comparative analysis of differentially expressed miRNAs in leaves of two wheat (TriticumaestivumL.) genotypes during dehydration stress[J]. BMC Plant Biology,2015,15(1):1-15.
[7]Chaves M M,Maroco J P,Pereira J S. Understanding plant responses to drought-from genes to the whole plant[J]. Functional Plant Biology,2003,30(3):239-264.
[8]靳军英,张卫华,袁 玲. 三种牧草对干旱胁迫的生理响应及抗旱性评价[J]. 草业学报,2015,24(10):157-165.
[9]任 磊,赵夏陆,许 靖,等. 4种茶菊对干旱胁迫的形态和生理响应[J]. 生态学报,2015,35(15):5131-5139.
[10]郭启芳,吴耀领,王 玮. 干旱、高温及共胁迫下不同小麦品种的生理生化响应差异[J]. 山东农业科学,2014(11):32-38.
[11]张旭东,王智威,韩清芳,等. 玉米早期根系构型及其生理特性对土壤水分的响应[J]. 生态学报,2016,36(10):2969-2977.
[12]马一泓,王 术,于佳禾,等. 水稻生长对干旱胁迫的响应及抗旱性研究进展[J]. 种子,2016,35(7):45-49.
[13]张木清,陈如凯. 作物抗旱分子生理与遗传改良[M]. 北京:科学出版社,2005:22-23.
[14]李丽芳,罗晓芳,王华芳. 植物抗旱基因工程研究进展[J]. 西北林学院学报,2004,19(3):53-57.
[15]李国龙,吴海霞,温 丽,等. 甜菜苗期抗旱鉴定指标筛选及其综合评价[J]. 干旱地区农业研究,2011,29(4):69-74.
[16]高俊凤. 植物生理实验指导[M]. 北京:高等教育出版社,2006:144-148,228-230.
[17]张宪政,陈凤玉,王荣富. 植物生理学实验技术[M]. 沈阳:辽宁农业科学出版社,1994:277-280.
[19]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000:270-271.
[20]史树德,孙亚卿,魏 磊. 植物生理学实验指导[M]. 北京:中国林业出版社,2011:4-8.
[21]徐民俊,刘桂茹,杨学举,等. 冬小麦品种干旱诱导蛋白的研究[J]. 河北农业大学学报,2002,25(4):11-15.
[22]赵天宏,沈秀瑛,杨德光,等. 水分胁迫对玉米小花分化期叶片蛋白质的影响初探[J]. 园艺与种苗,1999,19(5):22-25.
[23]康俊梅,杨青川,樊奋成. 干旱对苜蓿叶片可溶性蛋白的影响[J]. 草地学报,2005,13(3):199-202.
[24]魏 琴,赖家业,周锦霞,等. 干旱胁迫下麻疯树毒蛋白的Western杂交分析[J]. 北京林业学学报,2004,26(5):26-30.
[25]刘娥娥,汪沛洪,郭振飞. 植物的干旱诱导蛋白[J]. 植物生理学通讯,2001,37(2):155-160.
[26]彭立新,李德全,束怀瑞. 植物在渗透胁迫下的渗透调节作用[J]. 天津农业科学,2002,8(1):40-43.
[27]Folkard A,Mathias N A. Ovary abscisic acid concentration does not induce kernel abortion in field-grown maize subjected to drought[J]. European Journal of Agronomy,2001,15(2):119-129.
国家民政局官网首页主要职责第二条为:承担依法对社会团体、基金会、民办非企业单位进行登记管理和监察责任。据《关于城镇民办非营利性医疗机构进行民办非企业单位登记有关问题的通知》,民办非营利性医疗机构由民政部门承担登记管理和监察责任。进行年检管理,年检方式为送审。中华人民共和国民政部令第27号《民办非企业单位年度检查办法》第五条:民办非企业单位接受年检时应当提交的材料包括财务会计报告;第六条:年检的主要内容包括财务状况、资金来源和保用情况;但未将提供注册会计师审计报告作为必须报送的年检材料之一。其相关内设机构及职能中未明确具体承担相应监管职责的处室,仅见承担部内及所属预算管理单位的财务监管。
[28]Li C,Yin C Y,Liu S R. Different responses of two contrastingPopulusdavidianapopulations to exogenous abscisic acid application[J]. Environmental and Experimental Botany,2004,51(3):237-246.
[29]Yin C,Duan B,Wang X,et al. Morphological and physiological responses of two contrasting poplar species to drought stress and exogenous abscisic acidapplication[J]. Plant Science,2004,167(5):1091-1097.
[30]王 娟,李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J]. 植物学报,2001,18(4):459-465.
[31]Cabuslay G S,Ito O,Alejar A A. Physiological evaluation of responses of rice (OryzasativaL.) to water deficit[J]. Plant Science,2002,163(4):815-827.
[32]Flower D J,Rani A U,Peacock J M. Influence of osmotic adjustment on the growth,stomatal conductance and light interception of contrasting sorghum lines in a harsh environment[J]. Functional Plant Biology,1990,17(1):91-105.
[33]刘桂茹,陈秀珍,段文倩. 水分胁迫下小麦叶片渗透调节能力与品种抗旱性的关系[J]. 河北农业大学学报,2002,25(2):1-3.
[34]裴二芹,石云素,刘丕庆,等. 干旱胁迫对不同玉米自交系苗期渗透调节的影响[J]. 植物遗传资源学报,2010,11(1):40-45.
[35]Jones M M. Osmotic adjustment in leaves of sorghum in response to water deficits[J]. Plant Physiology,1978,61(1):122-126.
[36]Chaves M M,Oliveira M M. Mechanisms underlying plant resilience to water deficits:prospects for water-saving agriculture[J]. Journal of Experimental Botany,2004,55(407):2365-2384.
[37]武玉叶,李德全. 土壤水分胁迫下小麦叶片渗透调节与光合作用[J]. 作物学报,1999,25(6):752-758.
[38]邵艳军,山 仑,李广敏. 干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J]. 中国生态农业学报,2006,14(1):68-70.
[39]朱维琴,吴良欢,陶勤南. 干旱逆境对不同品种水稻生长、渗透调节物质含量及保护酶活性的影响[J]. 科技通报,2006,22(2):176-181.
[40]Basu P S,Berger J D,Turner N C,et al. Osmotic adjustment of chickpea (CicerarietinumL.) is not associated with changes in carbohydrate composition or leaf gas exchange under drought[J]. Annals of Applied Biology,2010,150(2):217-225.
[41]Sharp R E,Poroyko V,Hejlek L G,et al. Root growth maintenance during water deficits:physiology to functional genomics[J]. Journal of Experimental Botany,2004,55(407):2343-2351.
[42]Davies P J. The plant hormones:Their nature,occurrence and function[M]. Berlin, Germany:Springer Netherlands,1995:1-11.
[43]闫 洁,曹连莆,张 薇,等. 土壤水分胁迫对大麦籽粒内源激素及灌浆特性的影响[J]. 石河子大学学报(自然科学版),2005,23(1):30-38.
[44]胡秀丽,杨海荣,李潮海. ABA对玉米响应干旱胁迫的调控机制[J]. 西北植物学报,2009,29(11):2345-2351.
[45]王 玮,李德全,杨兴洪,等. 水分胁迫对不同抗旱性小麦品种芽根生长过程中IAA、ABA含量的影响[J]. 作物学报,2000,26(6):737-742.
[46]杨建昌,刘 凯,张慎凤,等. 水稻减数分裂期颖花中激素对水分胁迫的响应[J]. 作物学报,2008,34(1):111-118.
[47]牛俊义,闫志利,林瑞敏,等. 干旱胁迫及复水对豌豆叶片内源激素含量的影响[J]. 干旱地区农业研究,2009,27(6):154-159.
[48]蒙秋伊,罗 凯,刘鹏飞,等. 甘蔗离体抗旱突变体的筛选及生理特性[J]. 江苏农业科学,2017,45(4):99-102.
[49]宋丹华,黄俊华,王 丰,等. 铃铛刺苗期对持续干旱胁迫的生理响应[J]. 江苏农业科学,2016,45(5):292-295.
[50]张智猛,万书波,戴良香,等. 花生抗旱性鉴定指标的筛选与评价[J]. 植物生态学报,2011,35(1):100-109.
[51]郭数进,李玮瑜,马艳芸,等. 山西不同生态型大豆品种苗期耐低温性综合评价[J]. 植物生态学报,2014,38(9):990-1000.
[52]田山君,杨世民,孔凡磊,等. 西南地区玉米苗期抗旱品种筛选[J]. 草业学报,2014,23(1):50-57.

