多粘菌素E降解酶产生菌的筛选及其产酶条件的研究
,,
(浙江工业大学 生物工程学院,浙江 杭州 310014)
多粘菌素E (colistin) 是一类由多粘类芽孢杆菌 (Bacilluspolymyxinvar.colistinus) 产生的对革兰氏阴性菌具有较强杀菌作用的多肽类抗生素[1].此类抗生素能有效预防动物疾病并明显促进动物生长,因而作为兽药和饲料添加剂在畜牧养殖业中被广泛应用[2],但是由于其代谢率低不能被动物机体完全吸收,大部分被排出体外[3].有文献表明:在土壤、水体以及动植物性食品中都检测到多肽类抗生素残留,对人类健康构成很大的危害[4-5].
抗生素的降解方式主要有水解、光解、氧化分解和生物降解.肖明威等[6]用光催化氧化法处理头孢类抗生素废水120 min,化学耗氧量 (Chemical oxygen demand,COD) 去除率达70.1%.生物降解主要是通过微生物作用使抗生素分解为CO2和H2O等无毒无害小分子的物质.赵永斌等[7]从长期受四环素类抗生素污染的土壤中分离到一株木糖氧化无色杆菌 (Achromobacterxylosoxidans),它对土霉素、四环素和金霉素的降解率分别为65.78%,69.33%和71.34%.相比较于传统的物理、化学方法,生物降解抗生素具有无毒害、无残留、无二次污染和作用时间短等优点[8],已显示出良好的应用前景.然而关于生物降解多粘菌素E的研究却鲜有报道,文献分析显示近半个世纪以来国内外对多粘菌素的研究工作主要集中在药物代谢、药效分析和耐药检测等方面[9].笔者通过筛选得到一株能高效降解多粘菌素E的菌株,对其进行分类鉴定,并研究其降解酶产生条件,为微生物治理多粘菌素残留提供科学依据,也为微生物修复环境污染提供更多的选择.
1 材料与方法
1.1 材 料
1.1.1 菌 株
蛋白酶产生菌和大肠杆菌 (Escherichiacoli) DH5α均来自浙江工业大学微生物研究所前期保藏,菌株DC-01由本文鉴定.
1.1.2 培养基
降解菌培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L,pH 7.0,250 mL烧瓶装液量50 mL,121 ℃灭菌30 min.
降解酶筛选培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L,pH 7.0,250 mL烧瓶装液量50 mL,121 ℃灭菌30 min,多粘菌素E 5 000 U/mL过滤除菌.
降解酶发酵培养基:葡萄糖60 g/L,大豆蛋白胨40 g/L,Na2HPO4·12H2O 3 g/L,KH2PO40.3 g/L,pH 7.0,250 mL烧瓶装液量50 mL,121 ℃灭菌30 min.
碳源选择培养基:不同碳源 (碳摩尔数相同:葡萄糖60 g/L,蔗糖52 g/L,可溶性淀粉49 g/L),大豆蛋白胨40 g/L,Na2HPO4·12H2O 3 g/L,KH2PO40.3 g/L,pH 7.0,250 mL烧瓶装液量50 mL,121 ℃灭菌30 min.
氮源选择培养基:葡萄糖60 g/L,不同氮源 (总氮量相同:大豆蛋白胨40 g/L,酵母粉30 g/L,硫酸铵34 g/L),Na2HPO4·12H2O 3 g/L,KH2PO40.3 g/L,pH 7.0,250 mL烧瓶装液量50 mL,121 ℃灭菌30 min.
1.1.3 主要仪器和设备
电子分析天平 (德国Sartorius TE612-L),高压整齐灭菌器 (日本Panasonic MLS-3781L),恒温振荡培养器 (上海智诚 ZHWY-2102),生化培养箱 (上海博讯 SPX-250B-Z),核酸电泳装置 (北京六一 DYY-8C).
1.2 方 法
1.2.1 多粘菌素E降解菌的富集与筛选
将蛋白酶产生菌在降解菌培养基固体平板上活化后,挑取新鲜菌落接入含有5 000 U/mL多粘菌素E的液体降解菌培养基中,37 ℃,200 r/min下培养48 h后,转入培养基中多粘菌素E效价浓度更高的摇瓶中进行驯化,每次浓度提高2 000 U/mL.测定多粘菌素E的降解率来表征降解菌的产酶能力,通过蛋白酶产生菌对多粘菌素E降解效果的比较,筛选出降解能力强的降解酶产生菌株.
1.2.2 多粘菌素E降解菌的鉴定
菌株形态鉴定:采用降解菌培养基固体平板37 ℃培养降解菌24 h,对单菌落特征进行观察描述,按照《常见细菌系统鉴定手册》[10]进行革兰氏染色和芽孢染色.
16S rRNA序列分析:采用DNA基因组快速提取试剂盒进行总DNA提取,克隆引物采用细菌通用引物27F:5′-AGAGTTTGATCATGGCTCAG-3′和1492R:5′-TACGGTTACCTTGTTACGACTT-3′.PCR反应体系:高保真2×phanta Max Master Mix 25 μL,引物27F和1492R各2 μL,基因组模板2 μL,加无菌水至50 μL.PCR反应条件:95 ℃预变性3 min,95 ℃变性15 s,52 ℃退火15 s,72 ℃延伸60 s,72 ℃彻底延伸5 min,30 个循环.PCR产物用1%琼脂糖凝胶电泳检测.
1.2.3 菌体生物量测定
生长曲线测定:经降解菌液体培养基活化后的菌悬液按体积比5%接种于降解酶发酵培养基中,在37 ℃,200 r/min条件下培养,以未接种培养基为对照,采用分光光度法检测不同时间培养液的OD600,以测定菌体生长量.
菌体湿重测定:取1 mL发酵液于已知质量M1的离心管中,8 000 r/min离心10 min,弃去上清液,吸水纸除去余水后称量总质量M2.总质量M2减去离心管质量M1即可获得菌体湿重,计算公式为
菌体湿重M=M2-M1
1.2.4 培养条件对产酶的影响
采用单因素实验,将降解菌经降解菌培养基活化后接种于降解酶筛选培养基中,分别在不同的温度、pH、接种量、装液量和碳氮源等条件下培养24 h.培养结束后发酵液4 ℃,8 000 r/min离心10 min,取上清液1 mL加入终浓度为10 000 U/mL的多粘菌素E,于37 ℃下反应1 h后测定多粘菌素E残留量,每个处理设3 次重复.
1.2.5 多粘菌素E降解率测定
参考高岚等的抑菌圈法 (又称一剂量法) 对多粘菌素E的残留量进行测定[11]:以E.coliDH5α为指示菌均匀涂布在固体降解菌培养基上,在固体平板上放置的牛津杯中加入200 μL的待测液后,4 ℃条件下冷扩展12 h,再转移到37 ℃条件下培养24 h.用高精度游标卡尺测量抑菌圈直径,经校正后代入标准曲线回归方程计算多粘菌素E残留浓度.
多粘菌素E残留浓度mc计算公式为
mc=10(0.145 19d+1.140 08)R2=0.998 6
式中:mc为多粘菌素E残留浓度;d为抑菌圈直径校正值.
多粘菌素E降解率a计算公式为
a=(m0-mc)/m0×100%
式中m0为多粘菌素E初始浓度.
单位菌体降解量b计算公式为
b=(m0-mc)/M
式中M为菌体湿重.
2 结果与讨论
2.1 降解酶产生菌的筛选与鉴定
多粘菌素E属多肽类物质,推测其降解酶可能是一种蛋白酶.以浙江工业大学微生物研究所保藏的蛋白酶产生菌为材料,通过测定不同菌株对多粘菌素E的降解率来表征产酶能力,比较酶活大小,筛选得到对多粘菌素E具有明显降解效果的菌株DC-01.菌株DC-01在降解菌培养基平板上菌落呈扁平圆形、颜色灰白、边缘不整齐、表面粗糙褶皱的特征.经细胞染色及显微镜观察,DC-01为革兰氏阳性菌并且有芽孢产生 (图1).
利用细菌基因组和16S rRNA通用引物克隆了DC-01菌株的16S rRNA部分序列,经测序片段长度约1 427 bp.通过BLAST程序与GenBank (nr) 中的核酸数据库进行比对分析,在MEGA 5.0软件中对同源性较近的细菌绘制系统进化树,结果见图2.菌株DC-01与大多数芽孢杆菌属同源,其中与地衣芽孢杆菌 (B.licheniformis) WX-02置信度达到99%.因此,在分子系统发育分类学上笔者团队筛选到的多粘菌素E降解酶产生菌株属于地衣芽孢杆菌,命名为地衣芽孢杆菌DC-01 (B.licheniformisDC-01).
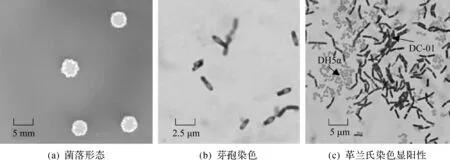
图1 降解菌DC-01菌落及菌体形态Fig.1 The colony and cellmorphology of degrading strain DC-01
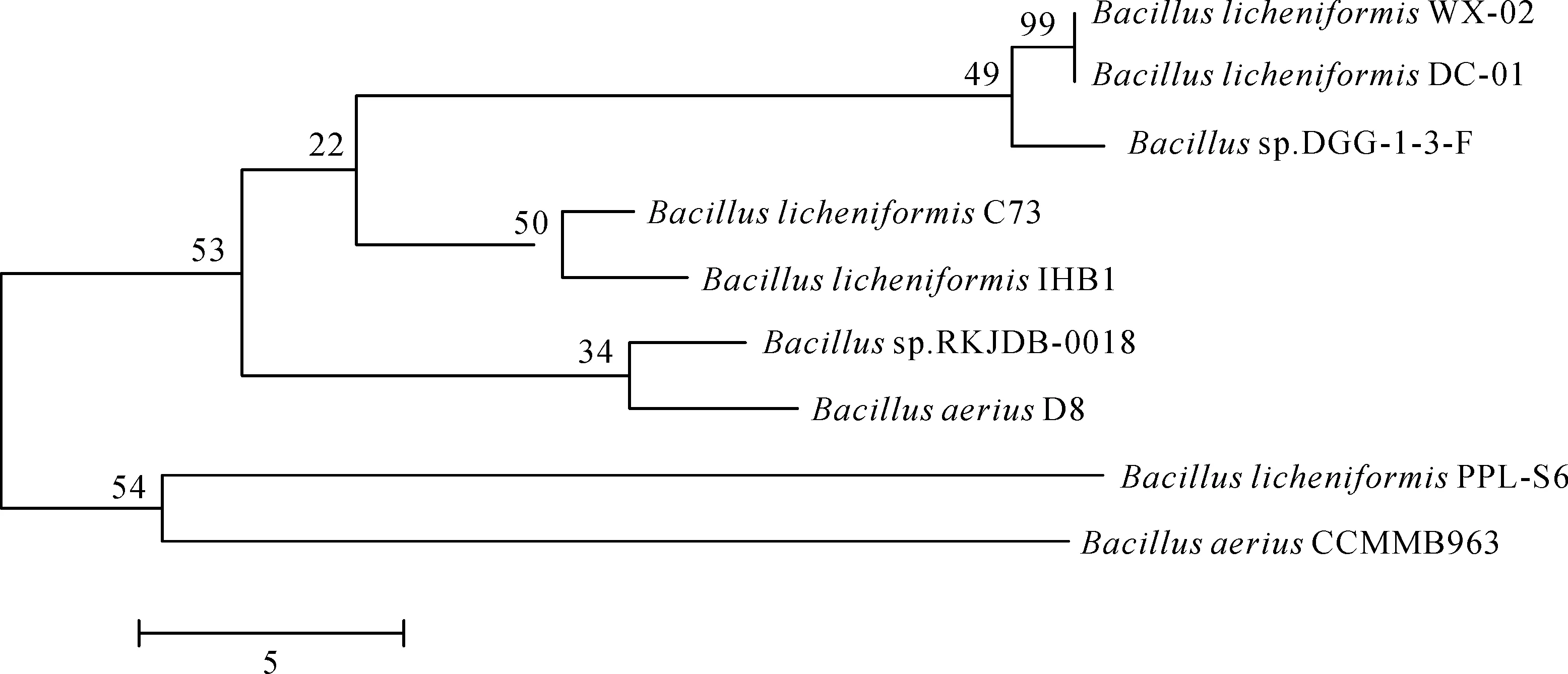
图2 降解菌B. licheniformis DC-01系统进化树Fig.2 The System evolution tree of B. licheniformis DC-01
2.2 培养条件对降解菌DC-01生长及其降解酶降解效果的影响
2.2.1 培养温度对降解菌DC-01生长及降解效果的影响
温度是影响有机体生长繁殖最重要的因素之一,任何的生化酶促反应都与温度相关.将降解菌B.licheniformisDC-01经活化后按5%接种量转接至降解酶发酵培养基中,在培养温度分别为23,30,37,44,51 ℃条件下200 r/min摇床振荡培养24 h.测定发酵液中的生物量及粗酶液对多粘菌素E的降解率,结果如图3所示.培养温度对B.licheniformisDC-01的生长和降解能力有显著影响.温度为23~44 ℃时,菌体湿重和多粘菌素E的降解率随着温度的升高而增加,在44 ℃时降解率达到最大值83.4%,但当温度继续上升到51 ℃时,菌体量和多粘菌素E降解率讯速下降.由于单位菌体降解量基本相同,说明单位菌体内的降解酶量是相近的.适宜的温度只是促进了菌体的生长,增加了菌体密度,从而提高了多粘菌素E的降解效率.降解菌最适的生长温度是44 ℃,但是从实际应用和经济效益出发,选用37 ℃作为适宜的培养温度.
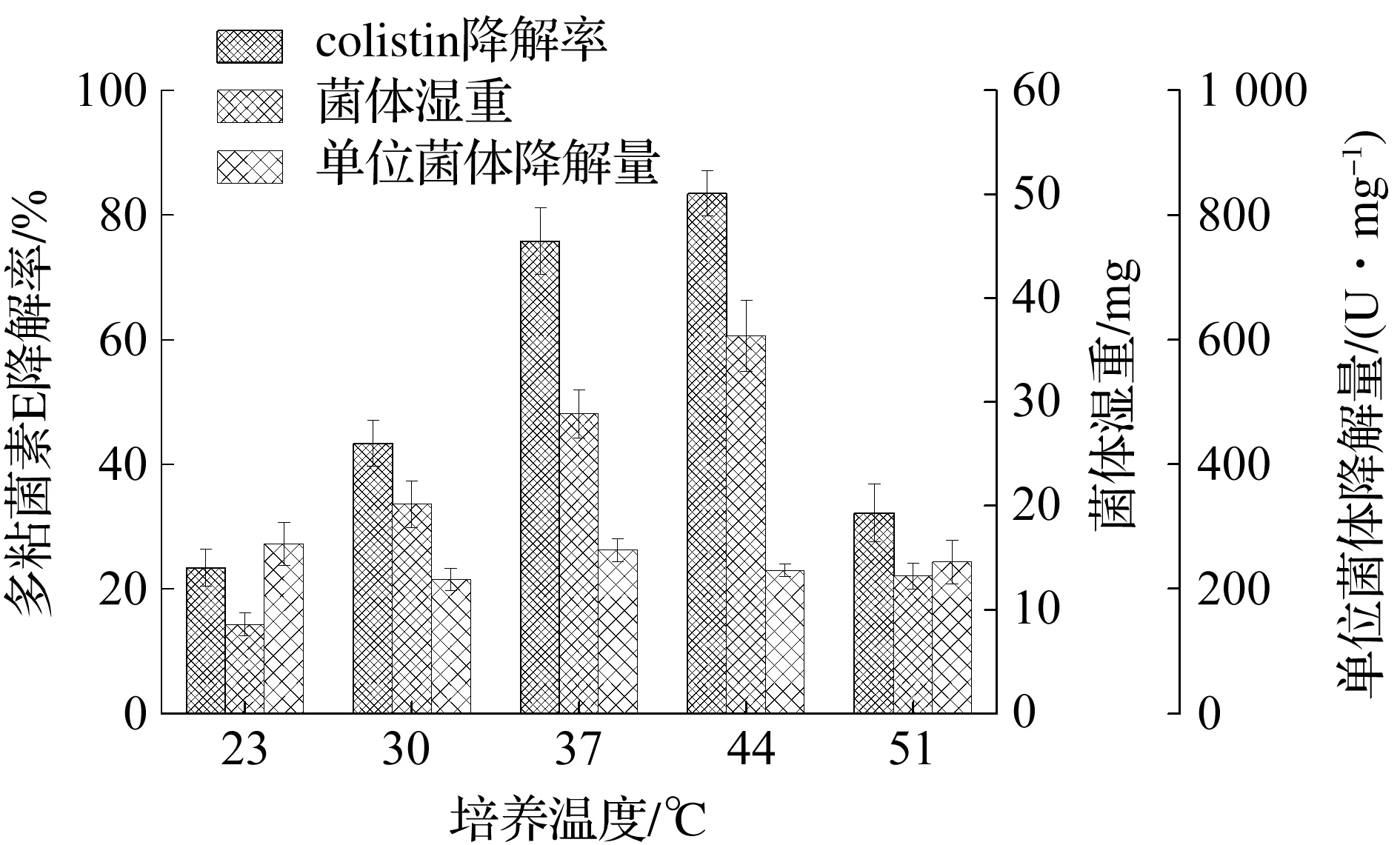
图3 培养温度对B. licheniformis DC-01的生长及其降解colistin能力的影响Fig.3 The effect of temperature to the growth of B. licheniformis DC-01 and colistin biodegradation
2.2.2 初始pH值对降解菌DC-01生长及降解效果的影响
pH值对微生物生长同样具有显著的影响,影响各种酶的活性.将降解菌B.licheniformisDC-01经活化后按5%接种量转接到初始pH值分别为5.0,6.0,7.0,8.0和9.0的降解酶发酵培养基中,37 ℃,200 r/min摇床振荡培养24 h.测定发酵液中的生物量及粗酶液对多粘菌素E的降解率,结果见图4.pH中性环境有利于地衣芽孢杆菌菌体的生长和降解酶的合成,而pH小于5的酸性环境不利于菌体生长,不同初始pH值对产物的合成也具有重要影响[12-13].由图4可知:培养基初始pH值对降解菌B.licheniformisDC-01的生长和对多粘菌素E的降解都有影响.在初始pH值为7.0~8.0时降解效果最好,降解率达到79.5%,此时菌株生长也最旺盛.可见降解菌B.licheniformisDC-01在中性环境下对多粘菌素的降解效果最好,所以适宜产降解酶的初始发酵pH值为7.0~8.0.
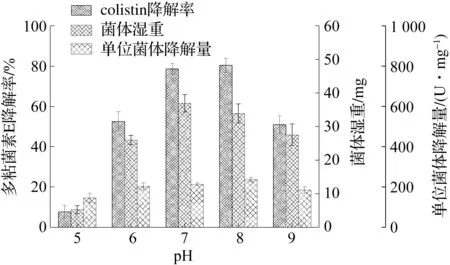
图4 初始pH对B. licheniformis DC-01的生长及降解colistin能力的影响Fig.4 The effect of pH value to the growth of B. licheniformis DC-01 and colistin biodegradation
2.2.3 接种量对降解菌DC-01生长及降解效果的影响
将降解菌B.licheniformisDC-01经活化后分别按4%,6%,8%,10%和12%接种量转接于pH为7.5的降解酶发酵培养基中,37 ℃,200 r/min摇床振荡培养24 h.测定发酵液中的生物量及粗酶液对多粘菌素E的降解率,结果如图5所示.当接种量较低时,降解菌B.licheniformisDC-01的生物量和对多粘菌素E的降解率随接种量的增加而升高,当接菌量为8%时,其降解率达到最大值86.9%.当接种量超过8%后,降解菌生物量保持稳定但是降解效果有所下降.接种量增加,降解菌受培养基中营养的限制,各实验组生物量基本相同.增大接种量能够缩短菌株生长的延滞期,但是接种量太大容易导致前期菌体生长过快,营养供应不足,菌体提前进入老化状态[14-15].接种量过高或过低都会影响降解效果,因此选择8%的接种量最适宜.
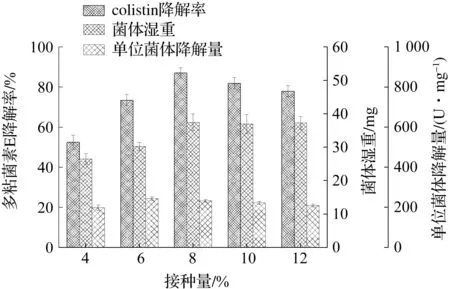
图5 接种量对B. licheniformis DC-01的生长及降解colistin能力的影响Fig.5 The effect of bacterium quantity tothe growth of B. licheniformis DC-01 and colistin biodegradation
2.2.4 摇瓶装液量对降解菌DC-01生长及降解效果的影响
摇瓶装液量的高低影响溶氧量,溶氧对于菌体的生长和降解效果都有重大的影响.将降解菌B.licheniformisDC-01经活化后按8%接种量转接于pH 7.5,装液量分别为30,50,70,90 mL的降解酶发酵培养基中,37 ℃,200 r/min摇床振荡培养24 h.测定发酵液中的生物量及粗酶液对多粘菌素E的降解率.由图6可知:当装液量为50 mL时,降解菌B.licheniformisDC-01对多粘菌素E的降解率达到最大值83.7%,但是装液量30 mL时生长最好.装液量低时溶氧量较高,此时菌株生长最旺盛,随着装液量增加溶氧降低,降解菌B.licheniformisDC-01的生物量呈现下降的趋势,表明降解菌B.licheniformisDC-01属于好氧菌.溶氧对微生物的影响分为两方面:影响与生长有关的能量代谢和直接参与产物的合成.高浓度的溶氧能够显著促进好氧菌B.licheniformisDC-01的生长,但是并不利于降解酶的合成分泌,因为微生物生长最适溶氧与降解酶合成最适溶氧并不相同[16-17],因此在摇床发酵条件下选择50 mL的装液量最适宜.
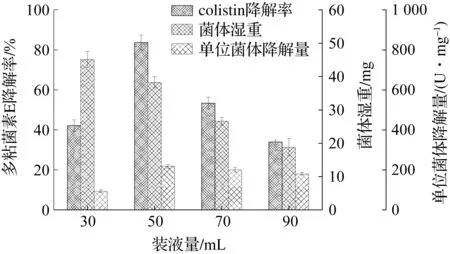
图6 装液量对B. licheniformis DC-01的生长及降解colistin能力的影响Fig.6 The effect of liquid volume to the growth of B. licheniformis DC-01 and colistin biodegradation
2.2.5 碳氮源对降解菌DC-01生长及降解效果的影响
不同的营养成分能够影响生物体的生长和代谢途径的改变.将降解菌B.licheniformisDC-01经活化后按8%接种量转接于pH为7.5、装液量为50 mL的不同碳氮源选择培养基中,37 ℃,200 r/min摇床振荡培养24 h.测定发酵液中的生物量及粗酶液对多粘菌素E的降解率.由图7可知:有机氮源比无机氮源更有利于降解菌B.licheniformisDC-01的生长和降解酶的合成与分泌.有机氮源大豆蛋白胨和酵母粉含有丰富的蛋白质、肽类,既能快速促进菌体的生长,又能诱导多粘菌素E降解酶的合成.在碳源的选择中,单糖葡萄糖、二糖蔗糖均优于多糖淀粉,其中选用蔗糖时的降解率和生物量最大,分别为92.1%和39.7 mg.孙倩等[18]利用高地芽孢杆菌 (Bacillusaltitudinis) 发酵生产碱性蛋白酶时也发现蔗糖是菌体生长和产酶的最佳碳源.因此,降解菌B.licheniformisDC-01产降解酶的培养基中最适宜的碳氮源组合是蔗糖和大豆蛋白胨.
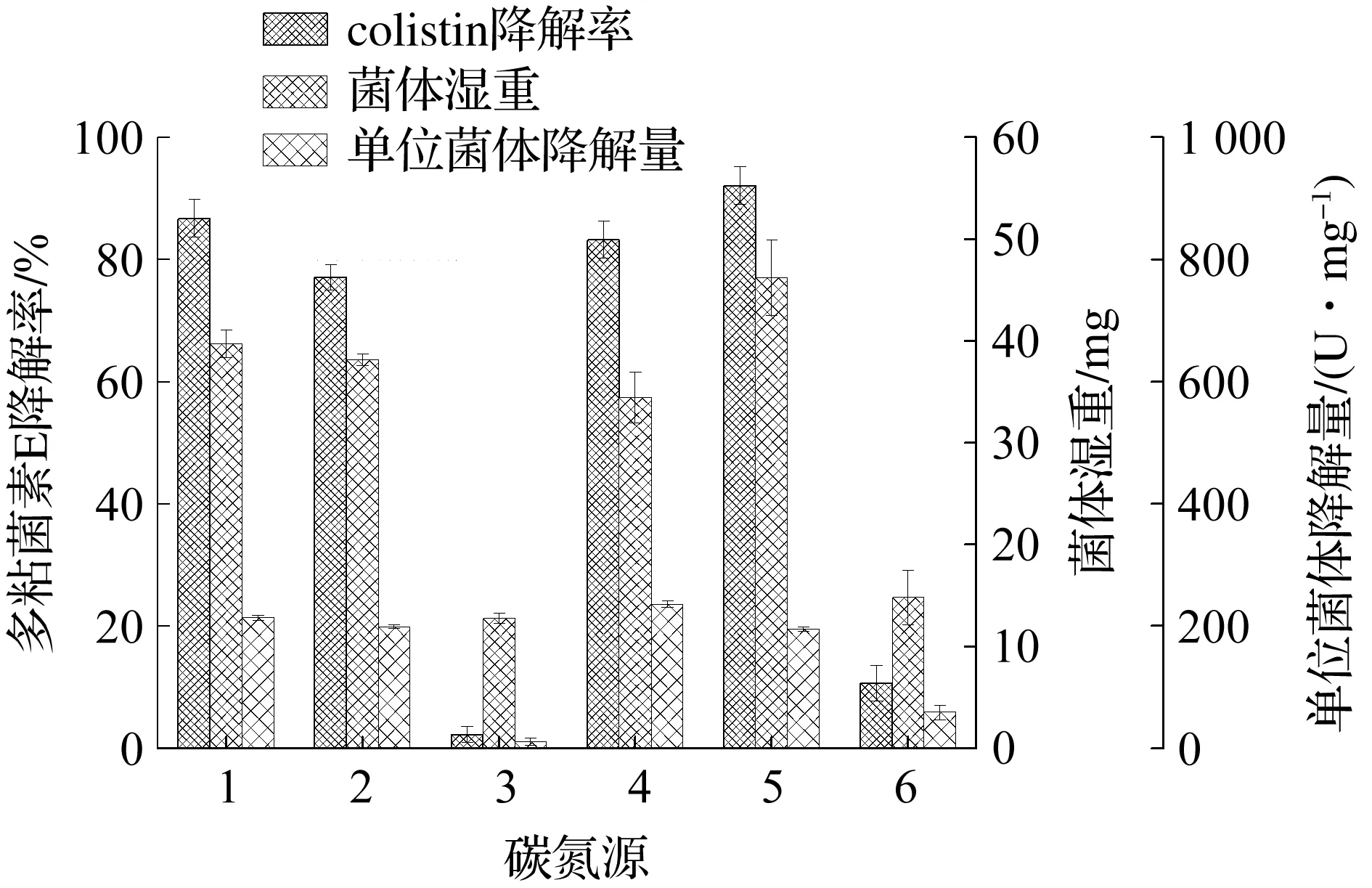
1-大豆蛋白陈;2-酵母粉;3-硫酸铵;4-葡萄糖;5-蔗糖;6-淀粉图7 碳氮源对B. licheniformis DC-01的生长及降解colistin能力的影响Fig.7 The effect of carbon and nitrogen sources to the growth of B. licheniformis DC-01 and colistin biodegradation
3 结 论
笔者筛选得到一株高效降解多粘菌素E的菌株DC-01,经形态观察和16S rDNA鉴定为地衣芽孢杆菌 (B.licheniformis) 并命名B.licheniformisDC-01.降解菌DC-01合成降解酶的最适摇瓶发酵条件为:温度37 ~44 ℃、初始pH值7.0~8.0、接种量8%、250 mL烧瓶装液量50 mL、发酵培养基中碳氮源组合为5.2%蔗糖和4.0%大豆蛋白胨.在最适发酵培养基中,37 ℃,200 r/min摇床振荡培养24 h,降解菌DC-01产生的粗酶液对10 000 U/mL多粘菌素E作用1 h的降解率达92.1%.
参考文献:
[1] KOMURA S, KURAHASHI K. Partial purification and properties of L-2,4-diaminobutyric acid activating enzyme from a polymyxin E producing organism[J].Journal of biochemistry, 1979, 86(4):1013-1021.
[2] 周艳,方静,李英伦.粘杆菌素研究及其应用[J].中国饲料,2006(16):15-17.
[3] WOO J, AHN J. Assessment of synergistic combination potential of probiotic and bacteriophage against antibiotic-resistantStaphylococcusaureusexposed to simulated intestinal conditions[J].Archives of microbiology, 2014, 196(10):719-727.
[4] AHMED M B, RAJAPAKSHA A U, LIM J E, et al. Distribution and accumulative pattern of tetracyclines and sulfonamides in edible vegetables of cucumber, tomato, and lettuce[J].Journal of agricultural and food chemistry, 2015, 63(2):398-405.
[5] MATONGO S, BIRUNGI G, MOODLEY B, et al. Pharmaceutical residues in water and sediment of Msunduzi River, KwaZulu-Natal, South Africa[J].Chemosphere, 2015(134):133-140.
[6] 肖明威.光催化氧化法处理抗生素废水新技术研究[D].广州:广东工业大学,2005.
[7] 赵永斌.3种四环素类抗生素降解菌的筛选及降解特性的研究[D].晋中:山西农业大学,2015.
[8] LIN B, LYU J, LYU X J, et al. Characterization of cefalexin degradation capabilities of twoPseudomonasstrains isolated from activated sludge[J].Journal of hazardous materials, 2015(282):158-164.
[9] AZZOPARDI E A, FERGUSON E L, THOMAS D W. Colistin past and future:a bibliographic analysis[J].Journal of critical care, 2013, 28(2):219e13-219e19.
[10] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11] 高岚,姜凤丽,秦朝英,等.标准曲线法测定硫酸多粘菌素B的抗生素效价[J].化学分析计量,2009,18(4):80-81.
[12] 袁超,崔乐芳,王瑞明.地衣芽孢杆菌在麸曲中产中性蛋白酶发酵工艺条件的研究[J].酿酒科技,2011(3):40-42.
[13] 杨革,刘艳,李桂芝.溶氧及pH对地衣芽孢杆菌合成聚γ-谷氨酸的影响[J].应用与环境生物学报,2006,12(6):850-853.
[14] 李永幸,杨帆,姜泽东,等.响应面优化微泡菌ALW1产褐藻胶裂解酶的发酵条件[J].发酵科技通讯,2016,45(2):75-80.
[15] 张义馨,张杨平,周锦敏,等.接种量对螺旋霉素发酵生产的影响[J].发酵科技通讯,2016,45(2):110-113.
[16] 赵宇,陈忠敏.微生物发酵过程中溶氧的影响及其调控[J].食品与发酵科技,2016,52(4):15-19.
[17] 平丽英,陈琳,方丽纳,等.浅谈微生物发酵中试的影响因素[J].发酵科技通讯,2017,46(4):212-215.
[18] 孙倩.高产碱性蛋白酶菌种的选育及发酵过程优化[D].郑州:河南工业大学,2012.

