大肠杆菌生产莽草酸发酵培养基优化
,,,,,
(1.莲花健康产业集团股份有限公司 博士后科研工作站,河南 项城 466200;2.天津科技大学 生物工程学院,天津 300457; 3.代谢控制发酵技术国家地方联合工程实验室,天津 300457)
莽草酸(shikimate),化学名称3,4,5-三羟基-1-环己烯-1-羧酸,是合成芳香族氨基酸及有机酸的重要中间物.由于其独特的化学结构,可以被用来合成重要的化学品,如酚类、生物碱、吲哚衍生物和手性药物等[1-2].更为重要的是,莽草酸是合成抗猪/禽流感药物达菲的前体物[3-5].此外,莽草酸还被广泛用作除草剂和抑菌剂[6],以及应用于有机化学和医药行业[5].莽草酸的现行生产方法主要是从八角果实中提取,其涉及步骤多、收率极低[7].微生物发酵法生产莽草酸是一种极具潜力的可持续的替代工业生产方法.目前,利用代谢工程构建莽草酸生产菌株已成为研究热点,包括大肠杆菌、谷氨酸棒杆菌、枯草芽孢杆菌等[7-8].经过多年的研究,科学家们已经构建了许多莽草酸生产菌株,有些莽草酸产量也比较高.然而,从莽草酸高产菌株的获得到其工业化生产之间还必须进行发酵培养基的优化和发酵过程控制的系统研究.
本课题组在前期工作中获得了一株大肠杆菌莽草酸生产菌,首先对其发酵培养基中碳氮源、金属离子进行了单因素优化,在此基础上,经过正交实验设计,对影响菌体生长和莽草酸产量的重要因素进行组合优化,拟获得适宜莽草酸发酵的培养基配方,为今后莽草酸工业化生产提供一定的参考.
1 材料与方法
1.1 材料与设备
1.1.1 菌 株
莽草酸生产菌大肠杆菌(Escherichiacoli)SHIKΔaroL,保藏于天津科技大学代谢工程研究室.
1.1.2 培养基
斜面培养基:牛肉膏10 g/L,酵母膏5 g/L,蛋白胨10 g/L,NaCl 2.5 g/L,琼脂粉30 g/L.pH 7.0~7.2,121 ℃灭菌20 min.
种子培养基:葡萄糖40 g/L,酵母粉2 g/L,蛋白胨2 g/L,柠檬酸三钠1.6 g/L,(NH4)2SO41.2 g/L,K2HPO45.6 g/L,MgSO4·7H2O 1.6 mg/L,FeSO4·7H2O 2.8 mg/L,MnSO4·H2O 1.2 mg/L,VB11.3 mg/L,VH0.3 mg/L.pH 7.0~7.2,121 ℃灭菌20 min.
发酵培养基:葡萄糖8 g/L,酵母粉1 g/L,蛋白胨5 g/L,牛肉膏1 g/L,玉米浆0.5 mL/L,柠檬酸2 g/L,(NH4)2SO41.6 g/L,K2HPO4·3H2O 7.5 g/L,MgSO4·7H2O 2 mg/L,FeSO4·7H2O 3 mg/L,钼酸铵0.009 mg/L,硼酸0.17 mg/L,CoCl2·6H2O 0.047 mg/L,MnSO4·H2O 0.017 mg/L,CuSO4·7H2O 0.017 mg/L,ZnSO4·7H2O 0.02 mg/L.碳氮源和金属离子优化实验中各物质的含量根据实际情况添加.pH 7.0~7.2,121 ℃灭菌20 min.
1.1.3 主要仪器
生化培养箱,广东省医疗器械厂;振荡培养箱,上海智诚分析仪器制造有限公司;数显鼓风干燥箱,上海博迅实业有限公司;752型紫外可见分光光度计,上海菁华科技仪器有限公司;SBA-40C生物传感仪,山东省科学院;LC-20A高效液相色谱仪,日本岛津公司.
1.2 发酵培养方法
1.2.1 菌种活化
从冷藏的菌种保藏斜面上或是保菌管中,用接种环接取适量菌体划线接种到新鲜活化斜面,36 ℃恒温培养16~20 h.再将斜面用无菌接种环转接至新的斜面,继续活化菌株,32 ℃培养20~24 h.
1.2.2 种子培养
将活化好的斜面,用接种环刮两环接种至含30 mL种子培养基(含质量分数4%的葡萄糖)的挡板瓶中.于36 ℃,200 r/min下摇床培养,通过苯酚红指示剂指示,用氨水调节pH为6.4~7.0.
1.2.3 发酵培养
种子培养约10 h后,按体积分数10%的接种量转接至终体积为30 mL的发酵培养基中,初始葡萄糖质量分数为4%.于36 ℃,200 r/min下摇床培养,通过苯酚红指示剂指示,用氨水调节pH为6.4~7.0.当底糖消耗将近完全时补加0.5 mL质量分数为60%的葡萄糖.
1.3 分析检测方法
1.3.1 pH测定
使用pH 6.4~8.0精密pH试纸测定.
1.3.2 菌体生物量测定
菌体生物量以干重表示,取30 mL发酵液13 000 r/min离心20 min,弃上清,菌体用去离子水洗涤两次,置于55 ℃恒温干燥箱中至恒重.用分析天平称重并计算每毫升发酵液所占的干重.
将发酵液稀释不同倍数,采用752型分光光度计测定600 nm波长下的吸光度,使OD600处于0.2~0.8.以OD值为横坐标,菌体干重为纵坐标绘制菌体干重曲线,获得干重曲线方程为:Y=0.362 41X-0.011 39(R2=0.998 3;Y为菌体干重DCW,g/L;X为OD600).
所取发酵样品稀释一定倍数后,测定OD600,根据干重曲线求得菌体干重DCW.
1.3.3 葡萄糖浓度测定
采用SBA-40C生物传感仪测定.
1.3.4 莽草酸浓度测定
采用高效液相色谱法测定.发酵液预处理:取1 mL发酵液于1.5 mL离心管中,12 000 r/min离心2 min,取上清液稀释5倍,稀释液经0.2 μm膜滤器过滤后置于4 ℃冰箱中待测.检测条件:紫外检测器,色谱柱为Bio-Rad Aminex HPX-87H(300 mm×7.8 mm,L×I.D.);流动相为5 mmol/L硫酸,流速0.5 mL/min,柱温30 ℃,检测波长215 nm.
2 结果与讨论
2.1 不同氮源对菌体生长及产酸的影响
发酵培养基中分别添加0,5,10,15,20 g/L的蛋白胨,对应的菌体生物量和莽草酸产量如图1(a)所示.当蛋白胨质量浓度为0~15 g/L时,菌体干重随着蛋白胨质量浓度的升高而升高,当蛋白胨质量浓度为20 g/L时,菌体干重略有下降.而莽草酸产量随着蛋白胨质量浓度的升高而一直上升.说明蛋白胨质量浓度确实对菌体生长和产酸有显著影响.
发酵培养基中分别添加0,1,3,6,9 g/L牛肉膏,菌体生物量和莽草酸产量如图1(b)所示.菌体干重基本随着牛肉膏添加量的升高而不断上升,而莽草酸产量基本保持不变.说明牛肉膏对菌体生长有一定作用,但对产酸没有显著影响.
发酵培养基中分别添加1,2,3,4 g/L的酵母粉,菌体生物量和莽草酸产量如图1(c)所示.当酵母粉质量浓度大于2 g/L时,菌体干重基本维持稳定.酵母粉质量浓度为2 g/L时,莽草酸产量达到最大,之后出现波动.说明酵母的添加对菌体生长有一定影响,对产酸没有显著影响.
发酵培养基中分别添加0,0.5,1.0,1.5 mL/L的玉米浆,菌体生物量和莽草酸产量如图1(d)所示.在所测试的玉米浆体积分数范围内,菌体干重和莽草酸产量出现小幅波动,基本保持不变,说明玉米浆的添加对菌体生长与产酸没有显著影响.
综上所述,通过单因素发酵优化实验发现:蛋白胨对菌体生长和产酸都有促进作用;牛肉膏对菌体生长促进作用明显,对产酸影响较小;酵母粉对菌体生长略有影响;玉米浆对菌株莽草酸发酵影响不大,可以忽略.因此,在后续正交实验设计中,只对蛋白胨和牛肉膏进行优化.赵现方等[9]对莽草酸发酵的碳氮源进行了优化,也发现相较于豆饼粉和酵母膏等,蛋白胨和牛肉膏对莽草酸发酵的影响最大.
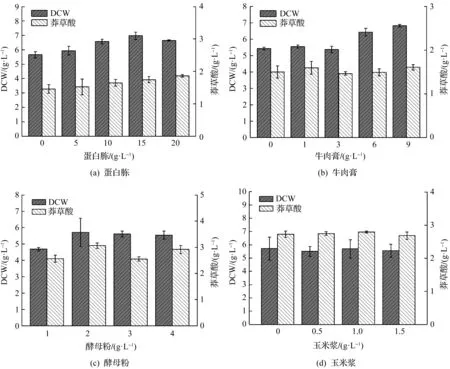
图1 氮源对菌体生长及产酸的影响Fig.1 Influence of nitrogen sources on bacterial growth and shikimate production
2.2 葡萄糖质量分数对菌体生长及产酸的影响
赵现方等[9]的研究发现葡萄糖和果糖比甘油和蔗糖等更有利于莽草酸的生产.笔者只选择了发酵工业中常用的葡萄糖,考察初始发酵培养基中的葡萄糖质量分数对莽草酸发酵的影响.在发酵培养基中分别添加质量分数为0.5%,1%,1.5%,2.0%,2.5%的葡萄糖,菌体生物量和莽草酸产量如图2所示.菌体干重和莽草酸产量随葡萄糖质量分数的升高呈现先升后降趋势,均在葡萄糖为1.5%时达到最大值,说明葡萄糖质量分数对菌体生长与产酸有一定的影响.仲楠[10]研究结果表明:莽草酸产量随着葡萄糖质量分数的升高先增加后下降,在葡萄糖质量分数为1.7%时达到最大值,与本实验结果类似.
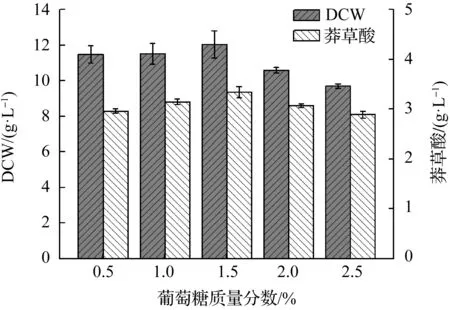
图2 葡萄糖质量分数对菌体生长及产酸的影响Fig.2 Influence of initial glucose content on bacterial growth and shikimate production
2.3 金属离子对菌体生长及产酸的影响
发酵培养基中分别添加质量浓度为0,1,2,3 mg/L的FeSO4·7H2O,菌体生物量和莽草酸产量如图3(a)所示.菌体干重随FeSO4·7H2O质量浓度的升高而不断增加,在3 mg/L时达到最大值.莽草酸产量在FeSO4·7H2O质量浓度为2 mg/L时升至最大值.说明铁盐的添加对菌体生长与产酸有一定的促进作用.在发酵培养基中分别添加质量浓度为0.8,1.4,2,2.6 mg/L的MgSO4·7H2O,菌体生物量和莽草酸产量如图3(b)所示.菌体干重随着MgSO4·7H2O质量浓度的升高先增加后下降,在MgSO4·7H2O为1.4 mg/L时达到最大.莽草酸产量呈现小幅波动.
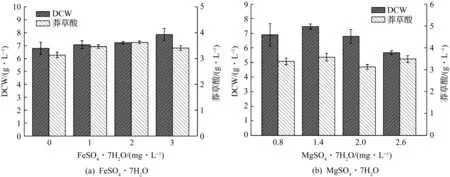
图3 金属离子对菌体生长及产酸的影响Fig.3 Effects of metal ions on bacterial growth and shikimate production
综上所述,FeSO4·7H2O对菌体生长和莽草酸积累均具有较大影响,而MgSO4·7H2O对菌体生物量影响较大.就单因素结果而言,最佳FeSO4·7H2O质量浓度为2 mg/L,最佳MgSO4·7H2O质量浓度为1.4 mg/L.然而,亚铁离子和镁离子为微量元素,少量添加对微生物生长具有不可或缺的作用,但其添加量需要严格控制.因此,在后续正交实验中对这两种金属离子的用量也进行了优化.
2.4 发酵培养基部分成分的正交实验
通过以上单因素发酵优化实验,得出各因素对菌体生长和莽草酸积累的最适添加浓度.由于玉米浆对菌体生物量和莽草酸产量均无显著影响,可以将其去除.选取最优的酵母粉用量2 g/L,葡萄糖质量浓度15 g/L,其他发酵培养基的成分保持不变,对牛肉膏、蛋白胨、MgSO4·7H2O和FeSO4·7H2O四种成分进行进一步正交优化.实验采用四因素三水平的L9(34)正交设计,各因素及水平见表1,莽草酸产量及均值分析见表2,显著性统计分析见表3.
表1正交实验因素水平表
Table1Factorsandlevelsinorthogonalexperiment

因素水平123A牛肉膏/(g·L-1)136B蛋白胨/(g·L-1)51015CMgSO4·7H2O/(mg·L-1)0.81.42.0DFeSO4·7H2O/(mg·L-1)123
表2莽草酸产量及均值分析
Table2Shikimateproductionandaverageanalysis
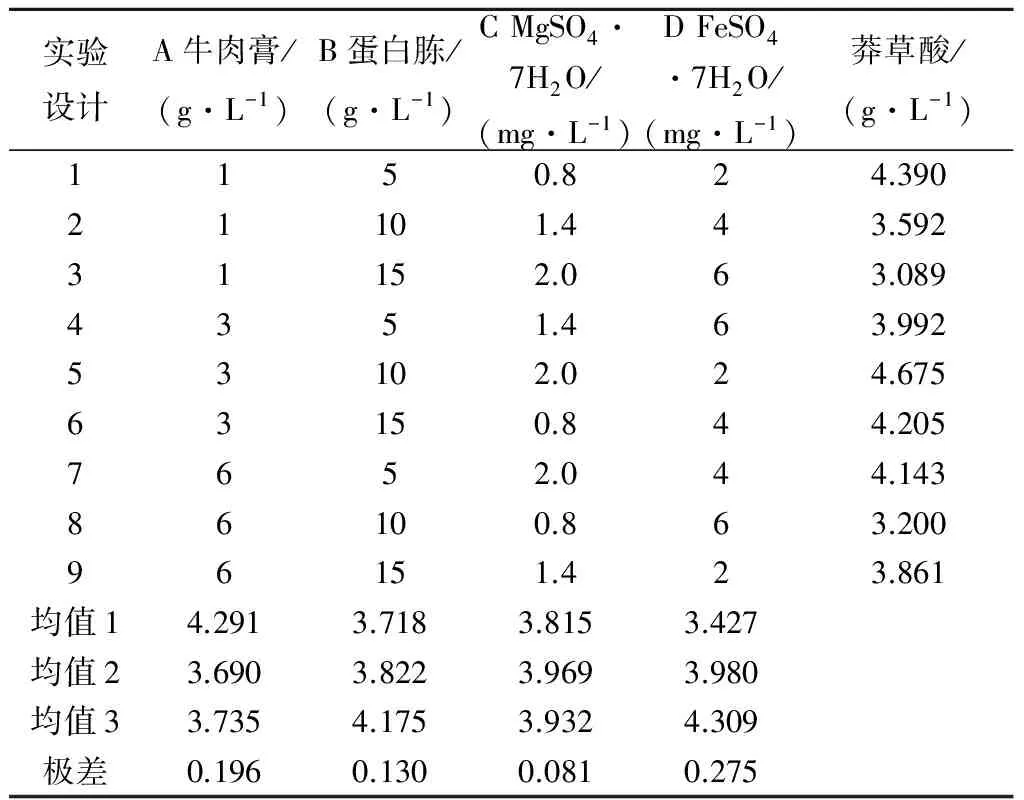
实验设计A牛肉膏/(g·L-1)B蛋白胨/(g·L-1)CMgSO4·7H2O/(mg·L-1)DFeSO4·7H2O/(mg·L-1)莽草酸/(g·L-1)1150.824.39021101.443.59231152.063.0894351.463.99253102.024.67563150.844.2057652.044.14386100.863.20096151.423.861均值14.2913.7183.8153.427均值23.6903.8223.9693.980均值33.7354.1753.9324.309极差0.1960.1300.0810.275
极差分析:极差越大,表明因素的重要程度越高.由表2可知:四因素的极差排序为FeSO4·7H2O>牛肉膏>蛋白胨>MgSO4·7H2O,说明FeSO4·7H2O对实验结果带来的影响最大,其次为牛肉膏和蛋白胨,MgSO4·7H2O对实验结果造成的影响最小.
表3显著性统计分析1)
Table3Significantstatisticalanalysis
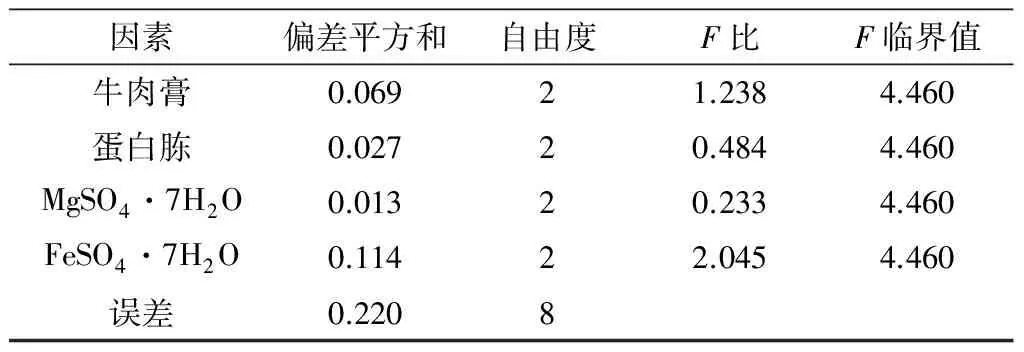
因素偏差平方和自由度F比F临界值牛肉膏0.06921.2384.460蛋白胨0.02720.4844.460MgSO4·7H2O0.01320.2334.460FeSO4·7H2O0.11422.0454.460误差0.2208
注:1) 在实验水平α=0.05时,分别验证各因素的显著性.
通过对以上四组实验结果的对比分析可知:菌体生物量及莽草酸产量在不同实验组中相差较大,同组实验则相差较小.
分别以各因素的水平变化为横坐标,以莽草酸产量的均值为纵坐标,画出水平与指标关系图(图4).从图4可以看出:A2B1C3D1为最佳方案,符合表2中莽草酸产量最高时的因素组合.因此确定该培养基为大肠杆菌莽草酸发酵的最适培养基.具体配方为:牛肉膏3 g/L,蛋白胨10 g/L,MgSO4·7H2O 2 mg/L,FeSO4·7H2O 2 mg/L,酵母粉2 g/L,葡萄糖15 g/L,其他成分同材料与方法部分描述.通过培养基优化后,莽草酸产量达到4.675 g/L,是优化前1.453 g/L的3.22倍.
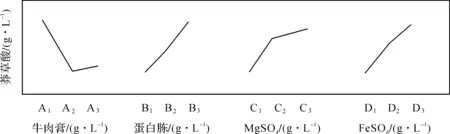
图4 各因素水平与指标关系图Fig.4 Correlation between levels and shikimate productions for each factor
3 结 论
本研究对大肠杆菌生产莽草酸的发酵培养基进行了优化,显著提高了莽草酸的产量.首先通过单因素优化实验发现,与酵母粉和玉米浆相比,蛋白胨和牛肉膏对菌体生长和莽草酸产量影响较大,初始葡萄糖、MgSO4·7H2O和FeSO4·7H2O浓度均对菌体干重和莽草酸产量产生较大影响.通过正交实验对这四个因素进行进一步优化,获得最佳莽草酸发酵培养基,此时莽草酸产量达到4.675 g/L,为培养基优化前的3.22倍.
参考文献:
[2] PROF J M G, THOMAS P S, THOMAS J D, et al. Benzene-free synthesis of phenol[J].Angewandte chemie international edition, 2001, 40(10):1945-1948.
[3] KNOP D R, DRATHS K M, CHANDRAN S S, et al. Hydroaromatic equilibration during biosynthesis of shikimic acid[J].Journal of the American chemical society, 2001, 123(42):10173-10182.
[4] RUSSELL R J, HAIRE L F, STEVENS D J, et al. The structure of H5N1 avian influenza neuraminidase suggests new opportunities for drug design[J].Nature, 2006, 443(7107):45-49.
[5] GHOSH S, CHISTI Y, BANERJEE U C. Production of shikimic acid[J].Biotechnology advances, 2012, 30(6):1425-1431.
[6] SONG C J, JIANG S D, SINGH G. Syntheses of (6S)-6-fluoro-and (6R)-6-hydoxyshikimic acids[J].Tetrahedron letters, 2001, 42(51):9069-9071.
[8] CHEN X Z, LI M M, ZHOU L. Metabolic engineering ofEscherichiacolifor improving shikimate synthesis from glucose[J].Bioresource technology, 2014, 166:64-71.
[9] 赵现方, 王艳婕, 武忠伟, 等. 莽草酸发酵培养基的最佳碳氮源筛选[J].河南科技学院学报(自然科学版), 2011, 39(6):16-18.
[10] 仲楠. 产莽草酸基因工程菌的构建及发酵研究[D].北京:北京化工大学, 2012.

