2,3-吡啶二甲酰亚胺及其工程菌转化产物的高效液相色谱检测
钮利喜, 马师师(山西大学生物技术研究所, 教育部化学生物学与分子工程重点实验室, 山西 太原 030006)
3-氨基甲酰基-α-吡啶甲酸(3-carbamoyl-α-picolinic acid,α-3CP)作为一类重要的结构单元,是合成药物和现代农药时的一种通用有机合成中间体,具有广阔的应用前景,如利用它可以合成烟碱类杀虫剂[1]。其化学合成主要是利用2,3-吡啶二羧酸(2,3-pyridinedicarboxylic acid, PDC)和氨合成2,3-吡啶二甲酰亚胺(2,3-pyridinedicarboximide, PDI),再通过PDI水解得到α-3CP[2]。但是PDI的水解反应随机发生于分子中两个酰胺键中的一个,生成α-3CP和2-氨基甲酰基-β-吡啶甲酸(2-carbamoyl-β-picolinic acid,β-2CP)两种水解产物。利用D-海因酶催化PDI水解可以特异地断裂其中的一个酰胺键,只生成α-3CP,从而避免副反应产物β-2CP的生成(见图1)[3]。目前国内尚未见对复杂环酰亚胺底物进行酶催化转化的报道。

图 1 D-海因酶区域选择性水解PDI为α-3CP的示意图Fig. 1 Schematic diagram of regioselective hydrolysis of PDI catalyzed to α-3CP by D-hydantoinase PDI: 2,3-pyridinedicarboximide; α-3CP: 3-carbamoyl-α-picolinic acid.
环酰胺酶超家族(superfamily of cyclic amide hydrolases)是生物体内重要的水解酶类之一,可水解不同的环酰胺键。根据底物专一性不同可将其分为环酰脲水解酶和环酰亚胺水解酶。环酰脲水解酶包括海因酶(hydantoinase)、二氢尿嘧啶酶、二氢乳清酸酶、尿囊素酶[4]。环酰亚胺水解酶一般作用于简单的环酰亚胺,最适底物是含硫的环酰亚胺,生成相应的半酰胺。海因酶的最适底物是海因或二氢尿嘧啶,其中少数海因酶还能作用于复杂的环酰亚胺[5,6]。
目前对D-海因酶的研究主要集中在利用其催化海因及其5′-单替代产物制备D-氨基酸,鲜有发现具有环酰亚胺水解酶活性的D-海因酶。我们从自行分离得到的一株原始菌株假单胞菌YZ26中克隆得到了一个D-海因酶基因,活性检测表明其同时具有环酰亚胺水解酶活性。
1 实验部分
1.1 仪器与试剂
Breeze 1525型高效液相色谱仪(美国Waters公司),超纯水发生器(Millipore公司), WD-9415B型超声波清洗机(北京市六一仪器厂)。PDI(纯度99%)、α-3CP(纯度97%)、β-2CP(纯度97%)为北京百灵威公司产品。含有D-海因酶基因的工程菌pET3a-hyd/BL21(DE3)为本室构建保存。实验中所有用水均为超纯水。
1.2 色谱条件
色谱分离柱:HypersilTMGOLD C18(250 mm×4.6 mm, 5 μm);流动相:H2O-乙腈(体积比为90∶10,含0.1%(体积分数)三氟乙酸);流速:1 mL/min;检测波长:254 nm;柱温为室温。
1.3 样品处理
标准溶液:精确称取一定量的PDI、α-3CP和β-2CP,用超纯水配制成0.5、1.0、2.0、4.0、8.0 mmol/L的标准工作溶液。
反应液制备:工程菌pET3a-hyd/BL21(DE3)发酵液经异丙基硫代半乳糖苷(IPTG)过夜诱导后,在9 000 r/min转速下离心10 min,收集菌体细胞。再用H2O清洗菌体两次后将其悬浮于饱和的PDI水溶液中,于37 ℃摇床160 r/min反应适当时间,用12 000 r/min转速离心10 min,取其上清进行HPLC测定。在上述条件下,1 min内转化底物生成1 μmol产物所需酶量定义为一个酶活单位(U)。
2 结果与讨论
2.1 标准色谱图
在1.2节色谱条件下,取1.0 mmol/L的PDI、α-3CP、β-2CP标准溶液等体积混合后取20 μL混合液上样,得到3种标准品的色谱图(见图2),其中PDI的出峰时间为5.7 min,α-3CP的出峰时间为3.0 min,β-2CP的出峰时间为3.9 min。3种化合物达到了基线分离。

图 2 PDI、α-3CP和β-2CP标准混合液的色谱图Fig. 2 Chromatograms of the standard mixture of PDI, α-3CP and β-2CP
由于PDI在缓冲溶液中很容易发生自发水解,推测该酰胺键在PDI中不稳定,因此在酸碱条件下容易发生自发水解,但该自发水解无特异性,在两个酰胺键上随机发生(见图3)。而在水溶液中PDI、α-3CP、β-2CP都非常稳定,因此我们选择H2O作为整个反应体系的溶剂。

图 3 PDI在50 mmol/L PBS (pH 7.5)中自发水解Fig. 3 Autohydrolysis of PDI in 50 mmol/L PBS (pH 7.5)
2.2 工作曲线的制作
将配制好的PDI、α-3CP、β-2CP系列浓度的标准溶液经0.22 μm滤膜过滤后进行分析,结果各标准品的峰面积Y与进样量X(μmol)的线性回归方程如下:PDI,Y=5.01×107X+4.28×104,r2=0.999 6;α-3CP,Y=4.56×107X+4.20×105,r2=0.999 4;β-2CP,Y=4.427 84×107X+4.32×105,r2=0.999 1。表明线性关系良好。
2.3 D-海因酶水解PDI的色谱分析
工程菌pET3a-hyd/BL21(DE3)经诱导后可以表达可溶性的重组D-海因酶蛋白,能专一性地水解PDI分子吡啶2位上的酰胺键,将其转化为α-3CP。由于PDI在水中的溶解度较低,为了保证酶催化反应始终处于最大反应速度,我们在转化体系中加入过量的PDI,保证在终止反应时反应液中仍然有过量的固体PDI,我们在1 mL转化体系中加入由相同体积发酵液收集得到的菌体细胞,反应30 min后离心取上清液进行HPLC检测酶催化产物α-3CP的生成(见图4),利用标准曲线将峰面积换算成摩尔数,测得工程菌中D-海因酶以PDI为底物时比活力为0.61 U/(mL510OD600 nm)。
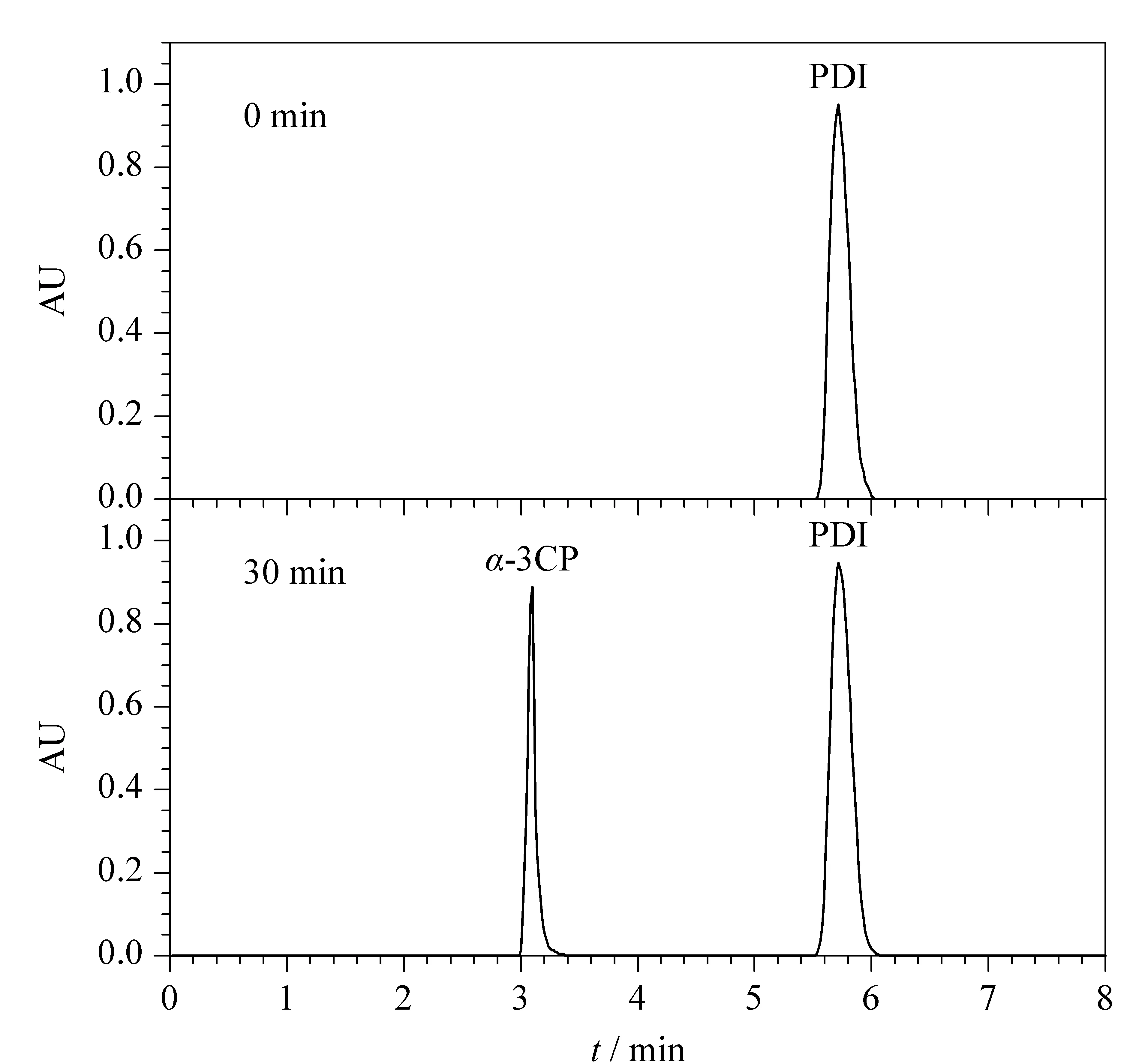
图 4 利用重组D-海因酶催化PDI生成α-3CPFig. 4 Generation of α-3CP by catalyzing PDI using recombinant D-hydantoinase
3 结论
通过建立HPLC快速检测方法确认我们重组表达的一种D-海因酶具有催化复杂环酰亚胺底物的能力,能够特异性地水解底物分子两个酰胺键中的一个,生成相应的半酰胺,该产物还能在半酰胺酶的催化下继续转化为二羧酸[7]。如果能通过一定的物理/化学助溶方法,或者建立新型的转化体系,解决底物溶解度差的问题,该方法有望用于复杂的半酰胺和二羧酸有机物分子的工业化生产。
参考文献:
[1] Moriya K, Shibuya K, Hattori Y, et al. Biosci Biotech Biochem, 1993, 57(1): 127
[2] Luc I, Spiessens M, Marc J, et al. Bull Soc Chim Belg, 1980, 89: 205
[3] Ogawa J, Soong C L, Ito M, et al. Appl Microbiol Biotechnol, 2000, 54(3): 331
[4] Soong C L, Ogawa J, Shimizu S. J Mol Catal B: Enzym, 2001, 12(1-6): 61
[5] Huang C Y, Yang Y S. Protein Expr Purif, 2005, 40(1): 203
[6] Soong C L, Ogawa J, Honda M, et al. Appl Environ Microbiol, 1999, 65(4): 1459
[7] Soong C L, Ogawa J, Shimizu S. Appl Environ Microbiol, 2000, 66(5): 1947

