超高效液相色谱-串联质谱法测定阿胶中马、牛、羊、猪、骆驼、鹿皮源成分
杭宝建, 田晨颖, 陈 晓, 邢 晟, 石 峰*, 冷佳蔚*, 巩丽萍*(. 山东省食品药品检验研究院, 山东 济南 500; . 山东中医药大学, 山东 济南 50355)
阿胶出现于先秦,至汉代已成为常用药物,具有补血益气、滋润养颜、提高机体免疫力等功能,可用于失血贫血、缺铁贫血、再生障碍贫血及年老体弱、儿童、妇女的滋补[1-4]。近年来,驴皮资源短缺,阿胶生产企业为了解决原料紧缺问题及降低成本,采用供应量大的马、牛、猪、羊、骆驼、鹿皮等低值皮进行掺假,而现有标准仅对牛皮源成分进行控制,未控制上述其余杂皮的检查,因此急需对现有标准进行提升。
皮的主要成分胶原蛋白经高温熬制后成为不完全水解的肽段,不同物种的胶原蛋白经胰蛋白酶酶切后可形成物种特异性的多肽[3-5]。本研究参考文献[6-8],采用蛋白酶酶切技术和质谱多肽识别技术建立了马、牛、羊、猪、骆驼、鹿等非驴皮源成分的掺假鉴别方法,可有效控制阿胶掺假现象,提升产品品质。

表 1 几种动物特征肽的序列及离子信息Table 1 Sequence and ion information of the marker peptides of several kinds of animals
* Quantitative ion.
本研究通过提取阿胶原材料驴皮及掺假马、牛、猪、羊、骆驼、鹿等杂皮的胶原蛋白,采用蛋白质组学技术,将驴皮与掺假皮源进行蛋白质组比对,找出各杂皮的理论特征肽,同时采用高分辨质谱结合蛋白搜库技术对理论特征肽进行序列及结构的验证,根据确证的杂皮特征肽,采用超高效液相色谱-串联质谱法建立了马、牛、羊、猪、骆驼、鹿等非驴皮源成分的掺假鉴别方法,可有效控制阿胶掺假现象,提升产品品质。
1 实验部分
1.1 仪器与试药
AB SCIEX Triple Quad 6500+超高效液相色谱-三重四极杆质谱联用仪(AB公司); KQ-300GDV型恒温数控超声器(昆山市超声仪器有限公司); Vortex-6涡旋振荡器(海门市其林贝尔仪器制造有限公司)。
甲醇、乙腈均为色谱纯(德国Merck公司)、甲酸为色谱纯(美国Fisher公司),胰蛋白酶为优级纯(美国西格玛公司),水为去离子水(Milli-Q纯水系统生产),碳酸氢铵为分析纯(上海国药集团)。
对照品:马皮特征肽、牛皮特征肽、羊皮特征肽、猪皮特征肽、骆驼皮特征肽、鹿皮特征肽对照品均由上海强耀生物有限公司合成,纯度为98%。
样品:研究用阿胶、马、牛、羊、猪、骆驼、鹿皮胶样品为实验室自制,其余阿胶样品为日常监督抽验样品,共15批。
1.2 马、牛、羊、猪、骆驼、鹿皮特征的序列鉴别
本工作参考文献[9],通过提取阿胶原材料驴皮及掺假马、牛、猪、羊、骆驼、鹿等杂皮的胶原蛋白,采用蛋白质组学技术,将驴皮与掺假皮源进行蛋白质组比对,找出各杂皮的理论特征肽,同时采用高分辨质谱结合蛋白质搜库技术对理论特征肽进行序列及结构的验证,序列见表1。
1.3 色谱、质谱条件
液相色谱条件:色谱柱为ACQUITY UPLC®BEH C18(100 mm×2.1 mm, 1.7 μm),流速0.3 mL/min,流动相A为0.1%甲酸溶液,B为0.1%甲酸乙腈溶液,梯度洗脱程序:0~3 min, 4%B; 3~8 min, 4%B~8%B; 8~15 min, 8%B~50%B; 15~16 min, 50%B; 16~16.1 min, 4%B; 16.1~25 min, 4%B;流速:0.3 mL/min。
质谱条件:电喷雾离子源(ESI)正离子扫描模式,多反应监测;离子源温度:550 ℃。定性、定量离子对、锥孔电压、碰撞能量见表1。
1.4 标准溶液及样品溶液的制备
标准溶液:取研究用自制阿胶样品0.1 g,置于50 mL量瓶中,加入质量分数约为1%的NH4HCO3水溶液(1 g固体,加入100 mL水溶解)40 mL,超声处理30 min,使样品完全溶解并加1% NH4HCO3水溶液定容至刻度,摇匀,得阿胶基质溶液。分别取马、牛、羊、猪、骆驼、鹿皮特征肽适量,加阿胶基质溶液制成各特征肽质量浓度为2 μg/mL的溶液,作为标准储备溶液。系列标准溶液用阿胶基质溶液配制,现用现配。
样品溶液:取胰蛋白酶适量,加1% NH4HCO3溶液溶解,制成质量浓度为1 μg/μL的胰蛋白酶溶液。取阿胶样品0.1 g,置于50 mL量瓶中,加1% NH4HCO3溶液40 mL,超声处理30 min,使样品完全溶解并加入上述1% NH4HCO3溶液定容至刻度,过0.22 μm滤膜,取100 μL续滤液至300 μL微量进样瓶中,同时加入上述1 μg/μL的胰蛋白酶溶液10 μL,摇匀,37 ℃恒温酶解12 h,即得。

表 2 几种动物特征肽的线性范围、回归方程、相关系数、检出限及定量限Table 2 Linear ranges, regression equations, correlation coefficients (R2), LODs and LOQs for the marker peptides of several kinds of animals
Y: peak area of marker peptide;X: mass concentration of marker peptide, mg/L.
2 结果与讨论
2.1 特征肽的发现
阿胶中的主要成分为驴皮胶原蛋白水解后的多肽。皮类胶原蛋白主要由Ⅰ型胶原蛋白组成[10],占胶原蛋白总量的80%~85%,Ⅰ型胶原蛋白又包括Ⅰ型α1、α2亚型。通过对马、牛、羊、猪、骆驼、鹿的Ⅰ型α1、α2胶原蛋白序列进行blast多序列比对,发现了胶原蛋白COL1α2之间的差异序列,进一步模拟胰蛋白酶酶切胶原蛋白获得物种相对的理论特征肽段。如果α1特征序列数据库中没有找到特征序列,就在α2中找,如果α2中没有,则尝试在其他类型胶原蛋白中找,最终找出理论特征肽,并通过高分辨质谱对各特征肽进行验证,各特征肽碎片归属均与数据库中信息一致。
2.2 质谱参数的优化
质谱的锥孔电压、碰撞能对待测物的裂解有重要的影响,配制100 ng/mL的各特征肽的单一标准溶液进行质谱条件优化:在电喷雾正离子模式下,通过蠕动泵直接进样方式,确定待测物母离子;逐渐改变碰撞能量,通过观察离子的丰度变化并与高分辨质谱碎片归属相结合确定定量离子、定性离子;最终通过优化质谱参数,确定碎裂电压及碰撞能量。
2.3 专属性实验
以马、牛、羊、猪、骆驼、鹿皮胶样品为阳性样品,以自制阿胶样品为阴性样品,选择马、牛、羊、猪、骆驼、鹿皮特征肽检测离子对进行测定[11,12],结果见图1。在这几种阳性样品中,各特征肽对照品相应的保留时间位置上均呈现出各相应皮特征肽离子流色谱峰,两两间各特征肽互不检出,说明每一特征肽相对于其他5个物种是具有特征性的。阿胶样品的色谱图中,在与马、牛、羊、猪、骆驼、鹿皮胶样品相应的位置上均无相应的色谱峰,因此认为所选各特征肽具有一定的代表性,且阿胶样品对测定无干扰。

图 1 (a)阿胶和(b)几种动物特征肽对照品的MRM色谱图Fig. 1 MRM chromatograms of (a) colla corii asini and (b) marker peptides of several kinds of animals
2.4 标准曲线、线性范围及检出限
取系列标准溶液进样,按上述色谱条件测得峰面积。以峰面积为纵坐标,各特征肽对照品质量浓度为横坐标,绘制标准曲线,结果表明各组分在0.02~2.0 mg/L内线性关系良好,线性方程、相关系数见表2。在阿胶样品中添加适量的标准工作溶液后,以3倍信噪比计算检出限,以10倍信噪比计算定量限,结果见表2。
2.5 重复性试验
取同一样品,按1.4节方法平行制备6份供试品溶液,以监测离子对进行测定,马、牛、羊、猪、骆驼、鹿皮胶特征肽峰面积的RSD分别为6.8%、6.1%、6.3%、 6.9%、6.9%和1.5%。
2.6 稳定性试验
取研究用同一样品,平行制备6份样品溶液,将6份样品置于-20 ℃条件下分别冷冻1天、7天、14天、30天、45天、60天后,融化后室温进样,以监测离子对进行检测,结果均可检出各特征肽,说明酶解样品在冷冻条件下60天内均稳定。
2.7 不同工艺对杂皮胶特征肽检出的影响
由于阿胶生产厂家较多,各厂家之间工艺差别较大,因此实验模拟了弱(100 ℃水解2 h)、中(120 ℃水解2 h)、强(125 ℃水解4 h)3种程度的熬胶条件,制备出不同制胶工艺下这几种杂皮胶样品,以各特征肽离子对进行检测。由表3结果可见,3种条件下制备的胶类样品中均可以检出相应特征肽。
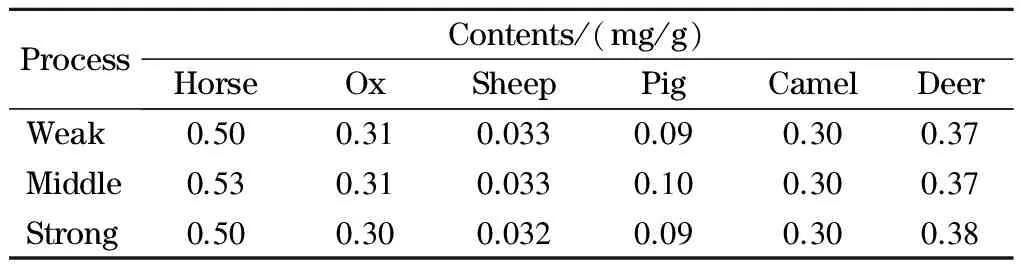
表 3 不同工艺对几种动物特征肽检出的影响Table 3 Effects of different processes on the marker peptides of several kinds of animals
Weak: hydrolysis for 2 h at 100 ℃; middle: hydrolysis for 2 h at 120 ℃; strong: hydrolysis for 2 h at 125 ℃.
2.8 样品测定
以所建立的方法对15批阿胶样品进行检验,结果表明,14批样品检出马源性成分,6批样品检出牛源性成分,1批样品检出羊源性成分,2批样品检出猪源性成分,1批样品检出骆驼源性成分(见表4)。
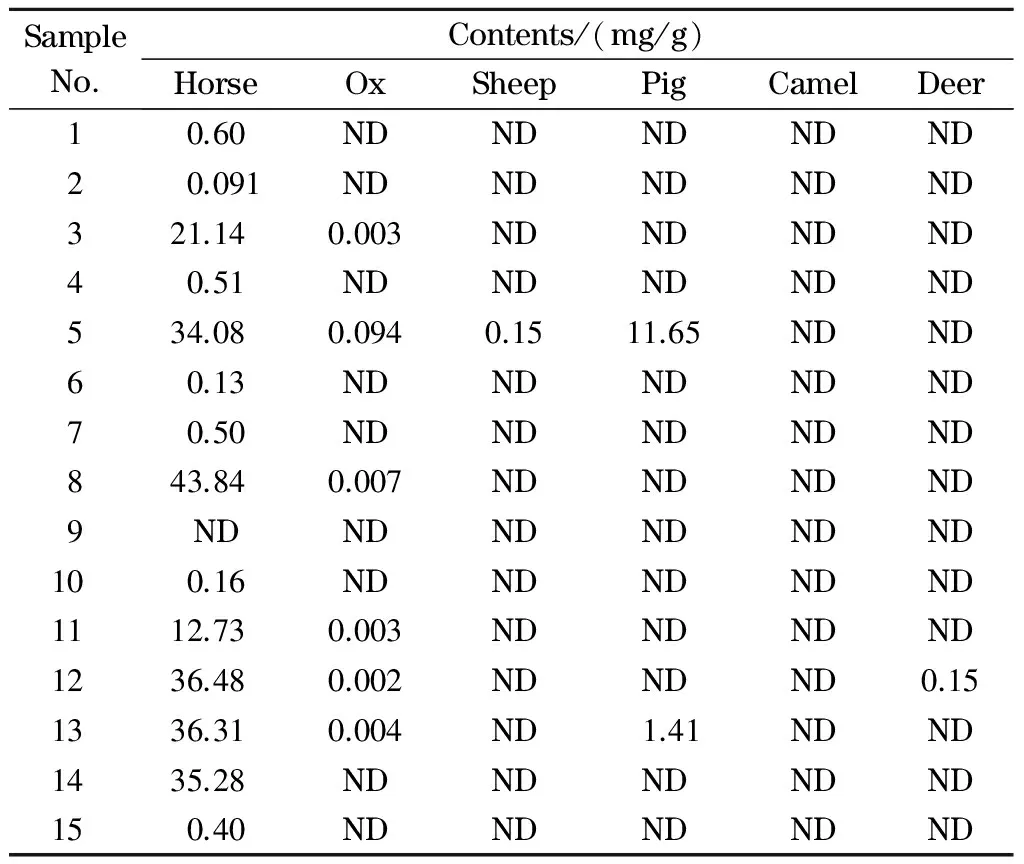
表 4 阿胶样品中杂皮源成分检测结果Table 4 Test results of miscellaneous skin ingredients in colla corii asini samples
ND: not detected.
3 结论
本文建立了超高效液相色谱-串联质谱测定阿胶中马、牛、羊、猪、骆驼、鹿皮源成分的检测方法,样品前处理操作简单,方法专属性强。实验结果表明本方法具有较好的灵敏度、特异性和精密度,能满足阿胶中杂皮源成分的检测要求,15批日常抽检阿胶样品不同程度地检出了掺假成分,因此非常有必要建立阿胶中杂皮源成分的检测方法,以提升产品质量,为阿胶品质的监控提供技术支持。
参考文献:
[1] Pharmacopoeia Commission of the People’s Republic of China. Pharmacopoeia of the People’s Republic of China, Part 1. Beijing: China Medical Science Press, 2015: 189
国家药典委员会. 中华人民共和国药典, 一部. 北京: 中国医药科技出版社, 2015: 189
[2] Zhang G F, Liu T, Wang Q, et al. Pharmaceutical Biotechnology, 2009, 16(3): 250
张贵锋, 刘涛, 王前, 等. 药物生物技术, 2009, 16(3): 250
[3] Hu J Y, Cheng X L, Xiao X Y, et al. Chinese Pharmaceutical Affairs, 2007, 21(3): 193
胡军影, 程显隆, 肖新月, 等. 中国药事, 2007, 21(3): 193
[4] Zhang G F, Liu T, Wang Q, et al. China Journal of Chinese Materia Medica, 2009, 34(10): 1211
张贵锋, 刘涛, 王前, 等. 中国中药杂志, 2009, 34(10): 1211
[5] Zhang G F, Liu T, Wang Q, et al. Food Hydrocolloids, 2009, 3(7): 2001
[6] Cheng X L, Li W J, Wei F, et al. Asia-Pacific Traditional Medicine, 2011, 7(3): 167
程显隆, 李文杰, 魏峰, 等. 亚太传统医药, 2011, 7(3): 167
[7] Cheng X L, Chen J, Li M H, et al. Chinese Pharmaceutical Journal, 2015, 50(2): 104
程显隆, 陈佳, 李明华, 等. 中国药学杂志, 2015, 50(2): 104
[8] Cheng X L, Li W J, Zhang X L, et al. Chinese Journal of Pharmaceutical Analysis, 2012, 32(6): 931
程显隆, 李文杰, 张小龙, 等. 药物分析杂志, 2012, 32(6): 931
[9] Cheng X L, Wei F, Chen J, et al. J Anal Methods Chem, 2014: 49
[10] Li H, Huang M J, Zhang S Q, et al. China Journal of Chinese Materia Medica, 2006, 31(8): 659
李昊, 黄美娟, 张少权, 等. 中国中药杂志, 2006, 31(8): 659
[11] Cheng X L. [PhD Dissertation]. Beijing: Beijing University of Chinese Medicine, 2012
程显隆. [博士学位论文]. 北京: 北京中医药大学, 2012
[12] Cheng X L, Wei F, Xiao X Y, et al. J Pharm Biomed Anal, 2012, 62: 191

