亲水相互作用色谱-串联质谱法测定液体食品中14种甜味剂
范广宇, 冯 峰, 张 峰*, 高 飞, 李晓明, 梁振纲(. 中国检验检疫科学研究院食品安全研究所, 北京 0076; 2. 连云港出入境检验检疫局, 江苏 连云港 22202; . 济南出入境检验检疫局, 山东 济南 2500; . 海南出入境检验检疫局技术中心, 海南 海口 570)
甜味剂是指能够赋予食品甜味的一类食品添加剂,分为人工甜味剂和天然甜味剂。人工甜味剂因为成本低、甜度高已在食品加工中被广泛应用,但长期过量食用人工合成甜味剂存在一定的安全风险,因而天然甜味剂受到人们的日益关注[1,2]。甜菊糖苷是从甜叶菊(SteviaRebaudiana(Bertoni) Hemsl.)叶子中提取出的一类天然甜味剂,其中含量比例最高的为甜菊苷(stevioside)和瑞鲍迪苷A(rebaudioside A),此外还包括其他结构类似物。瑞鲍迪苷A的甜度是蔗糖的450倍,而甜菊苷带苦味[3]。我国《食品安全国家标准 食品添加剂使用标准》中规定了甜味剂的使用范围和限量[4]。但在实际生产中存在违法添加甜味剂或者过量使用甜味剂的情况,因此亟须建立高通量、快速、灵敏的方法以检测食品中的甜味剂。
食品中甜味剂的检测方法主要有毛细管电泳法[5-7]、液相色谱法[8-11]和液相色谱-串联质谱法等[12-19]。毛细管电泳法目前在甜味剂检测中应用不多,不能满足多种甜味剂同时检测的需求;液相色谱法灵敏度低且容易受到基质干扰;液相色谱-串联质谱法因具有强大的定性定量能力而被越来越多地应用于甜味剂的检测中。目前,分离甜味剂多采用反相色谱法,但其存在分离效果不理想、需要在有机相中加入缓冲盐和分离时间较长等问题。亲水相互作用色谱(HILIC)是一种特殊的液相色谱分离模式,采用的是极性固定相和有机相含量较高的含水流动相。亲水相互作用色谱可以保留在反相色谱中不保留或洗脱过快的强极性物质,也因流动相中有机溶剂含量高使得柱压不会过高,从而可以改善某些极性物质的峰形,因此亲水相互作用色谱更适合用于分离极性物质[20]。本研究建立了亲水相互作用色谱-三重四极杆质谱快速、准确检测饮料和白酒中6种人工合成甜味剂和8种甜菊糖苷类甜味剂的方法。
1 实验部分
1.1 仪器与试剂
1200高效液相色谱仪,配备自动进样器、柱温箱(美国Agilent公司); API5000三重四极杆质谱仪(美国AB Sciex公司); Analyst工作站;XP 105分析天平(瑞士Mettler公司); A10 Milli-Q超纯水机(美国Millipore公司)。
甜蜜素(sodium cyclamate)、安赛蜜(acesulfame potassium)、糖精钠(sodium saccharin)、三氯蔗糖(sucralose)、阿斯巴甜(aspartame)和纽甜(neotame)均购自德国Dr. Ehrenstorfer公司;甜菊苷、瑞鲍迪苷B(rebaudioside B)、瑞鲍迪苷D(rebaudioside D)、瑞鲍迪苷F(rebaudioside F)、杜克苷A(dulcoside A)均购自美国ChromaDex公司;瑞鲍迪苷A、瑞鲍迪苷C(rebaudioside C)和甜菊双糖苷(steviolbioside)均购自北京百灵威公司。甲醇、乙腈(色谱纯)和甲酸铵(优级纯)购自美国Fisher公司。饮料和白酒样品均购自超市和电商平台。
1.2 标准溶液的制备
准确称取适量标准品,分别用水溶解并配制成质量浓度为1 000 mg/L的标准储备液,于4 ℃储存。分别移取14种甜味剂标准储备液,用乙腈-水(70∶30, v/v)定容,配制成质量浓度为10 mg/L的混合标准溶液,于4 ℃储存;使用时根据需要用乙腈-水(70∶30, v/v)稀释至所需浓度。
1.3 样品制备
准确称取1 g样品,用水稀释至100 mL,过0.22 μm滤膜后上机测定。
1.4 色谱条件
色谱柱:Waters XBridge Amide色谱柱(150 mm×4.6 mm, 3.5 μm);柱温:35 ℃;流动相:乙腈-10 mmol/L甲酸铵(65∶35, v/v);等度洗脱;流速:0.4 mL/min;进样体积:5 μL。
1.5 质谱条件
离子源为电喷雾电离(ESI)源;多反应监测(MRM)、负离子模式;实验所用的气体均为高纯氮气;碰撞气(CAD)压力为5 kPa;气帘气(CUR)压力为25 kPa;雾化气(GS1)压力为55 kPa;辅助气(GS2)压力为60 kPa;电喷雾电压(IS)为-4.5 kV;去溶剂温度(TEM)为500 ℃;入口电压(EP)为-10 V;碰撞室出口电压(CXP)为-15 V。14种甜味剂的保留时间、监测离子对、碰撞电压(CE)和去簇电压(DP)见表1。
2 结果与讨论
2.1 质谱条件的优化
本研究比较了正离子和负离子模式下各物质的响应值,发现在负离子模式下目标物的响应值明显优于正离子模式。除三氯蔗糖外,其他物质均选择准分子离子作为母离子,然后选择两个子离子组成两个监测离子对,并对DP和CE进行优化。当三氯蔗糖以[M-H]-(m/z395.3)的准分子离子为母离子进行子离子扫描时,逐渐增加CE值也只能得到一个丰度较大的子离子(m/z359.3),即准分子离子再失去一分子HCl后得到的碎片。由于三氯蔗糖结构中含有3个氯原子,根据天然同位素分布规律,[M+2-H]-(m/z397.3)的同位素离子丰度与准分子离子丰度相当,所以选择m/z397.3>361.5作为另一个监测离子对。优化后的质谱参数见表1。

表 1 14种甜味剂的保留时间、监测离子对、碰撞电压和去簇电压Table 1 Retention times, monitoring ion pairs, collision energies (CE) and declustering potentials (DP) of the 14 sweeteners
* Quantitative ion.
2.2 色谱条件的优化
2.2.1色谱柱的选择
目前报道[14-18]的甜味剂的检测方法多使用C18色谱柱进行分离,但由于天然甜味剂的极性较强,在C18色谱柱上的保留效果并不好。因此本研究比较了Agilent ZORBAX SB-C18(150 mm×4.6 mm, 3.5 μm)和Waters XBridge Amide(150 mm×4.6 mm, 3.5 μm)两种色谱柱对甜味剂的分离效果。结果表明,当使用Agilent ZORBAX SB-C18色谱柱时,甜菊糖苷类甜味剂的保留效果和峰形均较差;当使用Waters XBridge Amide色谱柱进行分离时,14种甜味剂的分离度和峰形均较好,推测原因是Waters XBridge Amide色谱柱引入了酰胺基,使得其对强极性化合物有更强的保留能力。因此本实验最终选择Waters XBridge Amide色谱柱。

图 1 无机相中甲酸铵和乙酸铵对14种甜味剂峰高和信噪比的影响Fig. 1 Effect of ammonium formate and ammonium acetate in inorganic phase on peak heights and S/N of the 14 sweeteners Nos. 1-14 are the same as that in Table 1.
2.2.2流动相的选择
本研究还对流动相进行了考察和优化。结果表明,流动相中有机相为乙腈时比为甲醇时能获得更好的分离度和灵敏度。分别考察了采用不同无机相(10 mmol/L甲酸铵水溶液、10 mmol/L乙酸铵水溶液、0.1%(体积分数)甲酸水溶液和超纯水)时14种甜味剂的分离效果。当采用0.1%(体积分数)甲酸水溶液和超纯水时,14种甜味剂的色谱峰较宽,且峰拖尾严重;采用10 mmol/L甲酸铵水溶液和10 mmol/L乙酸铵水溶液时,大部分甜味剂的峰高相当,但信噪比前者明显高于后者(见图1)。因此本研究最终选择乙腈-10 mmol/L甲酸铵水溶液作为流动相进行分离。
在优化的条件下,14种甜味剂的提取离子色谱图见图2。可以看出,在甜菊双糖苷的提取离子色谱图中有一强度相当的峰,保留时间为6.76 min,与甜菊苷的保留时间一致,通过对比二者的结构可知,甜菊苷由甜菊双糖苷结构上的羧基与β-Glc基团缩合而来,故其在质谱电离时也容易丢失β-Glc基团,产生的碎片离子(m/z641.8)进一步解离成m/z为479.7的碎片离子,产生与甜菊双糖苷峰高相当的峰。类似的情况还有瑞鲍迪苷B,其提取离子色谱图中有与瑞鲍迪苷A保留时间一致的色谱峰。

图 2 14种甜味剂定量离子对的提取离子色谱图Fig. 2 Extract ion chromatograms of the quantitative ion pairs of the 14 sweeteners
2.3 方法学评价
2.3.1线性关系、检出限和定量限
在优化的条件下,配制14种甜味剂的系列混合标准溶液(1~1 000 μg/L),以峰面积(Y)为纵坐标、质量浓度(X, μg/L)为横坐标绘制标准曲线,得到的线性回归方程和相关系数(r2)见表2。根据3倍和10倍信噪比确定方法的检出限(LOD)和定量限(LOQ),结果见表2。可以看出,14种甜味剂在各自的范围内线性关系良好,相关系数均大于0.995。
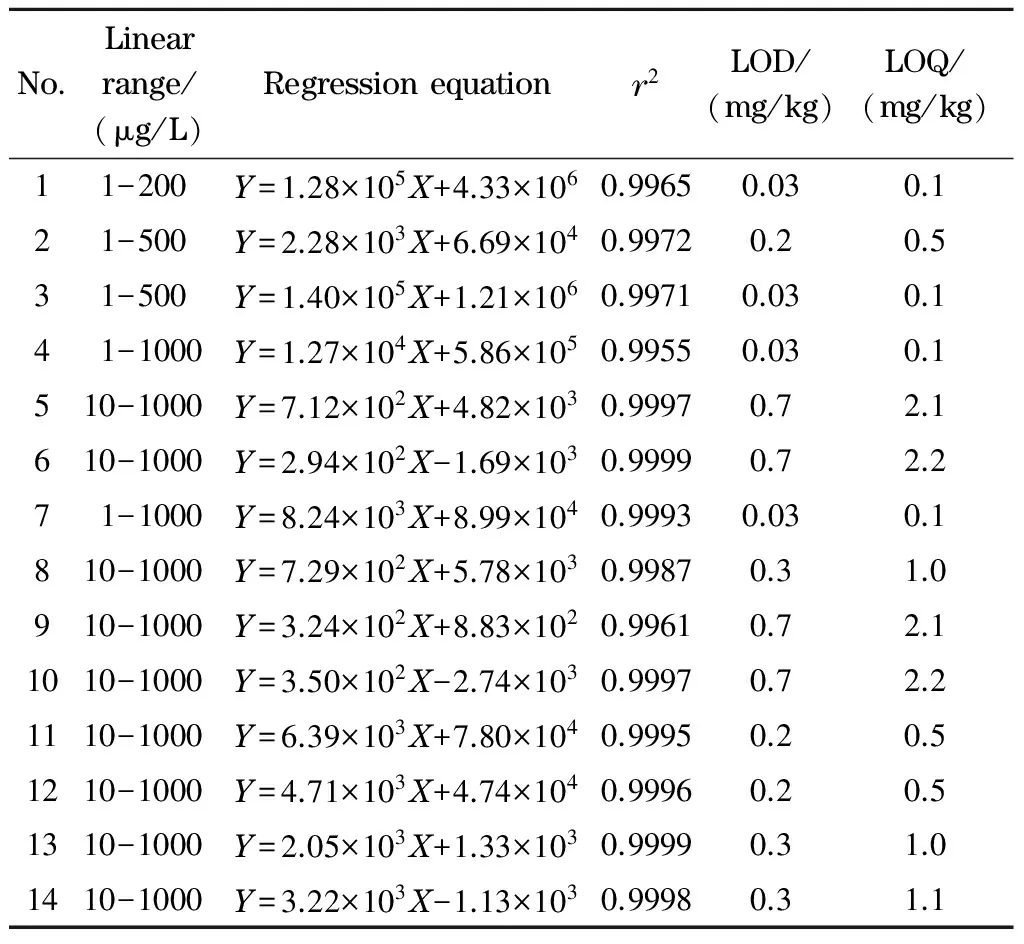
表 2 14种甜味剂的线性范围、回归方程、相关系数、检出限和定量限Table 2 Linear ranges, regression equations, correlation coefficients (r2), limits of detection and limits of quantification of the 14 sweeteners
Nos. 1-14 are the same as that in Table 1.Y: peak area;X: mass concentration, μg/L.
2.3.2精密度与回收率
在空白饮料样品中添加2、5和20 mg/kg 3个水平的混合标准溶液,经1.3节所述方法处理后,每个水平重复测定6次,得到方法的回收率和精密度,结果见表3。3个添加水平下14种甜味剂的平均回收率为80.8%~108.7%,相对标准偏差为1.5%~7.7%(n=6)。
2.4 实际样品测定
将方法应用于市场上购买的8种饮料和2种白酒中甜味剂的检测,有3种饮料样品中有甜味剂的检出,其中1种饮料中检出人工合成甜味剂三氯蔗糖,2种饮料中有天然甜味剂的检出,含量均符合GB 2760-2014的要求,详细结果见表4。
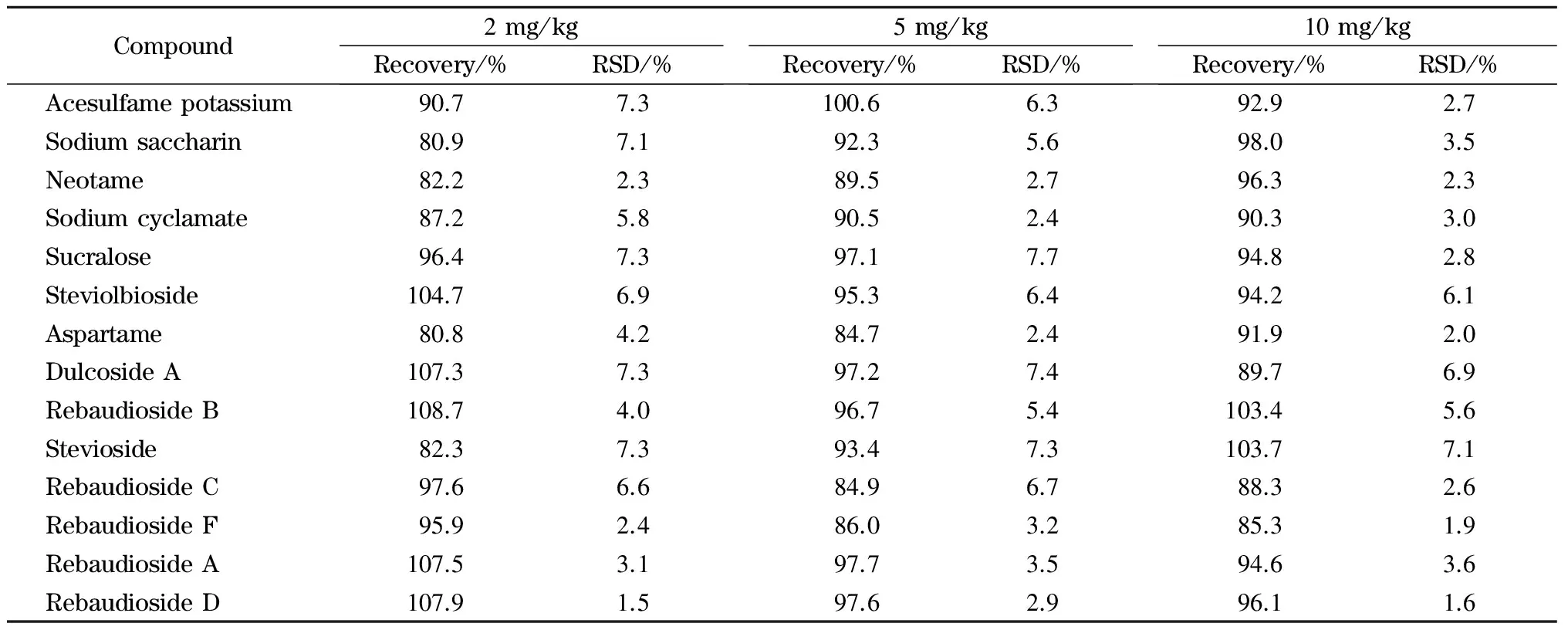
表 3 14种甜味剂的回收率和精密度(n=6)Table 3 Recoveries and precisions of the 14 sweeteners (n=6)

表 4 实际样品的测定结果Table 4 Detected results of the real samples
3 结论
本研究建立了亲水相互作用色谱-三重四极杆质谱检测饮料和白酒中14种甜味剂的分析方法。该方法样品前处理简单,分析速度快,精密度和灵敏度高,能够同时测定饮料和白酒等液体食品中14种甜味剂。该方法有望在食品甜味剂的检测中发挥重要作用。
参考文献:
[1] Yang D J, Chen B. J Agric Food Chem, 2009, 57(8): 3022
[2] Yang J, Wang J H, Liu J J, et al. Chemical Analysis and Meterage, 2013, 22(5): 100
杨君, 王建华, 刘靖靖, 等. 化学分析计量, 2013, 22(5): 100
[3] Liu Y, Wu S G, Yin Z, et al. China Food Additives, 2013(3): 233
刘英, 吴曙光, 尹州, 等. 中国食品添加剂, 2013(3): 233
[4] GB 2760-2014
[5] Chen T, Ding X J, Li Y Z, et al. Chinese Journal of Chromatography, 2014, 32(6): 666
陈桐, 丁晓静, 李一正, 等. 色谱, 2014, 32(6): 666
[6] Jiang Y X, Wei R X, Yang G Z, et al. Journal of Instrumental Analysis, 2009, 28(7): 838
蒋奕修, 魏瑞霞, 杨桂珍, 等. 分析测试学报, 2009, 28(7): 838
[7] Bergamo A B, da Silva J A F, de Jesus D P. Food Chem, 2011, 124(4): 1714
[8] Lorenzo R A, Pena M T, Fernández P, et al. Food Control, 2015, 47: 43
[9] Liu G, Lei J, Zhong H X, et al. Food Science and Technology, 2017, 42(7): 300
刘刚, 雷激, 钟红霞, 等. 食品科技, 2017, 42(7): 300
[10] Liu F, Wang Y, Wang Y H, et al. Chinese Journal of Chromatography, 2012, 30(3): 292
刘芳, 王彦, 王玉红, 等. 色谱, 2012, 30(3): 292
[11] Zhou W Q. Food Research and Development, 2017, 38(1): 161
周文清. 食品研究与开发, 2017, 38(1): 161
[12] Di Donna L, Mazzotti F, Santoro I, et al. J Mass Spectrom, 2017, 52(5): 290
[13] Kubica P, Namiesnik J, Wasik A. J Pharmaceut Biomed, 2016, 127: 184
[14] Sakai H, Yamashita A, Tamura M, et al. Food Addit Contam A, 2015, 32(6): 808
[15] Shah R, Farris S, De Jager L S, et al. Food Addit Contam A, 2015, 32(2): 141
[16] Niu Z R, Wang X J, Yu Y T, et al. Food Science, 2016, 37(2): 178
牛之瑞, 王秀君, 于毅涛, 等. 食品科学, 2016, 37(2): 178
[17] Zhou B, Lü R Y, Xiao L H, et al. Food Science, 2014, 35(12): 218
周彬, 吕任一, 肖丽恒, 等. 食品科学, 2014, 35(12): 218
[18] Ji C, Feng F, Chen Z X, et al. Chinese Journal of Chromatography, 2010, 28(8): 749
嵇超, 冯峰, 陈正行, 等. 色谱, 2010, 28(8): 749
[19] Chen X H, Zhao Y G, Yao S S, et al. Chinese Journal of Chromatography, 2011, 29(12): 1147
陈晓红, 赵永纲, 姚珊珊, 等. 色谱, 2011, 29(12): 1147
[20] McCalley D V. J Chromatogr A, 2017: 1523

