阀切换-离子色谱法测定1,2-环氧丁烷产品中有机酸
许竞早, 彭振磊, 张育红, 王 川, 金国杰(中国石化上海石油化工研究院, 上海 201208)
1,2-环氧丁烷(1,2-BO)是一种高端精细的化工中间体,可用作新型合成聚醚多元醇单体[1],还可用作环氧树脂的活性稀释剂、含氧化合物的保护剂等,在精细化工及石油化工中有着广泛的用途[2]。近年来,随着环氧化技术和分子筛催化剂的发展与应用,1-丁烯催化环氧化法生产1,2-BO的新工艺已成为当前的研究热点。1-丁烯催化环氧化法采用1-丁烯为原料,过氧化氢异丙苯为氧化剂,在硅钛分子筛催化剂的作用下,直接环氧化生成1,2-BO[1,3]。在过氧化氢异丙苯选择氧化丁烯制环氧丁烷反应过程中会产生少量的甲醇、醛等杂质,这些醇和醛会进一步氧化生成酸。微量酸的存在不仅影响产品的质量,也会对设备产生一定的腐蚀。1,2-BO产品中有机酸的存在会影响其作为聚醚单体的使用,最终影响聚合物的相对分子质量及产品质量。监测各批次产品之间有机酸的含量可以对生产过程的质量控制提供依据。因此,在生产1,2-BO产品的过程中定量测定和控制有机酸的含量非常关键。
有机酸常用的检测方法有比色法[4]、滴定法[5-7]、分光光度法[8]、液相色谱法[9,10]、毛细管电泳法[11,12]和离子色谱法[13-15]等。比色法、滴定法和分光光度法主要针对样品中的总酸进行测定,样品需要预处理,操作繁琐,并且无法对有机酸的形态进行甄别和定量。毛细管电泳法和液相色谱法目前已广泛用于有机酸的测定,采用液相色谱法时比较容易受干扰,分离效果及对多种样品的适应性不佳。毛细管电泳法需采用电解液,其配制过程较为繁琐,分析结果波动较大。离子色谱法也是测定有机酸的常用手段,具有简单、快速、灵敏等优点,但是对不溶于水的1,2-BO分析难度较大,如果直接进样,基体1,2-BO会掩盖有机酸的出峰,在线阀切换前处理技术较好地解决了高浓度基体中痕量待测物测定的问题。目前文献[16-21]报道的测试对象主要是水溶性较好的液体样品和易溶于水的固体样品,对于与水不能互溶的有机样品的测定鲜有报道。
本文采用乙醇对1,2-BO产品进行适当比例的稀释,改善其水溶性,同时结合阀切换技术在线消除有机基体的干扰,准确测定1,2-BO产品中有机酸。该方法简单、方便,可用于不溶于水的有机体系中有机酸的测定。
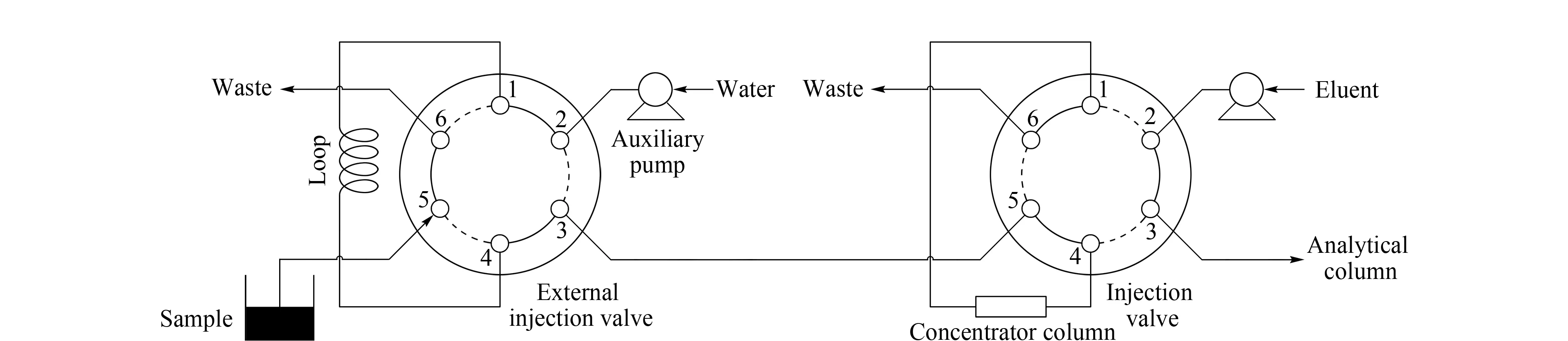
图 1 仪器结构示意图Fig. 1 Diagram of instrument structure
1 实验部分
1.1 仪器、试剂与材料
ICS-2100离子色谱仪、ASRS-4型电化学自再生抑制器、电导检测器、外置AXP-MS辅助泵、电磁十通阀(美国Thermo Fisher公司); Chromeleon色谱工作站。
甲酸铵、乙酸铵、丙酸钠(以上均为色谱纯)、乙醇(分析纯)均购自国药化学试剂有限公司。实验用水均为18.2 MΩ5cm的去离子水。1,2-BO产品(1号(日本TCI,纯度>99%), 2~4号(自产,纯度>99%))。
1.2 标准溶液的配制
精密称取适量甲酸铵、乙酸铵和丙酸钠,以乙醇为溶剂,配制不同质量浓度的甲酸根、乙酸根和丙酸根单标准溶液,用于制作标准曲线。用乙醇配制不同质量浓度的混合标准溶液,用于方法精密度的考察。
1.3 样品预处理
准确量取1.1节1,2-BO产品5 mL,加入乙醇5 mL,涡旋5 min,混匀。
1.4 色谱条件
色谱柱:IonPac AS11分析柱(250 mm×4 mm), IonPac AG11保护柱(50 mm×4 mm), IonPac TAC-ULP1超低压捕集柱(23 mm×5 mm);柱箱温度:30 ℃;淋洗液:KOH溶液;流速:1.5 mL/min;检测池温度:35 ℃;抑制器电流:112 mA;辅助泵流速:1.0 mL/min。梯度洗脱程序:1.0~10.0 min, 1.0 mmol/L; 10.0 min~20.0 min, 1.0 mmol/L~30 mmol/L; 20.0~25.0 min, 30 mmol/L。进样量:100 μL。
1.5 分析流程
阀切换系统由两套进样阀、两个泵、一根捕集柱以及一根分析柱组成(见图1)。外置进样阀上安装100 μL的定量环,样品通过注射器手动注入该定量环。离子色谱自带的进样阀(右侧)上安装IonPac TAC-ULP1超低压捕集柱(concentrator column),用来捕集待测样品中有机酸。待测组分在捕集柱捕集待测组分的同时,外置泵带动水冲洗捕集柱1.5 min(阀切换时间),使以分子状态存在的1,2-BO基体洗脱,而待测阴离子仍然保留在捕集柱上。然后系统切换至离子色谱自带的进样阀,使淋洗液(KOH)先通过捕集柱,将待测组分带入分析柱检测。
2 结果与讨论
2.1 溶解溶剂的选择
由于1,2-BO在水中的溶解度很小,在外置泵带动水和样品冲洗捕集柱时,样品不能和水充分混匀,造成每次基体消除效果不一致,导致样品测定结果重复性不佳。因此需选择合适的溶剂对1,2-BO进行适当稀释,以改善样品在水中的溶解性。
本实验选择乙腈、丙酮和乙醇作为溶剂溶解1,2-BO。结果表明,乙醇和基体1,2-BO的互溶性最好,且毒性最低,环境友好。因此选择乙醇作为溶剂对样品进行适当稀释,稀释比例为样品:乙醇=1∶1(v/v)。样品稀释后再通过涡旋的方法保证样品和乙醇充分混匀。
2.2 淋洗液的选择
OH-是强亲水性离子,易进入树脂亲水区,能同时分离与树脂亲和能力不同的阴离子,抑制产物为水,且电导率较低,因此本实验结合实验室现有条件,最终选用KOH作为淋洗液。
由于1,2-BO产品中有保留程度不同的多种阴离子存在,若采用等浓度淋洗会出现多种组分共流出的现象。故开始时选用较低的淋洗液浓度(1.0 mmol/L)以保证弱保留组分的分离,然后逐渐增加淋洗液浓度(1.0~30.0 mmol/L)以缩短强保留组分的分离时间。
2.3 阀切换时间的优化
进样后,有机酸被保留在捕集柱中,1,2-BO在捕集柱上不保留而直接洗脱至废液;待有机酸捕集完成后,淋洗液将捕集柱中的有机酸带至分析柱中检测。实验设置了不同的阀切换时间(0.5、0.75、1.0、1.5和2.0 min),考察捕集柱对有机酸根的捕集效率。实验发现:当阀切换时间为1.5 min时,各有机酸根含量最高,1,2-BO残留最少。因此将阀切换时间(捕集柱捕集时间)设为1.5 min。
2.4 捕集柱捕集效果的考察
选取甲酸根、乙酸根和丙酸根混合标准溶液,质量浓度分别为0.230、0.196和0.199 mg/L。采用阀切换技术或直接进样的形式进行分析,考察捕集柱的捕集效果(见表1)。从表1可以看出,通过阀切换,以IonPac TAC-UPL1为捕集柱时,其对乙酸根和丙酸根的捕集效果较好,捕集效率为97.6%和101.6%,对甲酸根的捕集效果略差,捕集效率为71.4%。可能原因如下:离子色谱法的分离机理是离子交换,是基于离子交换树脂上可解离的离子与流动相中具有相同电荷的溶质离子之间进行的可逆交换,根据这些离子对交换剂不同的亲和力而被分离。除离子交换过程外,对某些离子也存在与固定相的非离子相互作用。最重要的非离子相互作用是吸附[22],待测组分碳链越长,疏水作用越强,吸附能力越强,捕集效率越高。乙酸根和丙酸根的碳链相对于甲酸根更长,故捕集效率更高。

表 1 捕集柱对甲酸、乙酸和丙酸的捕集效果Table 1 Effect of concentrator column on formate, acetate and propionate
2.5 标准曲线和检出限
本方法采用外标标准曲线法定量,将1.2节配制的不同质量浓度的甲酸根、乙酸根和丙酸根单标准溶液依次进样,以峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线,其线性回归方程、相关系数(r)及线性范围,见表2。因丙酸根标准溶液的浓度范围较宽,为了避免使用一条标准曲线,使低浓度丙酸根测定误差较大,故丙酸根采用两条标准曲线。实验结果表明,各有机酸根离子都具有良好的线性关系,相关系数(r)均>0.999。本实验以色谱信号响应的信噪比(S/N)为3时的质量浓度确定方法的检出限),为0.23~4.80 μg/L(见表2)。

表 2 甲酸、乙酸和丙酸的回归方程、相关系数、线性范围和检出限Table 2 Regression equations, correlation coefficients (r), linear ranges and limits of detection (LODs)of the formic acid, acetic acid and propionic acid
y: peak area;x: mass concentration, mg/L.
2.6 精密度
选取甲酸根、乙酸根和丙酸根的质量浓度分别为0.230、0.196和0.199 mg/L的混合标准溶液1和质量浓度分别为0.921、0.785和0.993 mg/L的混合标准溶液2,用于方法精密度的考察。结果表明,3种离子峰面积的RSD值均小于5%。
2.7 加标回收率
为检验方法的准确性,选择2号1,2-BO产品进行3个不同加标水平的回收率试验,其分析结果及回收率结果见表3。结果表明,不同加标水平下3种离子的回收率为92.5%~111.8%,表明该方法符合分析要求。
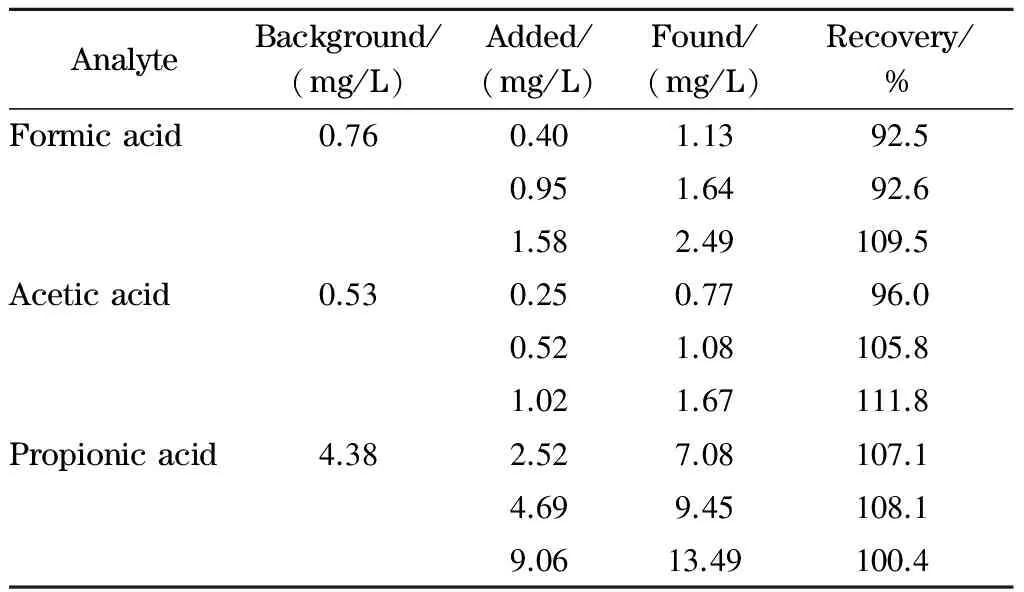
表 3 实际样品中甲酸、乙酸和丙酸的加标回收率(n=5)Table 2 Spiked recoveries of the formic acid, acetic acid and propionic acid in real samples (n=5)
2.8 样品测定
选择1号、3号和4号1,2-BO产品,按1.4节和1.5节所述进行操作,重复进样3次,计算样品中甲酸、乙酸和丙酸的含量(见表4)。可以看出,实际样品测定结果的重复性良好,RSD<5.6%。其中1号样品的色谱图见图2,保留时间8 min处的色谱峰为1,2-BO和溶剂乙醇的基体残留。

表 4 1,2-BO产品中甲酸、乙酸和丙酸的含量(n=3)Table 4 Contents of the formic acid, acetic acid and propionic acid in 1,2-butylene oxide (1,2-BO) products (n=3)

图 2 1,2-BO产品中3种有机酸的色谱图Fig. 2 Chromatogram of the three organic acids in a 1,2-BO product
3 结论
本研究建立了阀切换-离子色谱快速测定1,2-BO产品中有机酸含量的分析方法。该方法采用乙醇对样品进行稀释后直接进样,并通过阀切换技术实现了在线基体消除和待测有机酸的捕集。该方法前处理简单,有机试剂用量少,环境友好。该方法同时适用于不溶于水的有机体系中有机酸的分析。
参考文献:
吴美玲, 周灵杰, 陈玮娜. 聚氨酯工业, 2014, 29(2): 17
[2] Ma S Q, Li G, Wang X S. Petrochemical Technology, 2004, 33: 1614
马书启, 李钢, 王祥生. 石油化工, 2004, 33: 1614
[3] Gu W G, Hu S, Li M J, et al. Petrochemical Technology, 2016, 45(7): 834
辜乌根, 胡松, 李木金, 等. 石油化工, 2016, 45(7): 834
[4] Han Z J, Xu J, Wei X Z, et al. Chinese Agricultural Science Bulletin, 2016, 32(9): 194
韩助君, 许杰, 卫宣志, 等. 中国农学通报, 2016, 32(9): 194
[5] GB/T 12456-2008
《谢灵运传论》的“直举胸臆,非傍诗史”,其中“直举胸臆”同于第二例中邢邵“若胸臆语”,不同的是,一者是因“非傍诗史”而“直举胸臆”,一者则是因“用事不使人觉”而“若胸臆语”。沈约认为曹植、王粲等人“直举胸臆,非傍诗史”,却能够做到“讽高历赏”,是由于“音律调韵,取高前式”。显然,对沈约来说,“非傍诗史”能使诗文取得较高艺术成就,一般情况下是不可思议的,而曹植等人的某些作品能够做到,是以音律之美进行了弥补。这固然从正面说明了音律的重要性,却也从侧面说明了在通常情况下,用典对于诗文实乃不可或缺。
[6] Luo S X, Wu L, Liang Z Y, et al. Chemical Analysis and Meterage, 2007, 16(5): 53
罗盛旭, 吴良, 梁振益, 等. 化学分析计量, 2007, l6(5): 53
[7] Zhang H, Xia H L, Yang M N, et al. Pharmacy and Clinics Chinese Materia Medica, 2016, 7(3): 27
张慧, 夏厚林, 杨孟妮, 等. 中药与临床, 2016, 7(3): 27
[8] Niu J G, Liang X J, Liu X, et al. Chinese Journal of Applied Chemistry, 2010, 27(3): 342
牛金刚, 梁晓静, 刘霞, 等. 应用化学, 2010, 27(3): 342
[9] GB/T 5009.157-2003
[10] Jiang Y, Fan G F, Du R, et al. Chinese Journal of Chromatography, 2015, 33(8): 805
姜艳, 范桂芳, 杜然, 等. 色谱, 2015, 33(8): 805
[11] Peng Z L, Zhang Y H, Wang C. Chinese Journal of Analysis Laboratory, 2015, 34(7): 850
彭振磊, 张育红, 王川. 分析试验室, 2015, 34(7): 850
[12] Han H F, Wang Q, Liu X. Chinese Journal of Chromatography, 2012, 30(5): 538
韩海峰, 王庆, 刘霞. 色谱, 2012, 30(5): 538
[13] Chen A L, Ding H, Fang L M, et al. Chinese Journal of Chromatography, 2015, 33(12): 1333
陈爱莲, 丁卉, 方琳美, 等, 色谱, 2015, 33(12): 1333
[14] Shi C O, Yao B L, Hu M, et al. Chinese Journal of Chromatography, 2016, 34(10): 951
施超欧, 姚宝龙, 胡咪, 等, 色谱, 2016, 34(10): 951
[15] Song W D, Yuan X Y, Lü N, et al. Chinese Journal of Chromatography, 2016, 34(10): 1084
宋卫得, 袁晓鹰, 吕宁, 等. 色谱, 2016, 34(10): 1084
[16] Chen A L, Fang L M, Lü H X, et al. Chinese Journal of Chromatography, 2017, 35(5): 538
陈爱莲, 方琳美, 吕海霞, 等, 色谱, 2017, 35(5): 538
[17] Zhang T T, Wang N N, Ye M L, et al. Chinese Journal of Chromatography, 2013, 31(1): 88
张婷婷, 王娜妮, 叶明立, 等. 色谱, 2013, 31(1): 88
[18] Zhao X Y, Qu F, Mou S F. Chinese Journal of Chromatography, 2017, 35(3): 223
赵新颖, 屈锋, 牟世芬. 色谱, 2017, 35(3): 223
[19] Liu Y H, Zhang J H, Wang M L, et al. Chemical Analysis and Meterage, 2016, 25(4): 23
刘颖慧, 张经华, 王明林, 等. 化学分析计量, 2016, 25(4): 23
[20] Wu L T, Fang L, Huo Z J, et al. Chinese Journal of Analysis Laboratory, 2013, 32(11): 93
吴凌涛, 方丽, 霍柱健, 等. 分析试验室, 2013, 32(11): 93
[21] Yang Y L, He J, Huang Z P, et al. J Chromatogr A, 2013, 1305: 171
[22] Mo S F, Liu K N. Ion Chromatography Method and its Application. Beijing: Chemical Industry Press, 2000
牟世芬, 刘克纳. 离子色谱方法及应用. 北京: 化学工业出版社, 2000

