人参皂苷Rg1通过抑制Wnt/β-catenin通路促进退变人腰椎间盘髓核细胞的生长及胞外基质合成
鲁 花, 于 露, 甄欢欢, 刘汝银, 岳宗进
(河南中医药大学第二附属医院脊柱科, 河南 郑州 450002)
腰椎间盘突出是以椎间盘退变为主要特征的一种常见病、多发病,也是腰腿痛的重要起因之一[1]。由于腰椎间盘的组织再生能力有限,退变后较难逆转[2]。人腰椎间盘髓核细胞(human lumbar nucleus pulposus cells,HNPCs)是人体腰椎间盘髓核组织的唯一构成细胞,严重影响着腰椎间盘退变的发生和发展[3]。腰椎间盘退变可直接导致髓核细胞数量减少和细胞外基质(extracellular matrix,ECM)的合成减少[4]。人参皂苷Rg1(ginsenoside Rg1)作为传统中药人参的有效成分,具有促进海马神经发生、提高神经可塑性、抗衰老、提高免疫和辅助抗肿瘤等作用[5]。在体外,可通过细胞氧糖剥夺(oxygen-glucose deprivation,OGD)来模拟体内髓核细胞退变的微环境[6-7]。有报道证实,人参皂苷Rg1能通过抑制细胞凋亡保护脑部缺血再灌注损伤[8],提示其对病理损伤下的细胞具有一定的保护作用。但是,人参皂苷Rg1在HNPCs退变中是否也具有积极的保护作用尚不明确。因此,本文拟探究人参皂苷Rg1对退变HNPCs生长和ECM合成的影响,并进一步研究其可能的作用机制,以期为腰椎间盘突出患者的临床治疗在寻找新的药物靶点方面提供初步的实验依据。
材 料 和 方 法
1 试剂和材料
HNPCs购于ScienCell;DMEM培养基、胎牛血清和胰蛋白酶等均购于HyClone;人参皂苷Rg1购于中国食品药品鉴定研究院;LiCI购于Sigma;CCK-8试剂盒购于上海生工生物工程有限公司;Real-time PCR 试剂盒购于Invitrogen;引物合成由上海生工生物工程股份有限公司合成;Annexin V-FITC检测试剂盒购于Trevigen;Caspase-3活性试剂盒和Western blot所用抗体均购于Abcam;ECL发光试剂盒购自Amersham。
2 方法
2.1细胞培养和OGD模型的构建 HNPCs培养于含有10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养。当皿底细胞融合至80%时,用胰蛋白酶消化后按照3∶1的比例进行传代培养。构建HNPCs的OGD模型来模拟人体内的腰椎间盘髓核细胞的退变微环境,将HNPCs培养基换为无血清的无糖DMEM培养基,于1% O2/ 94% N2/ 5% CO2气体组分中培养 12 h。根据细胞分组,将LiCl以20 μmol/L 的浓度添加到培养基中用来激活Wnt/β-catenin信号通路。4 d左右第1次换液,每隔2 d换液1次,发现细胞开始贴壁后于光学显微镜下进行形态观察。
2.2Real-time PCR检测Ⅱ型胶原(collagen II)、聚集蛋白聚糖(aggrecan)和Ki67的mRNA水平 按照试剂盒说明书提取各组细胞总RNA。反转录合成第一链cDNA,collagen II的上游引物序列为5’-GCTCCCAGAACATCGCCTACC-3’,下游引物序列为5’-TGAACCTGCTATTGCCCTCT-3’;aggrecan的上游引物序列为5’-AGTCCTCAAGCCTCCTGTA-3’,下游引物序列为5’-CAGTGCTCGCCAGTGTAG-3’,β-actin的上游引物序列为5’-GGACTCGTCATACTCCTGCTTG-3’,下游引物序列为5’-GGAAATCGTGCGTGACATTAAG-3’。按照试剂盒的说明书进行PCR扩增,扩增条件为预变性94 ℃ 5 min;变性94 ℃ 1 min、退火60 ℃ 1 min、延伸72 ℃ 3 min,30个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测,依据2-ΔΔCt法计算各样本mRNA的相对表达量。
2.3Western blot检测collagen II、aggrecan和Wnt/β-catenin通路相关蛋白的表达 将各组细胞按照每孔4×105的密度接种于6孔板,24 h后换液,进行无血清培养基培养。24 h后采用BCA法进行蛋白定量,各取30 μL 样品进行SDS-PAGE,再将蛋白转移至膜上,5% 脱脂奶粉室温封闭 1 h,加入I 抗为鼠抗人的collagen II、aggrecan、β-catenin、c-Myc、cyclin D1 和β-actin(稀释比例均为1∶1 000),4 ℃ 孵育过夜。加入HRP标记的兔抗鼠 II 抗(1∶10 000)37 ℃ 孵育45 min,用 ECL液显影,使用化学发光试剂盒在化学发光系统检测,随后结果采用Image-Pro Plus 6软件(Media Cybernetics)分析,以待测蛋白与内参照β-actin的灰度值比值作为蛋白的相对表达量。
2.4CCK-8实验检测细胞活力 将各组细胞按照每孔2×105个的密度接种于96孔板中,用含10% 胎牛血清的DMEM培养基制成单细胞悬液,置于37 ℃、5% CO2的条件下培养。每组设5个复孔,待细胞长至80%融合时,分别于转染后24、48和72 h加入20 μL CCK-8溶液。培养24 h,于酶标仪490 nm处检测吸光度(A)值。取5孔A值的平均数,按照下列公式计算细胞相对活力:细胞相对活力(%)=处理组A/对照组A×100%。
2.5流式细胞术检测细胞凋亡 将各组细胞按照每孔4×105个的密度接种到6孔板,12 h后换液,进行24 h无血清培养基培养。预冷PBS洗涤,加入预冷75%乙醇,4 ℃固定4 h以上。离心弃上清,PBS洗涤后,加入500 μL Binding Buffer悬浮细胞。加入5 μL Annexin V-EGFP孵育15 min,再加入5 μL propidium iodide (PI)混匀。室温、避光、反应5~15 min。1 h内,在FC-500流式细胞仪上使用Beckman CXP软件检测细胞凋亡情况。
2.6Caspase-3试剂盒检测caspase-3活性 将各组细胞按照每孔2×105的密度接种于96孔板中,12 h后换液,进行24 h无血清培养基培养。按照说明书进行操作,比色法测定caspase-3活性,用分光光度计在405 nm处检测吸光度(A)值。
3 统计学处理
数据均采用SPSS 13.0统计软件进行统计学分析,以均数±标准差(mean±SD)表示。多组比较采用单因素方差分析,随后各组均数间的两两比较通过SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 正常HNPCs和退变HNPCs的形态观察
光镜观察结果显示,正常HNPCs培养4 d左右大部分细胞开始贴壁,细胞形态多以类圆形和短梭形为主,胞质丰富,突起呈现短而粗的特点;与HNPCs组相比,经过OGD模拟的退变HNPCs在6 d后才发现贴壁生长,细胞突起延长,形态为明显的长梭形,胞质减少且细胞生长滞缓,见图1。
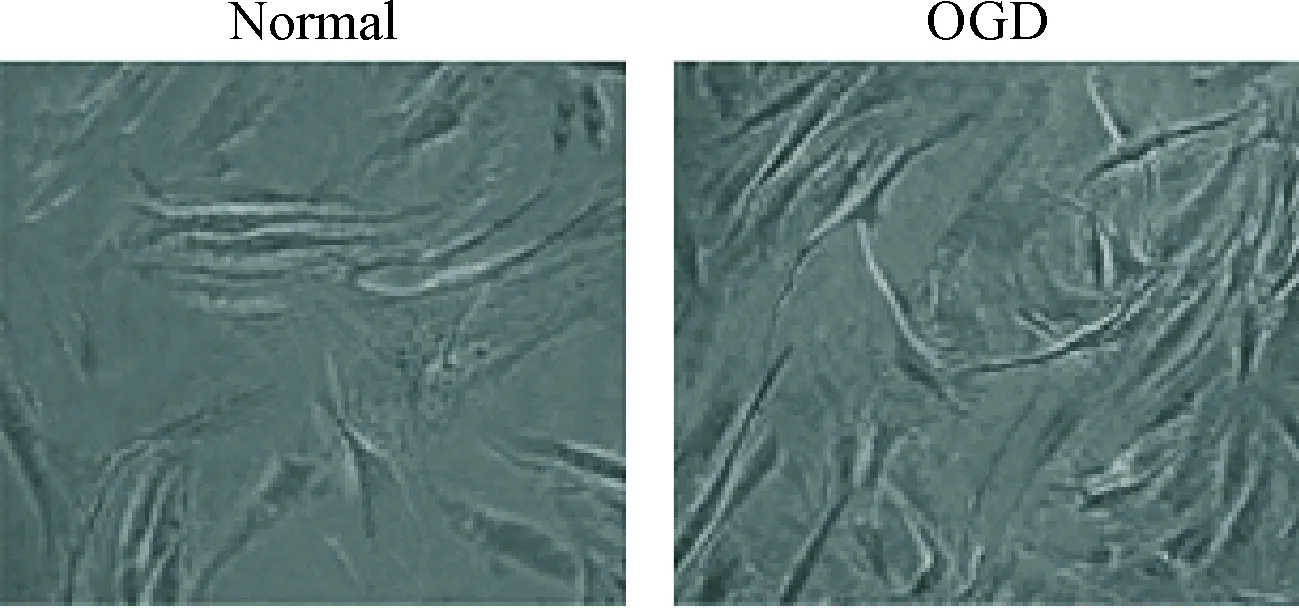
Figure 1. The morphological changes of normal HNPCs and degenerative HNPCs observed under optical microscope (×100).
图1正常和退变HNPCs的形态变化
2 人参皂苷Rg1促进退变HNPCs中collagen II 和aggrecan的表达
Real-time PCR结果显示,与HNPCs组相比,OGD组细胞中特异性标志物collagen II 和aggrecan表达均显著减少(P<0.05),而25 μmol/L、50 μmol/L和100 μmol/L人参皂苷Rg1可显著增加collagen II 和aggrecan表达(P<0.05)。Western blot结果同样显示,不同剂量人参皂苷Rg1均可增加OGD组细胞collagen II 和aggrecan的蛋白表达,高剂量的人参皂苷Rg1作用效果最为显著(P<0.05),提示其可促进OGD下细胞中ECM的合成,见图2。
3 人参皂苷Rg1增加退变HNPCs的活性
CCK-8检测结果显示,与HNPCs组相比,OGD组细胞活性明显降低,而25 μmol/L、50 μmol/L和100 μmol/L人参皂苷Rg1可明显升高OGD组细胞活性(P<0.05),见图3A。Real-time PCR结果显示,与HNPCs组相比,OGD组细胞中增殖标志蛋白Ki67的mRNA水平显著减少,不同剂量人参皂苷Rg1均可增加OGD组细胞Ki67的mRNA表达,高剂量的人参皂苷Rg1作用效果最为显著(P<0.05),见图3B。
4 人参皂苷Rg1减少退变HNPCs的凋亡
流式细胞术检测结果显示,与HNPCs组相比,OGD组细胞凋亡总数增加,而25 μmol/L、50 μmol/L和100 μmol/L人参皂苷Rg1可减少OGD组细胞凋亡比例(P<0.05),见图4A、B。Caspase-3试剂盒检测结果显示,与HNPCs组相比,OGD组细胞中的caspase-3活性显著升高,不同剂量人参皂苷Rg1均可降低OGD组细胞caspase-3活性,高剂量的人参皂苷Rg1作用效果最为显著(P<0.05),见图4C。

Figure 2. The mRNA and protein expression levels of collagen II and aggrecan were detected by real-time PCR and Western blot analysis. Mean±SD.n=6.*P<0.05vsHNPCs group;#P<0.05vsOGD group.
图2人参皂苷Rg1对退变HNPCs中collagenII和aggrecan表达的影响
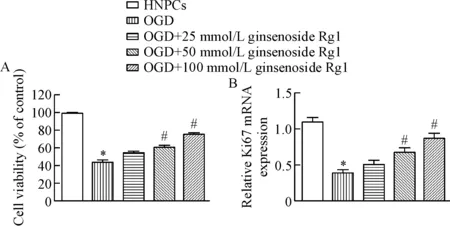
Figure 3. Effect of ginsenoside Rg1 on the viability of degenerative HNPCs.A: the cell viability was measured by CCK-8 assay; B: the mRNA level of Ki67 was detected by real-time PCR. Mean±SD.n=6.*P<0.05vsHNPCs group;#P<0.05vsOGD group.
图3人参皂苷Rg1对退变HNPCs活力的影响
5 Wnt/β-catenin信号通路在人参皂苷Rg1改善HNPCs退变中的作用
Western blot实验结果显示,与HNPCs组相比,OGD组细胞中β-catenin、c-Myc和cyclin D1蛋白均被显著激活,100 μmol/L人参皂苷Rg1可有效降低β-catenin、c-Myc和cyclin D1蛋白的表达,而给予Wnt/β-catenin信号通路激活剂LiCl可逆转人参皂苷Rg1发挥的下调作用(P<0.05),见图5A、B。同样的,在OGD组细胞中,LiCl可显著缓解人参皂苷Rg1引起的细胞活力增加、细胞凋亡比例减少及collagen II 和aggrecan表达升高(P<0.05),见图5C~F。
讨 论
人参是中国传统中草药,人参皂苷Rg1作为其主要的药效成分,被证实是相对安全和有效的药物,对正常的组织并无不良影响,因而被应用于治疗各种疾病[9]。人参皂苷Rg1药理作用广泛,特别是其可诱导多种肿瘤细胞的凋亡,在肿瘤的治疗方面具有较高的药用价值[10]。近期文献报道证实,人参皂苷Rg1可剂量依赖性改善大鼠的神经损伤症状,对受缺血再灌注损伤的大鼠脑部具有一定的保护作用[8]。已知体外细胞的OGD处理可模拟体内的缺血再灌注损伤[11-12],而且,体外OGD的HNPCs也可用来模拟退变HNPCs的微环境[6],因此,本文拟探讨人参皂苷Rg1是否对退变HNPCs有一定改善疗效。
首先,在体外培养HNPCs并构建OGD的HNPCs模型,光镜下观察细胞形态变化,证实OGD后的HNPCs细胞贴壁较晚,生长缓慢, 形态由类圆形变为长梭形,胞质明显减少,成功构建退变HNPCs模型,为后续实验研究奠定基础和依据。腰椎间盘退变可显著减少髓核细胞ECM的合成,而ECM主要由collagen II 和aggrecan构成[1]。本文实验证实,基质合成相关标志分子collagen II 和aggrecan在OGD处理的HNPCs中显著降低,而不同浓度的人参皂苷Rg1可明显增加 collagen II 和aggrecan的表达,提示人参皂苷Rg1可促进退变HNPCs的ECM合成。
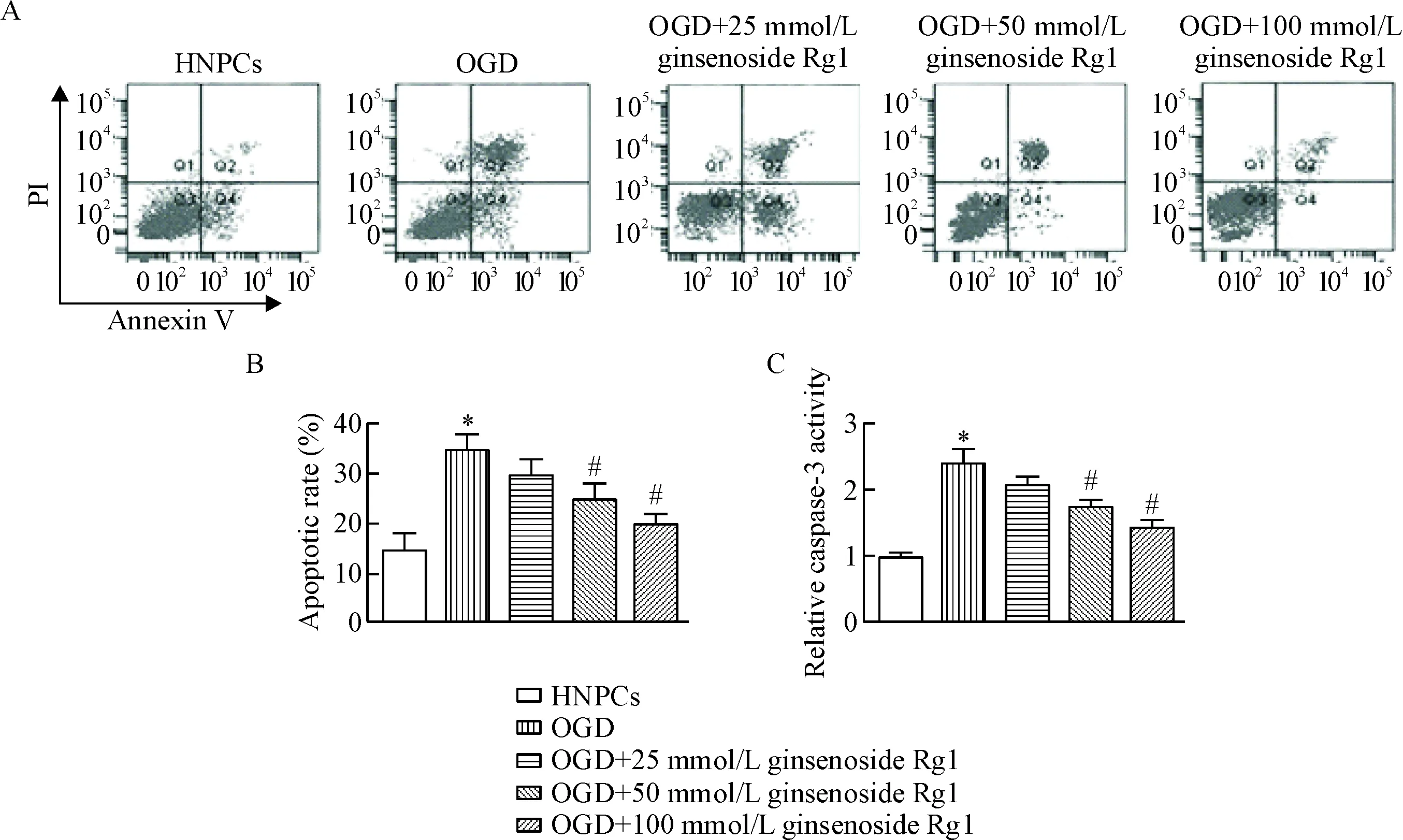
Figure 4. Effect of ginsenoside Rg1 on the apoptosis of degenerative HNPCs.A: the cell apoptosis was analyzed by flow cytometry; B: the quantitative analysis of A; C: the caspase-3 activity was measured by a caspase-3 analysis kit. Mean±SD.n=6.*P<0.05vsHNPCs group;#P<0.05vsOGD group.
图4人参皂苷Rg1对退变HNPCs凋亡的影响
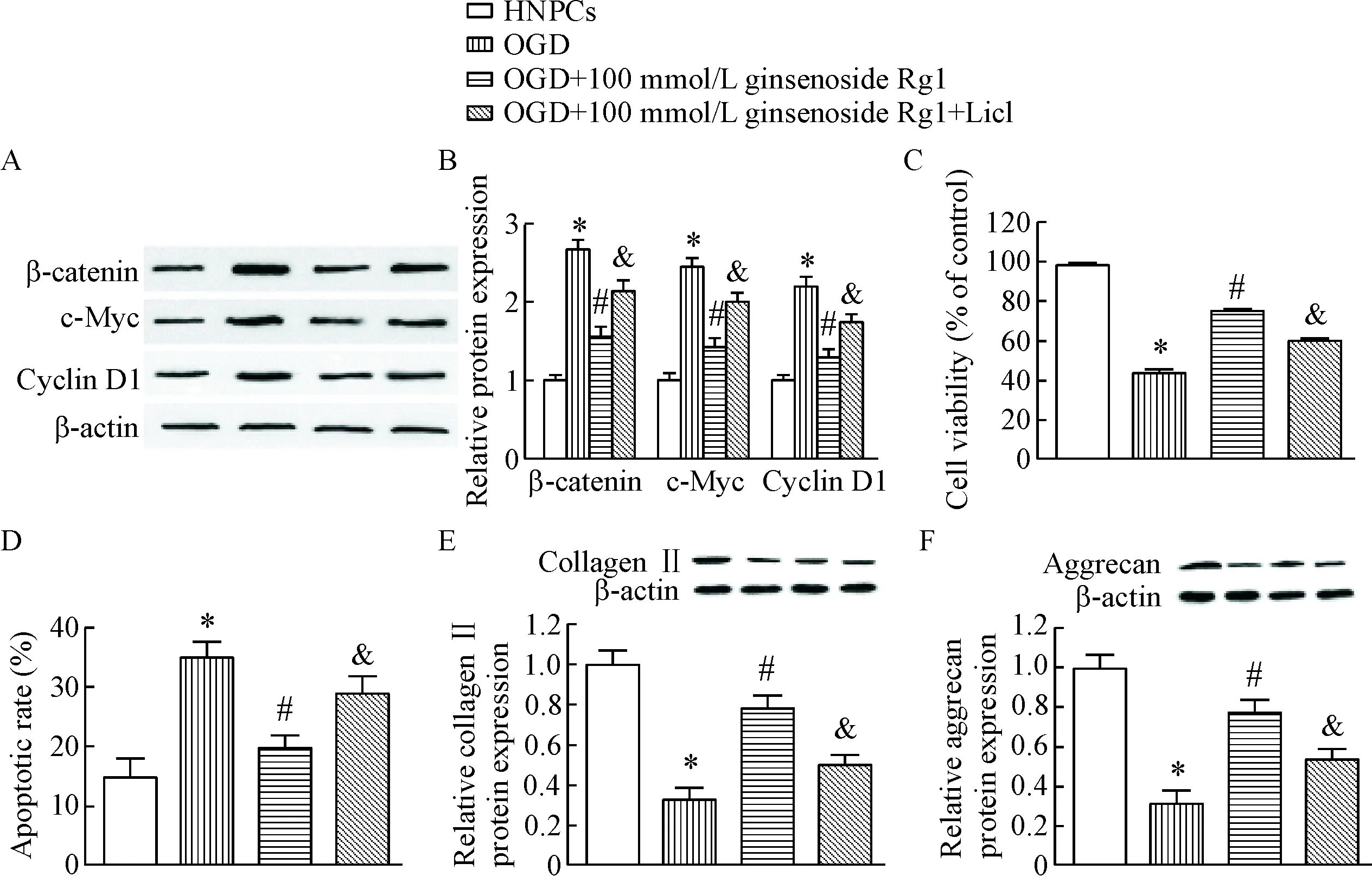
Figure 5. Role of Wnt/β-catenin pathway in the inhibitory effect of ginsenoside Rg1 on degeneration of HNPCs.A: the representative images of the Western blot for determining the protein levels of β-catenin, c-Myc and cyclin D1; B: the quantitative analysis of A; C: the cells activity was measured by CCK-8 assay; D: the cells apoptosis was analyzed by flow cytometry; E: the protein expression of collagen II was determined by Western blot; F: the protein expression of aggrecan was determined by Western blot. Mean±SD.n=6.*P<0.05vsHNPCs group;#P<0.05vsOGD group;&P<0.05vsOGD+100 μmol/L ginsenoside Rg1 group.
图5Wnt/β-catenin信号通路在人参皂苷Rg1抑制HNPCs退变中的作用
细胞的增殖和凋亡是判断细胞生长状况的根本指标,实验结果发现,人参皂苷Rg1可增加退变HNPCs的活力,且增加增殖蛋白Ki67的表达,显著促进退变HNPCs的增殖。同时,人参皂苷Rg1可减少退变HNPCs的凋亡,降低caspase-3的活性,显著抑制退变HNPCs的凋亡。这提示人参皂苷Rg1可有效促进退变HNPCs的生长,缓解其退变速度。
经典的Wnt/β-catenin信号通路是调控细胞生长、发育的关键途径[13-14]。有文献证实,激活的Wnt/β-catenin信号通路可引起椎间盘细胞的胞外基质分解,抑制HNPCs增殖,诱导HNPCs凋亡,引发细胞退变[15]。本实验表明,退变HNPCs中Wnt/β-catenin信号通路被激活,通路相关蛋白β-catenin、c-Myc和cyclin D1均表达上调,人参皂苷Rg1可显著下调通路蛋白的表达,而通路激活剂LiCl可显著扭转人参皂苷Rg1抑制的Wnt/β-catenin的活化。除此之外,LiCl也可减弱人参皂苷Rg1对退变HNPCs生长和ECM合成的影响。此结果提示,人参皂苷Rg1对退变HNPCs的生长和ECM合成的调控很可能是通过抑制Wnt/β-catenin信号通路而实现。
本文证实,人参皂苷Rg1可通过负向调控Wnt/β-catenin信号通路促进退变HNPCs的生长和ECM合成,从而有可能改善人腰椎间盘退变中髓核细胞的功能。因此,本研究将为延缓人腰椎间盘退变的治疗提供一个新的方向。
[参考文献]
[1] 顾海伦, 刘 莉, 王 欢, 等. Ad-BMP-2和Ad-TGF-β1共转染人退变椎间盘髓核细胞对细胞外基质代谢的影响[J]. 生物医学工程与临床, 2009, 13(1):58-61.
[2] 刘海飞, 王德春, 胡有谷. 椎间盘退行性变的生物学治疗研究进展[J]. 中华外科杂志, 2006, 44(4):284-287.
[3] 吴 畏, 章海均, 顾志谦, 等. 紫檀芪通过促进Nrf2核转移在调节髓核细胞炎症反应中的作用[J]. 中国细胞生物学学报, 2016, 38(10):1214-1221.
[4] 王大武, 胡侦明, 郝 杰, 等. 沉默信息调节因子2同源蛋白1通过Akt/PKB通路抑制人退变椎间盘髓核细胞凋亡[J]. 生物化学与生物物理进展, 2012, 39(6):563-573.
[5] 韩路拓, 任钧国, 杨佳妹, 等. 人参皂苷Rg1对高糖培养的心肌成纤维细胞Wnt信号通路的影响[J]. 北京中医药大学学报, 2014, 37(11):758-762.
[6] Liu J, Wang J, Zhou Y. Upregulation of BNIP3 and translocation to mitochondria in nutrition deprivation induced apoptosis in nucleus pulposus cells[J]. Joint Bone Spine, 2012, 79(2):186-191.
[7] 鲁 花, 于 露, 甄欢欢, 等. 骨形态发生蛋白9激活PI3K/Akt信号通路抑制退变髓核细胞的炎症反应和凋亡[J]. 第三军医大学学报, 2016, 38(18):2047-2052.
[8] 王巧云, 刘 凤, 吴峰阶, 等. 人参皂苷Rg1对局灶性脑缺血再灌注损伤大鼠海马p-ERK1/2与p-JNK表达的影响[J]. 中国中西医结合杂志, 2013, 33(2):2229-2234.
[9] 杨 逸, 杨丽瑛, 戴景峰, 等. 人参皂苷Rg1药理活性的研究进展[J]. 时珍国医国药, 2012, 23(12): 3121-3123.
[10] 赵保胜, 刘 洋, 徐暾海, 等. 人参皂苷Rg1对人胃癌BGC-823的抑制作用研究[J]. 中国临床药理学与治疗学, 2011, 16(4):361-365.
[11] Sang GH, Shim J, Choi EJ. CIIA negatively regulates neuronal cell death induced by oxygen-glucose deprivation and reoxygenation[J]. Mol Cell Biochem, 2014, 397(1):139-146.
[12] 刘 晶, 陈 曼, 董瑞瑞, 等. Ghrelin在脑缺血再灌注损伤后神经修复过程中的作用和机制[J]. 中国病理生理杂志, 2015, 31(10):1861.
[13] 朱将虎. 经典Wnt/β-catenin信号通路在神经干细胞增殖和分化中的作用[J]. 重庆医学, 2016, 45(34):4858-4860.
[14] 张应花, 邓晓慧, 王中平, 等. 丙戊酸孤独症大鼠脑中经典Wnt信号通路的变化[J]. 中国病理生理杂志, 2014, 30(8):1394-1399.
[15] 杜立龙, 徐宝山, 杨 强. 椎间盘退变信号转导机制的研究进展[J]. 中国脊柱脊髓杂志, 2013, 23(12):1119-1122.

