高效液相色谱-串联质谱法测定多种食品基质中的黄曲霉毒素
徐潇颖, 刘 柱, 朱炳祺, 梁晶晶, 陈万勤, 罗金文
(浙江省食品药品检验研究院,浙江杭州 310052)
黄曲霉毒素(Aflatoxins,AFT)是一种由黄曲霉和寄生曲霉等真菌经过聚酮途径产生的次生代谢产物[1],常见于发霉的粮食和其他富含有机物的霉变物体表面。天然产生的AFT中较为常见的有AFT B1、B2、G1、G2和M1[2]。其中,AFT B1毒性最强,是氰化物的10倍,砒霜的68倍[4],且具有很强的致突变、致畸和致癌作用,被世界卫生组织确定为1A级危险物。因此,世界各国都对进口农产品和食品中的AFT的最大允许限量(MRL)做出严格规定[4]。对于样品基质中的AFT,一般先利用溶剂对目标物进行萃取,而后进一步对提取液进行净化,以减少杂质含量,排除基质对分离和检测的干扰。王岩松等[5]将Oasis HLB萃取小柱用到谷物中AFT B1、B2、G1、G2和M1的净化,平均回收率在74.6%~89.6%之间;吴燕等[6]利用MycosepTM226多功能净化柱对食品中AFT净化富集,回收率可达到86.7%~97.2%;Taherimaslak等[7]则利用磁性Fe3O4纳米粒子键合三甲氧基硅烷作为固相萃取剂,对牛奶中AFT M1进行检测。而免疫亲和层析主要是基于抗原抗体特异性结合的原理,因此具有较高的灵敏度和良好的特异性,是目前我国现行国家标准推荐的方法之一。
目前AFT检测方法常见的为薄层色谱法[8]、液相色谱法[0 - 10]以及液-质联用法[11 - 12]。采用液-质联用法检测AFT,不仅具有高的灵敏度,同时可以使前处理更简单,实现多组分同时分析。本文通过高效液相色谱-串联质谱对不同食品基质中的AFT进行测定,考察不同基质及不同净化方式对AFT回收率的影响,为不同基质中AFT测定时净化方式的选择提供依据。
1 实验部分
1.1 仪器与试剂
XR30AD液相色谱仪(日本,Shimadzu公司);QTrap5500三重四极杆串联质谱仪(美国,AB SCIEX公司);Keference Skit Milli-Q超纯水器(美国,Millipore公司);Turbo Vap LV氮气吹干仪(Biotage(上海)有限公司);QT-1涡旋混合器(上海琪特公司);Seven Excellerce酸度计(瑞士,Mettler Toledo公司)。
黄曲霉毒素(AFT)B1、B2、G1、G2均购自美国Supelco公司:其中B1、G1的浓度为1 μg/mL,B2、G2的浓度为0.3 μg/mL。AFT B1、B2、G1和G2混合标准工作液:准确吸取各标准储备液1.00 mL于10 mL容量瓶中,稀释至刻度,充分振荡混匀后得到混合标准工作液。黄曲霉毒素B1-13C17购自英国Biopure公司;甲醇、乙腈(德国Merck公司)和甲酸(美国Fluka公司)均为色谱醇;多壁碳纳米管(MWCNTs)(纯度>97%,直径20~40 nm,长度>5 μm;深圳市纳米港科技有限公司),磁性碳纳米管(mMWCNTs)制备过程为利用浓HNO3羧化后磁化[13]。实验过程中用水为超纯水仪制得。
1.2 仪器条件
1.2.1色谱条件色谱柱为ACQUITY UPLC BEH C18柱 (50×2.1 mm,1.7 μm);流速:0.35 mL/min;柱温:35 ℃;进样量:2 μL;流动相(A)为甲醇∶乙腈=1∶1(V/V);(B)为0.1%甲酸水溶液。梯度洗脱程序:0~1 min,15%B;1~7 min,15%~80%B;7~10 min,80%~15%B。
1.2.2质谱条件离子源:电喷雾离子源,正离子扫描;扫描方式:多重反应监测;电离电压:5 500 V;离子源温度:500 ℃;气帘气流速:30 L/min;碰撞气流量:5 L/min;化合物定性离子对、定量离子对、锥孔电压、碰撞能见表1。
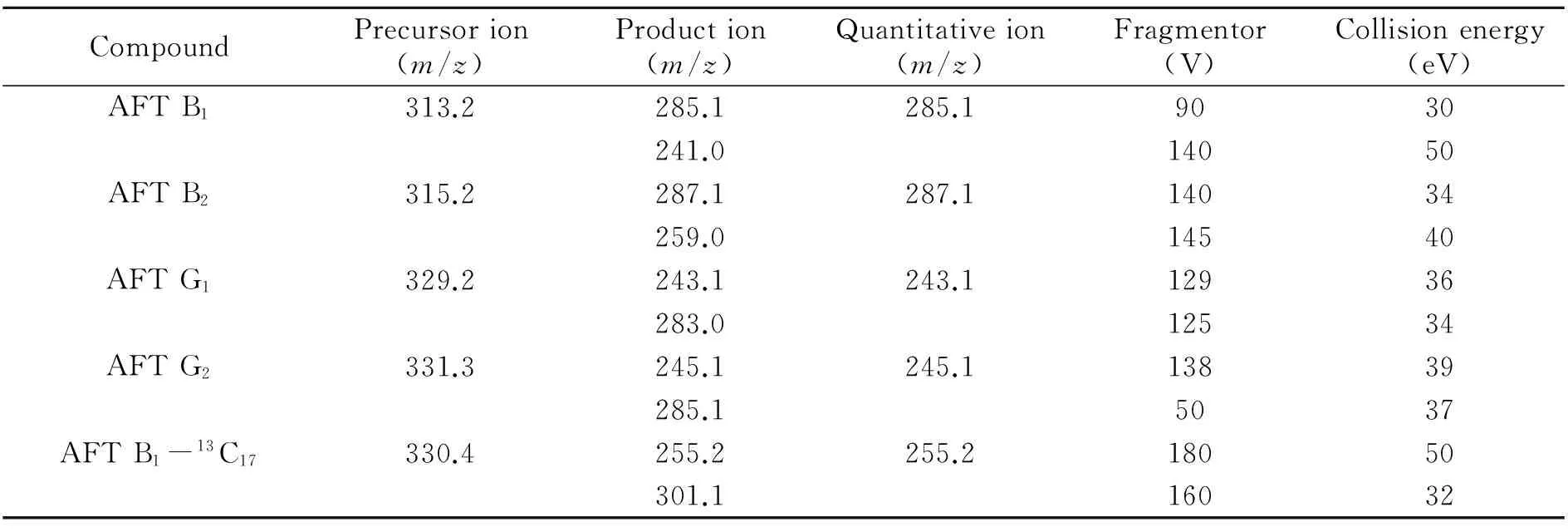
表1 MRM模式下黄曲霉毒素的质谱条件
1.3 样品前处理
1.3.1提取准确称取经过充分粉碎均匀的试样5.0 g,置于50 mL具塞塑料离心管中,精确移取40 mL乙腈∶水=80∶20(V/V),充分振荡混匀3 min,10 000 r/min离心5 min。
1.3.2净化免疫亲和柱和Waters Oasis HLB固相萃取(SPE)柱净化:取上述提取液3.0 mL于50 mL塑料离心管中,加入纯水至40 mL,以4~5 mL/min的速度全部通过免疫亲和柱,抽真空30 s。然后准确加入4.0 mL甲醇洗脱,收集全部洗脱液于5 mL玻璃试管中,用氮气吹至近干。准确加入1.0 mL初始比例流动相,充分振摇混匀30 s,转移至进样小瓶中,待测。多功能净化柱Mycosep-226和Mycosep-228:移取8~10 mL提取液通过多功能净化柱后,精确移取3.0mL滤液至5 mL玻璃试管中,用氮气吹至近干,准确加入1.0 mL初始比例流动相,充分振摇混匀30 s,转移至进样小瓶中,待测。Oasis Prime-HLB SPE柱净化:准确移取5~6 mL提取液,直接通过Prime-HLB SPE柱,收集滤液于5 mL玻璃试管中,准确移取3.0 mL滤液用氮气吹至近干,准确加入1.0 mL初始比例流动相,充分振摇混匀30 s,转移至进样小瓶中,待测。磁性碳纳米管净化:取上述提取液3.0 mL于50 mL塑料离心管中,加入纯水至40 mL后,加入一定量磁性碳纳米管,超声1 min后,涡旋提取30 min,用磁铁吸附磁性碳纳米管,除去上清液。再加入2 mL 甲醇∶乙腈=1∶1(V/V)的洗脱溶液,超声1 min后,涡旋30 min后,收集洗脱液于5 mL玻璃试管中,用氮气吹至近干,准确加入1.0 mL初始比例流动相,充分振摇混匀30 s,转移至进样小瓶中,待测。
1.4 加标回收和精密度实验
向未检出AFT B1、B2、G1和G2的大米样品中,分别加入0.1、0.2、0.5 mL 3个浓度水平的AFT(0.1 μg/mL 的AFT B1、G1和0.03 μg/mL的AFT B2、G2)标准溶液,得到AFT B1、G1浓度为2.0、4.0、10.0 μg/kg,AFT B2、G2浓度为0.6、1.2、3.0 μg/kg的加标试样,进行加标回收试验,每个浓度3份平行,计算加标回收率和精密度。
2 结果与讨论
2.1 磁性碳纳米管净化条件的优化
实验对磁性碳纳米管的投加量、提取溶剂以及洗脱溶剂进行优化。结果发现20、40、60、80 mg 4个不同添加量下,目标物的回收率并无显著变化,故确定20 mg为磁性碳纳米管投加量;在酸性(pH=4.0)条件下进行提取,碱性(pH=12.0)有机溶剂进行洗脱可以获得较好的回收率,回收率在60.3%~67.6%之间。而使用AFT B1-13C17进行内标法计算后,回收率可达到95%以上。相比于传统的SPE柱净化,磁性碳纳米管成本较低,提取、净化过程操作也简便。
2.2 不同净化方式下黄曲霉毒素的回收率与精密度
以大米为基质,分别采用多功能净化柱Mycosep-226、Mycosep-228、免疫亲和柱、Waters Oasis HLB SPE小柱、Oasis Prime-HLB SPE柱、磁性碳纳米管6种净化方式,考察三个加标浓度水平下的黄曲霉毒素的回收率,结果如图1。在6种净化方式中,免疫亲和柱在4种黄曲霉毒素的三个浓度水平下的回收率在95.2%~102.8%之间,要优于其它几种净化方式。主要是由于免疫亲和柱利用了抗体对毒素的特异性吸附,所以能专一性吸附提取液中的黄曲霉毒素。而在6种净化方式中,mMWCNTs净化方式虽然已进行优化,但回收率依然只有60.3%~67.6%,主要是目标物在提取过程中未像填充柱可进行多次交换吸附,造成了部分目标物在提取过程中的损失,但此方法成本低且操作过程相较于其他柱净化无需严格控制过柱速率。

图1 不同净化方式下黄曲霉毒素的回收率与精密度Fig.1 Recovery and precision of aflatoxin under different purification methods
2.3 不同基质中黄曲霉毒素的回收率与精密度
分别在玉米粉、大米及食用油中进行相同水平加标后进行回收率测定,结果如表2。在不同基质中,6种净化方式所测得的回收率大体呈相同趋势,其中都以免疫亲和柱最佳,回收率在86.1%~102.8%之间,Prime-HLB采用通过式净化技术也能够获得较好回收,而磁性碳纳米管回收率在58.4%~66.2%之间,但采用内标法后该方法仍可对黄曲霉毒素进行有效测定。而对于不同的基质,食用油中黄曲霉毒素的测定回收率要低于另两种基质,考虑油中存在脂类物质,对柱回收存在影响,因此相比于免疫亲和柱,通过式的Prime-HLB、多功能净化柱Mycosep-226、Mycosep-228的回收率差异较小。从不同黄曲霉毒素方面分析,Mycosep-226对AFT G2的回收效果要优于其它3种黄曲霉毒素;而免疫亲和柱及Prime-HLB对不同黄曲霉毒素回收效果相近,在同时测定4种黄曲霉毒素时可选用这两种净化柱。
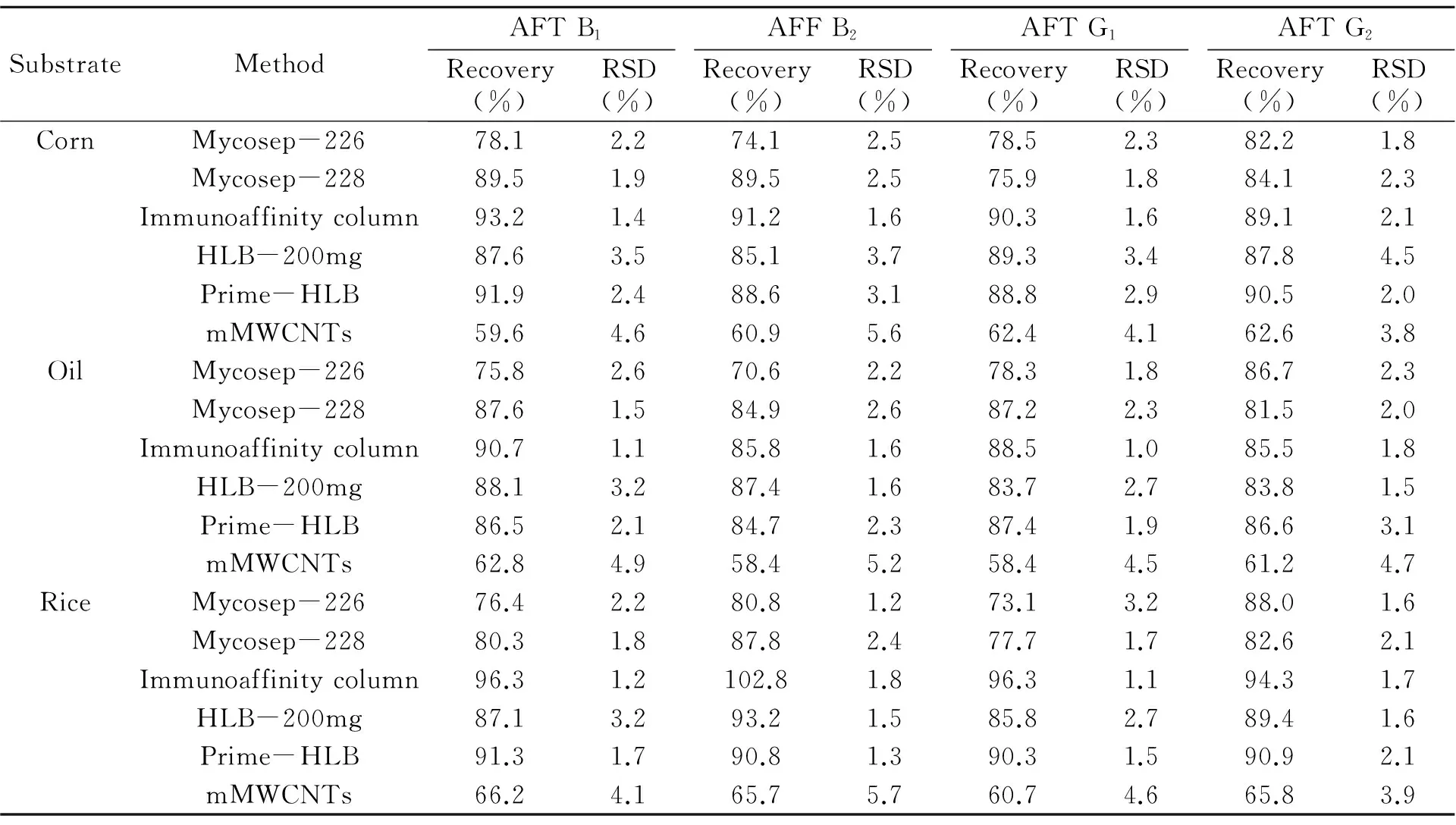
表2 不同基质中黄曲霉毒素的回收率与精密度(n=3)
2.4 不同基质中黄曲霉毒素的基质效应
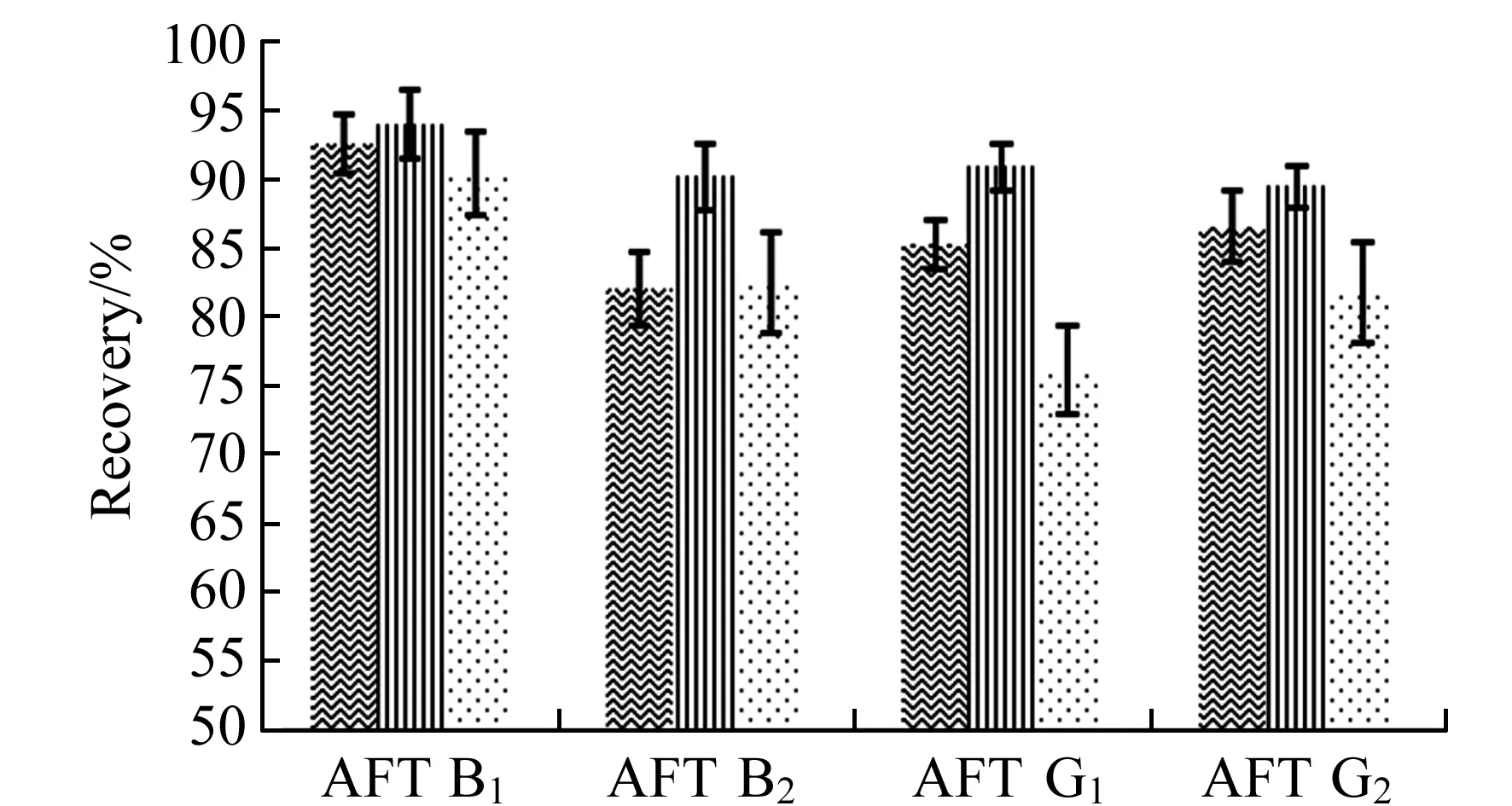
图2 不同基质中黄曲霉毒素的基质效应Fig.2 Matrix effects on detection of aflatoxin in different substrates
液相色谱具有较好的特异性,但越来越多的数据表明液相色谱-串联质谱普遍存在基质效应[14]。本文中选择Prime-HLB进行净化处理后,按照Matuszewski等[15]的建议,比较基质效应(ME)=不同来源的样品基质提取后添加/纯标准品溶液,采用中浓度点加标条件,每个样品进行5次平行测定,实验结果如图2。以大米、玉米粉及食用油为基质的ME<100%,说明三者对黄曲霉毒素均存在基质抑制效应,其中大米与玉米粉的基质抑制效应较小,分别在89.4%~93.9%、82.0%~92.5%,而食用油的基质效应76.1%~90.4%。主要是由于食用油中存在磷脂,磷脂对电喷雾电离产生离子抑制作用[16]。一般对基质效应的消除多采用同位素内标法,该方法不但可抵消质谱离子化时的基质效应,还可以消除前处理过程中的差异。
3 结论
本实验探索黄曲霉毒素净化的新方法,比较6种净化方式对黄曲霉毒素的回收效果,发现免疫亲和柱利用抗原抗体的特异性吸附作用,在不同基质及不同加标水平下获得的回收率都高于其他5种净化方式;磁性碳纳米管作为净化新方法,其绝对回收率在58.4%~66.2%,而加入内标进行回收率计算时,则回收率可达到90%以上,该方法较其它柱净化方式具有成本低和操作简便的优势。而不同基质中黄曲霉毒素存在的基质抑制效应也是影响液相色谱-串联质谱法准确测定黄曲霉毒素因素之一。
参考文献:
[1] WANG R X,ZHANG W,LI S G,et al.Cereals & Oils(王瑞鑫,张微,李书国,等.粮食与油脂),2016,12(1):62.
[2] LIU D M,CAO C,ZU J Y,et al.Journal of Food Safety & Quality(刘冬梅,曹成,俎建英,等.食品安全质量检测学报),2016,5(7):1920.
[3] Shyu R H,Shyu H F,Liu H W,Tang S S.Toxicon,2002,40(3):255.
[4] MA L.Study on Detection Technology for Determination of Aflatoxin B1with High Sensitivity.Chinese Academy of Agricultural Sciences(马良.黄曲霉毒素B1高灵敏度检测技术研究.中国农业科学院),2007.
[5] WANG Y S,FAN S H,LI H F,et al.Chinese Journal of Analysis Laboratory(王岩松,范世华,李华锋,等.分析试验室),2011,(10):63.
[6] WU Y,ZHU Y P,WANG G Q.Chinese Journal of Health Laboratory Technology(吴燕,朱怡平,汪国权.中国卫生检验杂志),2011,21(8):1865.
[7] Amoli-Diva M,Taherimaslak Z,Allahyari M,Pourghazi K,Manafi M H.Talanta,2015,134:98.
[8] LIU Q F.China Tropical Medicine(柳其芳.中国热带医学),2006,6(2):246.
[9] ZHU P F,LIU W W,LING X,et al.Journal of Food Safety and Quality(朱鹏飞,刘文卫,凌霞,等.食品安全质量检测学报),2016,5(7):1798.
[10] CHEN H L,CAI D R.Journal of Analytical Science(陈海铃,蔡端容.分析科学学报),2015,31(5):705.
[11] PENG K N,WANG Y X.Journal of Analytical Science(彭康年,王远兴.分析科学学报),2012,28(3):303.
[12] WANG S M,XU Y,MAO D,et al.Chinese Journal of Pharmaceutical Analysis(王少敏,许勇,毛丹,等.药物分析杂志),2011,31(5):907.
[13] XU X Y,LUO J W,CHEN W Q,et al.Journal of Instrumental Analysis(徐潇颖,罗金文,陈万勤,等.分析测试学报),2017,(1):61.
[14] Kaczyński P.Food Chemistry,2017,230:524.
[15] Matuszewski B K,Constanzer M L,Chavez-eng C M.Analytical Chemistry,2003,75:3019.
[16] Little J L,Wempem F,Buchanan C M.J Chromatogr B,2006,833(2):219.

