碳纳米管芹菜素印迹聚合物的制备及应用
丁 佳, 吕莎平, 刘跃进, 吴志民, 李勇飞, 潘浪胜
(湘潭大学化工学院,湖南湘潭 411105)
芹菜素作为一种天然黄酮类化合物,因其独特的药理功能和生物活性被广泛地应用于药物研究中,研究表明芹菜素具有抗氧化[1]、抗炎[2]、抗肿瘤[3]和抑制癌细胞的生长[4]等作用。另外,芹菜素还与能Bcl-2在心肌细胞缺氧/复氧损伤中发挥重要作用[5]。因此,研究芹菜素的提取分离与应用具有十分重要的意义。
分子印迹技术是一种基于分子印迹聚合物(MIPs)对特定目标化合物的选择吸附作用[6 - 7]的技术。多壁碳纳米管(MWCNTs)作为一种新型的高强度碳纤维材料,具有机械性能好、电学性能强和稳定性高等优点[8]。研究表明在碳纳米管表面接枝MIPs是可行的[9 - 10],这种新型的材料MWCNTs-MIPs,既有碳纳米管超强的力学性能和电学性能,又有MIPs专一选择识别性能,使得分子印迹点位完全暴露在基质表面,克服了空间位阻的影响,提高分子印迹材料的选择吸附效率。同时,以碳纳米管为微固相萃取材料的固相萃取技术的专一性较强[11 - 13]。
本文以羧基化多壁碳纳米管为基材,结合分子印迹技术,以芹菜素作为模板分子,成功制备了一种基于碳纳米管的新型印迹复合材料(MWCNTs-MIPs),并通过扫描电镜(SEM),傅里叶变换红外(FT-IR)光谱和比表面积分析(BET)对该材料进行表征。另外,对聚合物的静态吸附性能与选择性进行研究,同时还对固相萃取方法进行了重现性研究。
1 实验部分
1.1 主要仪器和试剂
PerkinElmer Series200高效液相色谱仪(PerkinElmer);DF-10型集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);KQ220E型数控超声波清洗器(昆山市超声仪器有限公司);RE-200旋转蒸发仪(上海雅荣生化设备仪器有限公司);DZ-CII真空干燥箱(上海贤德实验仪器有限公司)。
芹菜素(陕西慧科植物开发有限责任公司);羧基化碳纳米管(内径:20~30 nm;长度:10~30 μm,北京德科岛金科技有限公司);偶氮二异丁腈(AIBN,天津市大茂化学试剂厂);乙二醇二甲基丙烯酸酯(EGDMA,阿拉丁试剂有限公司);氯化亚砜、丙烯酰胺(AM)(天津市科密欧化学试剂开发中心);二甲基甲酰胺(DMF,广东汕头市西陇化工厂)。试剂均为分析纯,实验用水为蒸馏水。
1.2 碳纳米管印迹材料的制备
1.2.1MWCNTs-CH=CH2的制备参照文献方法[14],称取0.45 g MWCNTs-COOH溶解于50 mL氯化亚砜中,超声15 min后加热回流搅拌24 h。待反应结束后,采用减压蒸馏法回收二氯亚砜,得到目标产物MWCNTs-COCl。再将产物MWCNT-COCl和1.2 g AM溶于100 mL DMF中,超声15 min后,于25 ℃ 下回流搅拌24 h。待反应结束后冷却至室温,真空抽滤,得到粗产物。然后分别用0.12 mol/L HCl和蒸馏水洗涤至中性,70 ℃真空干燥过夜,得MWCNTs-CH=CH2。
1.2.2纳米管芹菜素分子印迹聚合物的制备称取0.1081 g芹菜素和0.1139 g AM,溶解于80 mL丙酮中,超声30 min,然后加入0.2 g的 MWCNT-CH=CH2,继续超声20 min并静置1 h,使模板分子与功能单体充分反应。然后依次加入1.58 g交联剂EGDMA和20 mg AIBN。通氮气20 min后,于60 ℃恒温搅拌反应24 h。待反应结束冷却至室温,真空抽滤后,收集滤液采用减压蒸馏法回收丙酮。滤饼用乙醇反复洗涤,以除去未参与反应的模板分子、功能单体、交联剂等杂质。
初洗后的滤饼装于索氏提取器中,以甲醇-乙酸混合液(9∶1,V/V)作洗脱剂,回流提取24 h后,洗去模板分子,然后用蒸馏水洗涤至中性。将得到的产物于80 ℃下真空干燥24 h。非印迹材料(MWCNT-NIPs)的制备除不加模板分子外,其它步骤均与上述相同。
1.3 聚合物的静态吸附性能实验
为了研究多壁碳纳米管芹菜素分子印迹聚合物的吸附性能,考察了振荡时间对吸附容量的影响。具体步骤如下:分别称取8等份20 mg的MWNT-MIPs和MWCNTs-NIPs,加入到10 mL 0.2 mmol/L的芹菜素乙醇溶液中,然后放入恒温箱中分别振荡10、30、60、90、200、300、400和500 min,取上层清液,微孔滤膜过滤后用高效液相色谱法(HPLC)测定芹菜素的浓度,平行测定三次,取平均值。计算其对芹菜素的吸附容量Q;Q=(c0-c) ×V/m,式中Q表示聚合物的吸附容量(mmol/g);c和c0分别表示芹菜素的初始浓度和吸附后上清液中芹菜素的浓度(mmol/L);V表示溶液的体积(mL);m表示质量(g)。绘制吸附动力学曲线。
1.4 选择性吸附实验
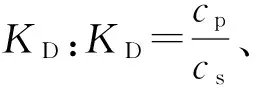
1.5 印迹聚合物固相萃取
称取50 g MWCNTs-MIPs,采用干法装入带有筛板的固相萃取柱中,上端用玻璃棉封堵。首先,选用1 mL芹菜素无水乙醇溶液上样,对不同体积分数的乙醇溶液的淋洗液进行了优化,筛选出最佳体积分数的淋洗液;然后取溶于乙醇的芹菜提取物溶液上样,先用最佳体积分数的乙醇溶液淋洗,再用无水乙醇作为洗脱液进行洗脱,用HPLC法进行分析。
1.6 HPLC检测条件
色谱条件:Diamonsil C18柱(250×4.6 mm,5 μm;迪马科技有限公司);流动相:甲醇-0.5%的磷酸溶液(70∶30,V/V);流速:1 mL/min;检测波长:348 nm;柱温:室温。
精密称取5.4、16.2、27.0、37.8、54.0 mg芹菜素,以无水乙醇为溶剂,配制体积为200 mL,浓度分别为0.1、0.3、0.5、0.7、1.0 mmol/L的芹菜素标准溶液。HPLC法检测进样量均为6 μL。
2 结果与讨论
2.1 扫描电镜(SEM)表征
采用SEM分别对MWCNTs-COOH、MWCNT-CH=CH2、MWCNTs-MIPs和MWCNTs-NIPs进行形貌表征。从图1可以看出,MWCNTs-COOH呈单一的纳米管状或小的束状,管径大约为20 nm。同样在放大20倍下,MWCNTs-CH=CH2均匀变大,这表明双键已经均匀接枝在碳纳米管上。从MWCNTs-MIPs和MWCNTs-NIPs的SEM图中可看出,经过接枝修饰的MIPs和NIPs管径都均匀增大,但两者相差不大,约为30~40 nm。与图1(B)比较可知,MWCNTs-MIPs的管径大于MWCNT-CH=CH2的管径,这说明聚合物已经均匀的接枝在碳纳米管表面,印迹层厚度为10~20 nm。

图1 MWCNTs-COOH(A)、MWCNTs-CH=CH2(B)、MWCNTs-MIPs(C)和MWCNTs-NIPs(D)的扫描电镜(SEM)图Fig.1 SEM images of MWCNTs-COOH(A),MWCNTs-CH=CH2(B),MWCNTs-MIPs(C)and MWCNTs-NIPs(D)
2.2 红外光谱分析
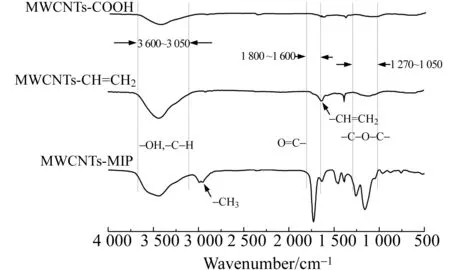
图2 MWCNTs-COOH、MWCNTs-CH=CH2和MWCNTs-MIPs的红外光谱图Fig.2 Infrared spectra of MWCNTs-COOH,MWCNTs-CH=CH2 and MWCNTs-MIPs
图2为MWCNTs-COOH、MWCNTs-CH=CH2和MWCNTs-MIPs的红外光谱图。从图2中可以看出,MWCNTs-COOH的红外光谱图的吸收峰最少,这是因为它含有较简单的有机结构。在MWCNTs-COOH、MWCNTs-CH=CH2和MWCNTs-MIPs的红外图谱中,3 050~3 600 cm-1处有较宽的弥散吸收峰,这是-OH和C-H吸收峰叠加所致。在MWCNTs-CH=CH2的红外谱图中,1 628 cm-1处出现一个双键的特征吸收峰;而MWCNTs-MIPs的红外谱图中,1 455~1 600 cm-1附近出现苯环骨架振动吸收峰,800~1 000 cm-1间是-(CH2)n-的摇摆振动峰,2 800~3 000 cm-1处是 -CH3的特征峰,1 270~1 050 cm-1处是-C-O-C-的振动吸收峰;此外,1 730 cm-1处的是酯羰基吸收峰,强度明显增强,这是由于MWCNTs-MIPs高分子层是EGDMA和AM共聚而来。以上结果说明MIPs被成功接枝到MWCNTs上,形成对芹菜素具有独特识别功能的MWCNTs-MIPs。
2.3 比表面积分析
采用比表面分析(BET)测定了MWCNTs-MIPs和MWCNTs-NIPs的比表面积、孔径和总孔容。由表1可知,MWCNTs-MIPs的比表面积、总孔容都大于MWCNTs-NIPs,由于提供了较大的空间,因此更有利于模板分子的吸附,并且吸附容量要大于传统方法合成的印迹聚合物。
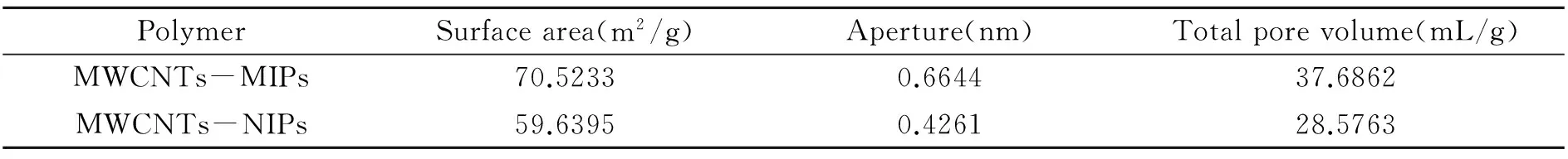
表1 MWCNTs-MIPs和MWCNTs-NIPs的BET表征结果
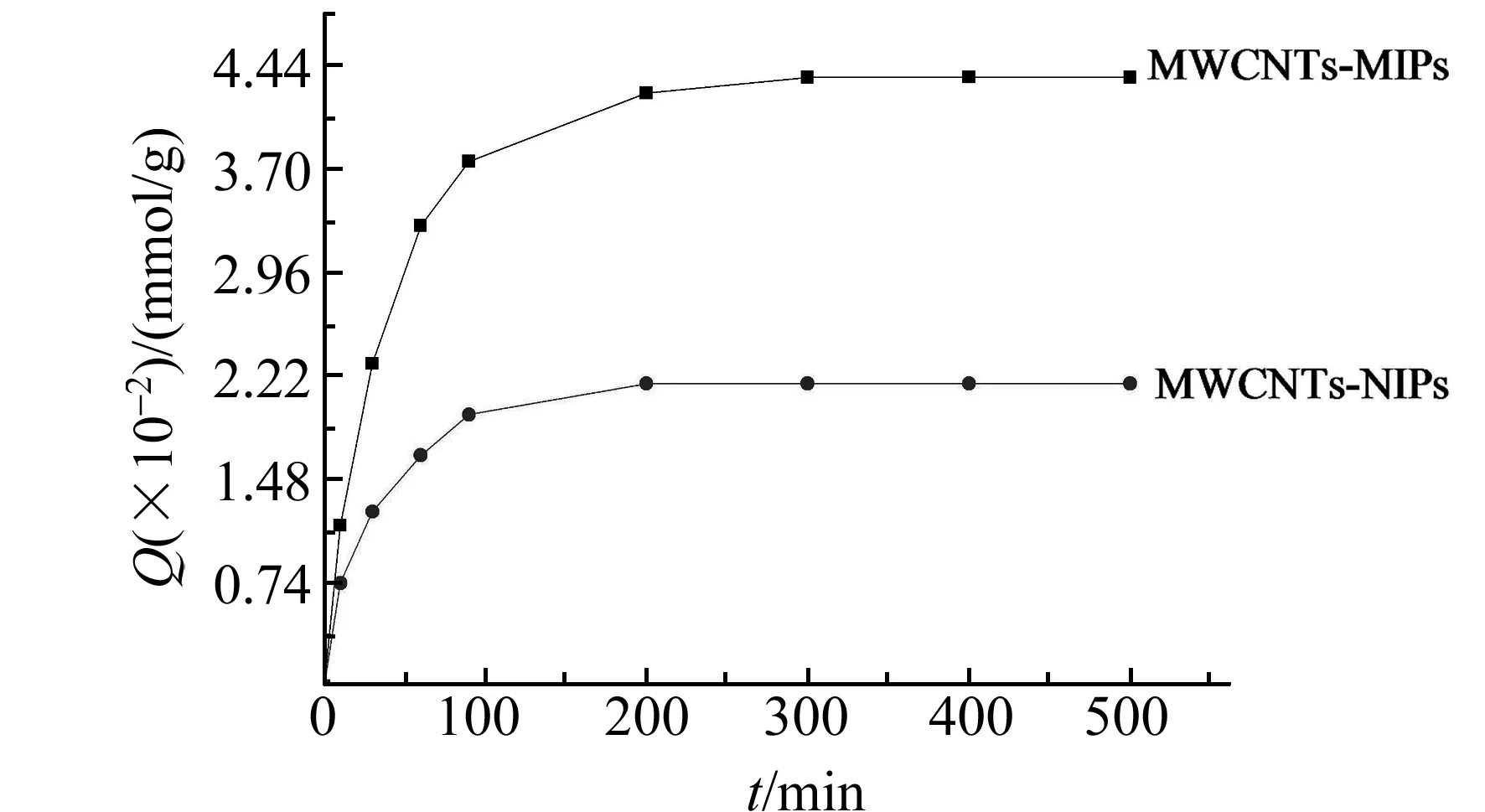
图3 MWCNTs-MIPs和MWCNTs-NIPs的吸附动力学曲线Fig.3 Adsorption kinetics of MWCNTs-MIPs and MWCNTs-NIPs
2.4 模板分子对印迹聚合物吸附性能的影响
图3是MWCNTs-MIPs及MWCNTs-NIPs的吸附动力学曲线。从图中可以看出,MWCNTs-MIPs在前20 min内吸附容量迅速增加,在200 min时已基本达到平衡。而MWCNTs-NIPs的吸附容量100 min达到最大。这是由于MWCNTs-MIPs 的孔穴由芹菜素分子所印迹,生成较大的孔穴有利于模板分子的传质,因此在吸附实验开始时呈现出较快的吸附速率。但随着时间的增加,当MWCNTs-MIPs表面的识别位点被结合以后,由于其向MWCNTs-MIPs孔穴的传质有一定的空间位阻使吸附速度逐渐下降。而MWCNTs-NIPs中由于不存在与模板分子结构相对应的有序排列的立体孔穴,因此它主要是通过非模板聚合物表面的非特异性吸附作用来吸附芹菜素,所以很快就能达到吸附平衡。
2.5 印迹聚合物的选择性能
由表2可知,MIPs对芹菜素产生了较为明显的印迹效果,而对其结构类似物木犀草素的吸附性相对较差。这是由于在聚合过程中,以芹菜素为模板分子,使得MIPs中存在与芹菜素结合的功能基团,同时也留下了与芹菜素的立体结构能互补的特殊空穴,这些均使得MIPs对芹菜素有着特殊的识别性能。由此可见,MWCNTs-MIPs对模板分子芹菜素有着较好的选择性吸附性能。
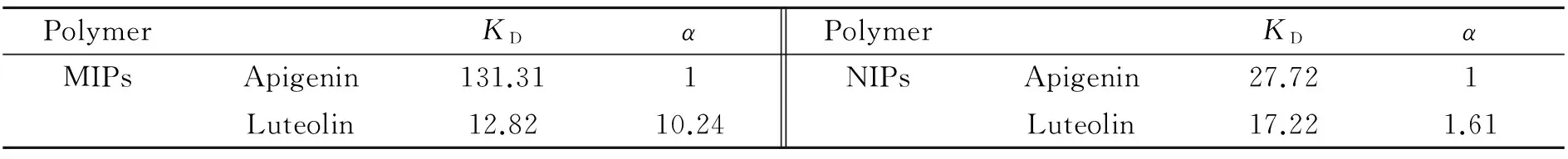
表2 MWCNTs-MIPs和MWCNTs-NIPs的选择性系数
2.6 淋洗液的优化
在淋洗的步骤中,考虑到乙醇极性较大、溶解性能好,能够溶解较多的非特异吸附的杂质,因此我们采用了不同体积分数的乙醇溶液(50%、25%和10%)进行淋洗液的筛选。结果表明,当采用10%的乙醇溶液作为淋洗液时,淋洗效果最好,它能有效地除去杂质而保留芹菜素。
2.7 芹菜提取物中芹菜素的固相萃取
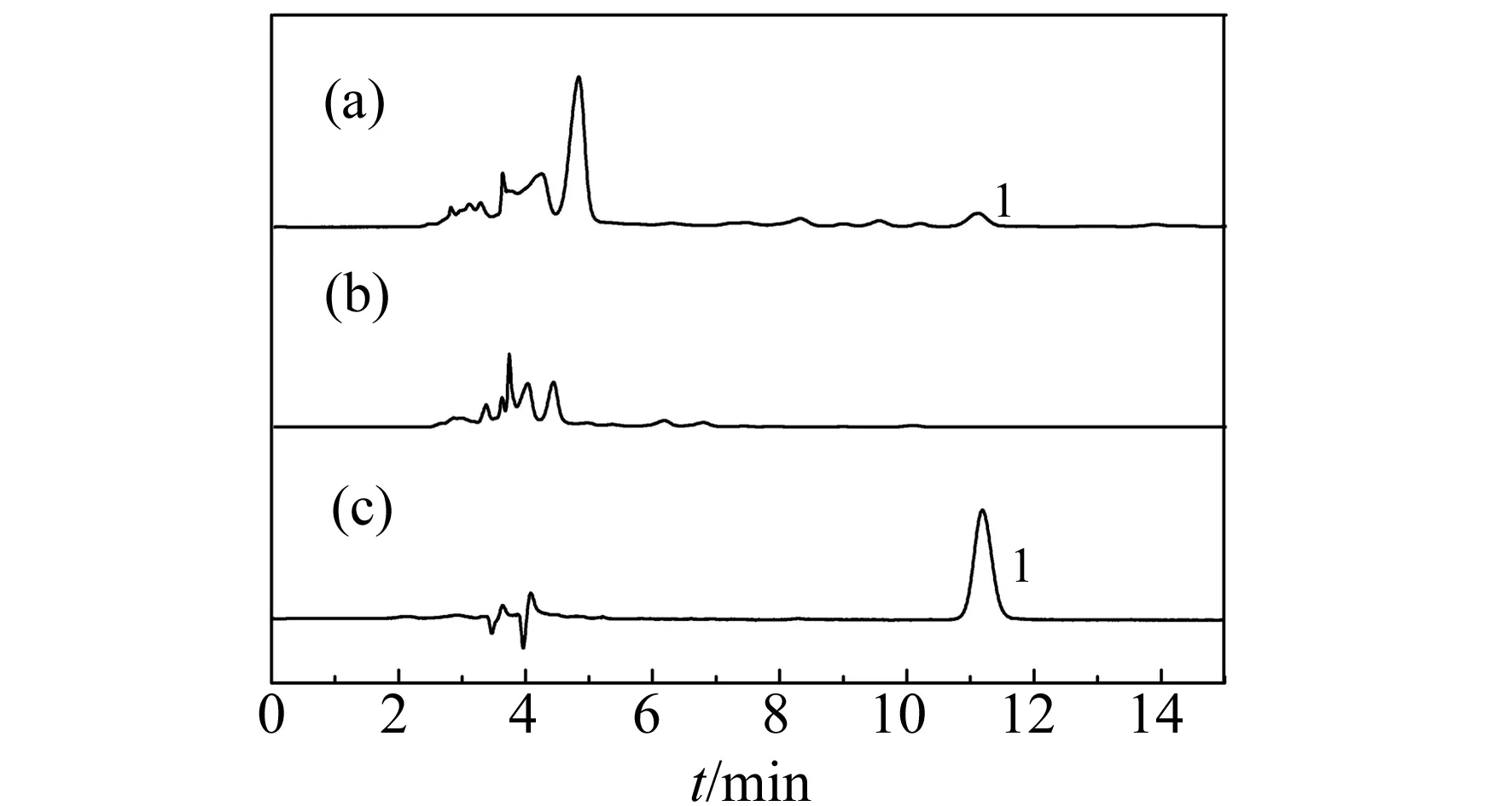
图4 芹菜提取液的色谱图Fig.4 Chromatograms of celery extracts1-apigenin;(a)extracts of celery;(b)leachate;(c)eluent.
取1 mL芹菜提取液的无水乙醇溶液上样后,先用10%乙醇溶液淋洗,再用无水乙醇作为洗脱液进行洗脱,每1 mL收集一次洗脱液,然后进行HPLC法分析,芹菜提取物的色谱图如图4所示。结果表明,经10%乙醇溶液淋洗和经无水乙醇洗脱的固相萃取操作后,洗脱液中芹菜素的含量有所提高,芹菜素得到有效纯化和富集。
2.8 印迹聚合物固相萃取方法的重现性
为了研究碳纳米管分子印迹聚合物固相萃取方法的重现性,碳纳米管分子印迹聚合物固相萃取1次后,按照上述操作条件重复操作5次,其样品纯度和回收率见表3。由表3可知,碳纳米管分子印迹聚合物重复操作5次,分离效果基本不变,能使芹菜素的纯度由0.53%提高至90.93%,回收率可达到95.84%,对芹菜素有较好的分离富集效果,富集因子高达171.6。
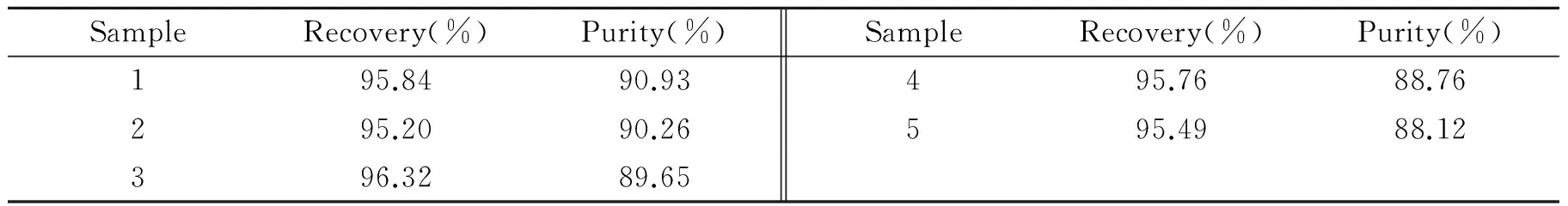
表3 固相萃取方法重现性(n=5)
3 结论
本文成功制备了一种基于碳纳米管的新分子型印迹复合材料(MWCNTs-MIPs),并通过SEM、FT-IR和BET对聚合物进行表征。MWCNTs-MIPs对芹菜素呈现出较强的吸附能力和选择识别能力,其吸附容量远大于MWCNTs-NIPs。对芹菜提取物进行了固相萃取研究,结果表明该技术具有良好的重现性,对芹菜素富集因子高达171.6,为芹菜素的分离富集提供了一条新的途径。
参考文献:
[1] Romanova D,Vachalkova A,Cipak L,et al.Neoplasma,2000,48(2):104.
[2] Jeong G S,Lee S H,Jeong S N,et al.International Immunopharmacology,2009,9(12):1374.
[3] Lee S H,Ryu J K,Lee K Y,et al.Cancer Letters,2008,259(1):39.
[4] REN H Y,TANG X W.Journal of Zhejiang University(Medical Sciences)(任环宇,唐修文.浙江大学学报)(医学版),2011,5:508.
[5] ZHOU M,YOU J Z,HE H,et al.Chinese Parmacological Bulletin(周敏,游嘉振,何欢,等.中国药理学通报),2015,1:122.
[6] HU Y Y,XU H Q,YAO J,et al.Chinese Journal of Analytical Chemistry(胡艳云,徐慧群,姚剑,等.分析化学),2014,2:227.
[7] XIAO S J,LI H X,YU S W.Chemical Industry and Engineering Progress(肖淑娟,李红霞,于守武.化工进展),2010,2:293.
[8] HU X,CHENG Z.Chinese Journal of Chemical Engineering(胡翔,程昭.中国化学工程学报),2015,9:1551.
[9] ZHANG H C,LIU G Y,SHANG J,et al.Chinese Journal of Analytical Chemistry(张洪才,刘国艳,商璟,等.分析化学),2012,1:95.
[10] ZHANG Z H,YANG X,ZHANG H B,et al.Acta Polymerica Sinica(张朝晖,杨潇,张华斌,等.高分子学报),2011,12:1470.
[11] LIU J L,ZHANG S,WANG X J,et al.Chemical Journal of Chinese Universities(刘建林,张琛,王夏娇,等.高等学校化学学报),2012,1:37.
[12] YANG X,ZHANG Z H,CHEN X,et al.Chinese Journal of Analytical Chemistry(杨潇,张朝晖,陈星,等.分析化学),2012,6:870.
[13] KOU L J,Liang R N.Chinese Journal of Chromatography(寇立娟,梁荣宁.色谱),2014,8:817.
[14] ZHANG H B,ZHANG Z H,HU Y F,et al.Chemical Journal of Chinese Universities(张华斌,张朝晖,胡宇芳,等.高等学校化学学报),2010,11:2141.

