QuEChERS净化-超高效液相色谱-串联质谱法测定莲雾中植物生长调节剂
乐 渊, 李春丽*, 张振山, 吴南村, 刘春华
(中国热带农业科学院分析测试中心,海南省热带果蔬产品质量安全重点实验室,海南海口 571101)
植物生长调节剂是一类与植物激素具有相似生理和生物学效应的物质,按作用方式可分为生长促进剂、生长延缓剂和生长抑制剂。其在农业生产上使用可有效调节作物的生育过程,达到稳产增产、改善品质、增强作物抗逆性等目的[1]。但若使用不规范却会使作物过快增长,或使生长受到抑制甚至死亡,进而影响农产品的品质和消费者安全。近年来有媒体对果蔬植物生长调节剂的问题反复炒作,“激素农产品”的报道时有耳闻,严重影响民众的消费信心,冲击了果蔬产业。
莲雾(Syzygiumsamarangense(Blume) Merr.et Perry)是桃金娘科蒲桃属热带常绿果树,其果实具有特殊的芳香,肉质清脆可口,深受消费者喜爱,但不耐贮藏,室温贮藏4 d后商业品质迅速下降。利用植物生长调节剂调节莲雾果实产期,让果品分散上市,能获得更大的经济效益[2 - 3]。目前,国内外已有报道利用气相色谱法、液相色谱法、免疫法等方法测定植物生长调节剂,但这些方法往往费时较长、灵敏度不够或者检测的分析物种类少[4 - 8]。QuEChERS方法于2003年被Anastassiades等开发出来,具有回收率高、稳定性强和被分析物范围广等优点,广泛应用于农药残留检测领域[9]。本研究拟利用QuEChERS方法净化莲雾提取液,采用超高效液相色谱-串联质谱法(UPLC-MS/MS)检测莲雾中氯吡脲等16种植物生长调节剂。方法具有快速、准确度高、成本较固相萃取(SPE)低廉等优点。
1 实验部分
1.1 仪器与试剂
Exion LC超高效液相色谱仪、TripleQuad 4500三重四极杆串联质谱仪(美国,AB SCIEX公司),配有电喷雾离子源(ESI)和Analyst 3.0工作站;AL204型电子分析天平(瑞典,梅特勒托利多公司);T25型分散机(德国,IKA公司);LXJ-Ⅱ型B离心机(上海安亭科学仪器厂)。
多效唑(Paclobutrazol,纯度98.5%)、矮壮素(Chlormequat Chloride,纯度99.0%)、噻苯隆(Thidiazuron,纯度99.7%)、6-苄基腺嘌呤(6-Benzylaminopurine,6-BA,纯度99.0%)、烯效唑(Uniconazole,纯度98.0%)、氯吡脲(Forchlorfenuron,纯度98.7%)、胺鲜酯(2-Diethylaminoethyl Hexanoate,DA-6,纯度98.5%)、助壮素(Mepiquat Chloride,纯度99.1%)、2,3,5-三碘苯甲酸(2,3,5-Triiodobenzoic Acid,TIBA,纯度99.0%)、2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic Acid,2,4-D,纯度99.0%)、对氯苯氧乙酸(4-Chlorophenoxyacetic Acid,4-CPA,纯度99.7%)、赤霉素(Gibberellic Acid,GA3,纯度98.0%)、3-吲哚丁酸(3-Indolebutyric Acid,IBA,纯度99.9%)、萘乙酸(1-Naphthaleneacetic Acid,NAA,纯度98.0%)、抗倒酯(Trinexapac Ethyl,纯度99.0%)、脱落酸(Abscisic Acid,ABA,纯度98.5%)标准品,均购自上海安谱科学仪器有限公司;色谱纯甲醇、乙腈、甲酸购自美国Fisher公司;吸附剂乙二胺-N-丙基硅烷(PSA)购自美国Agilent公司;C18吸附剂、石墨化炭黑(GCB)购自上海安谱科学仪器有限公司。实验用水为经Milli-Q净化系统及0.22 μm过滤膜过滤的纯化水。
莲雾样品购自海南省海口市南北水果批发市场。
1.2 标准溶液的配制
将上述氯吡脲等16种植物生长调节剂标准品用甲醇配制成浓度为100 μg/mL的混合标准储备溶液,在-18 ℃避光保存,有效期3个月。取空白莲雾样品按1.3方法进行前处理,得到空白莲雾基质溶液。将标准储备溶液分别用甲醇和空白莲雾基质溶液稀释成浓度为5、10、20、50、100、200、500 ng/mL的系列混合标准溶液,现配现用。
1.3 样品前处理
莲雾样品经去核取可食部分,用组织捣碎机捣碎,装入洁净容器内,密封后于-18 ℃下保存。准确称取10.00 g均质试样于50 mL具塞离心管中,加入10.0 mL乙腈(含1%甲酸),18 000 r/min均质2 min,再加入1.0 g NaCl,涡旋1 min,然后以5 000 r/min的离心5 min。取上层乙腈溶液1.00 mL于预先加有50 mg C18粉末和150 mg无水MgSO4的离心管,冰水浴冷却2 min后涡旋1 min,再以10 000 r/min离心5 min,上清液经0.22 μm微孔膜过滤,待UPLC-MS/MS分析。
1.4 仪器工作条件
UPLC条件:ACQUITY BEH C18柱(50×2.1 mm×1.7 μm);柱温:35 ℃;样品室温度:15 ℃;进样体积:5 μL;流速:0.25 mL/min。流动相:A为乙腈,B为含5 mmol乙酸铵水溶液。梯度洗脱条件:0~0.5 min,5%A;0.5~2.5 min,5%~70%A;2.5~4.5 min,70%A;4.5~4.6 min,70%~5%A;4.6~5 min,5%A。
ESI-MS/MS条件:离子源:电喷雾离子源;离子化电压:5 000~4 500 V;温度:550 ℃;气帘气:30 psi;喷雾气:55 psi;辅助加热气:55 psi;碰撞气:8 psi。多反应监测模式(MRM)下的质谱参数见表1。

表1 MRM 分析的质谱参数
*quantitative ion.
2 结果与讨论
2.1 UPLC-MS/MS工作条件的优化
在电喷雾电离模式下,以流动注射方式分别对氯吡脲等16种植物生长调节剂的单标溶液进行母离子全扫描,再对各自的子离子进行全扫描,每个化合物选择2对响应值高的特征离子对作为定量及定性离子对(奈乙酸选择1对特征离子对),并进行MRM参数的优化,优化结果见表1。在上述质谱条件下,以乙腈和含5 mmol乙酸铵的水溶液作为流动相,氯吡脲等16种植物生长调节剂可获得较好的分离度及较高的响应值。
2.2 提取条件的选择
选择了乙酸乙酯、丙酮、二氯甲烷、乙腈和含1%甲酸的乙腈溶液等进行考察。称取10.0 g空白样品,添加0.10 mL 1 μg/mL的16种植物生长调节剂的混标后,分别用10 mL上述5种溶剂进行提取实验。结果表明:含1%甲酸的乙腈提取效果最好,16种植物生长调节剂回收率高,基质干扰少;用丙酮提取时,基质干扰较多,不利于后续的净化;用乙酸乙酯和二氯甲烷提取时,部分调节剂(脱落酸、氯吡脲)提取效果较差;用乙腈提取时,部分酸性调节剂(2,4-二氯苯氧乙酸、对氯苯氧乙酸、萘乙酸、脱落酸)回收率中等,不如含1%甲酸乙腈高。因此本文采用含1%甲酸的乙腈作为提取溶剂。
2.3 净化条件的选择
QuEChERS方法常用的吸附剂有PSA、C18、GCB、氨丙基粉和碳纳米管等[10 - 11]。在吸附剂选择时,本文探索了5种净化方案:50 mg PSA和150 mg无水MgSO4;25 mg GCB和150 mg无水MgSO4;50 mg PSA、50 mg C18和150 mg无水MgSO4;50 mg PSA、25 mg GCB和150 mg无水MgSO4;50 mg C18粉和150 mg无水MgSO4。取空白样品,添加0.10 mL 1 μg/mL的16种植物生长调节剂的混标,按2.2方法提取后采用上述5种方案净化。结果表明5种条件下矮壮素、助壮素和赤霉素的回收率均低于30%,原因可能是这3种调节剂热稳定性差,净化时无水MgSO4吸水放热导致回收率低。净化时采用冰水浴降温后,回收率均有大幅提高。第二和第四种方案下,6-苄基腺嘌呤、噻苯隆、烯效唑和氯吡脲的回收率低于30%,其中氯吡脲回收率只有4%。第一和第三种方案下,3-吲哚丁酸和萘乙酸的回收率低于50%。第五种方案下,16种生长调节剂回收率均在70%~130%之间。原因可能是6-苄基腺嘌呤、噻苯隆、烯效唑和氯吡脲为平面结构,被GCB吸附,3-吲哚丁酸和萘乙酸为有机酸,被PSA吸附。因此本文采用C18和无水MgSO4作为吸附剂净化莲雾提取液。
2.4 方法的线性范围和检出限
移取一定量的植物生长调节剂标准储备液,以空白莲雾基质提取液为稀释溶液配制标准曲线,采用1.4中方法进行测定,以仪器响应峰面积对各目标物的质量浓度进行线性回归。结果表明,氯吡脲等16种植物生长调节剂的质量浓度在5.0~500.0 ng/mL范围内线性良好,相关系数和回归方程见表2。以3倍信噪比(S/N=3)计算检出限(LOD),以10信噪比(S/N=10)计算定量限(LOQ),16种植物生长调节剂的检出限和定量限见表2。

表2 氯吡脲等16种植物生长调节剂的线性回归方程、相关系数、线性范围、检出限(LODs)和定量限(LOQs)
2.5 方法的精密度和回收率
取空白莲雾样品,按低、中、高3个浓度水平进行加标实验,按1.3节方法进行前处理,平行测定5次,计算回收率和精密度,结果见表3。结果显示,16种植物生长调节剂回收率在71.0%~124%之间,相对标准偏差(RSD)在0.6%~11.2%之间,符合方法学要求。

表3 方法回收率及相对标准偏差(n=5)
2.6 基质效应
本文通过测定16种植物生长调节剂在基质匹配溶液中的响应值(A)及其在纯溶剂中的响应值(B),得到基质效应:ME=(A-B)/B×100%。表3为莲雾基质中16种植物生长调节剂在高、低两个浓度(500 ng/mL、50 ng/mL)的基质效应。结果表明,氯吡脲、抗倒酯、2,3,5-三碘苯甲酸和萘乙酸存在基质抑制效应,但干扰程度较低;脱落酸存在基质增强效应,低浓度时干扰程度较低,高浓度时干扰强烈;6-苄基腺嘌呤等11种植物生长调节剂在高低浓度都存在强烈的基质抑制效应[12]。
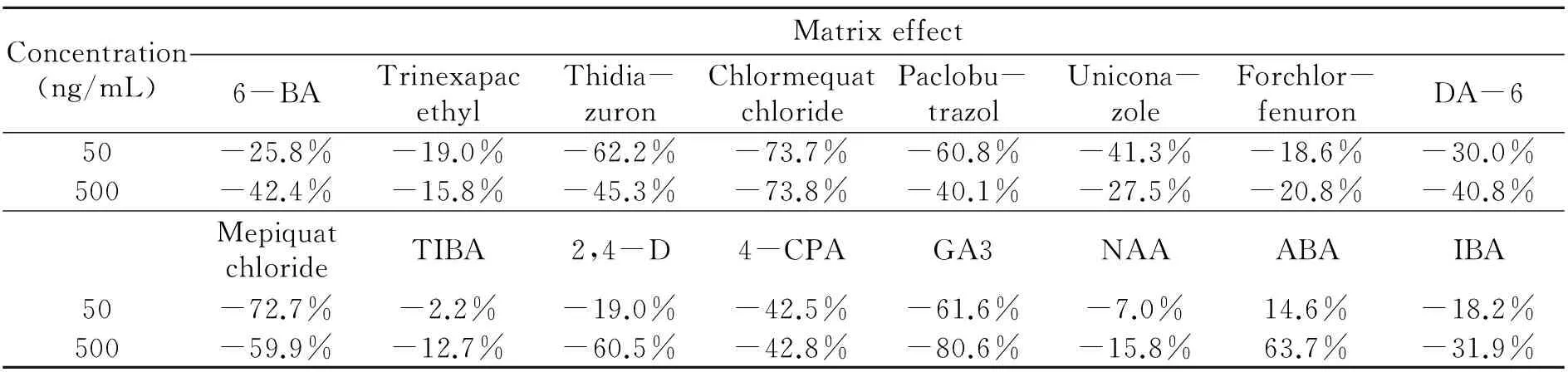
表4 氯吡脲等16种植物生长调节剂在莲雾提取液中的基质效应
为消除基质效应所带来的干扰,提高分析结果的准确度,常采用标准加入法、基质匹配标准溶液、使用分析保护试剂和同位素内标法等[13 - 14]。在农药残留分析中,最常见的是用基质匹配标准溶液进行消除。从结果分析可知,当只需要测定氯吡脲、抗倒酯、2,3,5-三碘苯甲酸和萘乙酸时,由于基质效应较弱可直接使用溶剂标准溶液进行定量;当还需要测定其他植物生长调节剂时,就需要使用基质匹配标准溶液,才能定量准确。
2.7 实际样品的测定
采用本实验建立的方法测定了采集于海口市南北水果批发市场的21份莲雾样品,均未检出氯吡脲等16种植物生长调节剂。
3 结论
本研究建立QuEChERS法前处理,UPLC-MS/MS法快速检测莲雾中氯吡脲等16种植物生长调节剂。实验优化了UPLC与MS的采集参数、确定了吸附剂的种类及用量,并考察了基质效应。方法学考察及实际样品测定证明该方法具有简便、快速、准确度高、成本较固相小柱萃取低廉等优点,可用于莲雾中氯吡脲等16种植物生长调节剂的检测,具备一定的推广价值。
参考文献:
[1] XU A D.China Vegetables(徐爱东.中国蔬菜),2009,8:1.
[2] LIN Q G,TAO T Y,FU B H.Tropical Agricultural Engineering(林庆光,陶挺燕,符碧海.热带农业工程),2013,37(3):25.
[3] YU D,CHEN Z F,WEI X Q,et al.South China Fruits(余东,陈志峰,魏秀清,等.中国南方果树),2012,42(3):99.
[4] Santos M J,Crespo E,Polo L M.Talanta,2000,53(2):367.
[5] Esparza X,Moyano E,Galceran M T.Journal of Chromatography A,2009,1216(20):4402.
[6] Riediker S,Obrist H,Varga N,et al.Journal of Chromatography A,2002,966(1):15.
[7] Ma L,Zhang H Y,Xu W,et al.Food Analytical Methods,2013,6(3):941.
[8] Lu Q,Wu J H,Yu Q W,et al.Journal of Chromatography A,2014,1367(7):39.
[9] Anastassiades M,Lehotay S J,Stajnbaher D,et al.Journal of AOAC International,2003,86(2):412.
[10] Nguyen T D,Yu J E,Lee D M.Food Chemistry,2008,110:207.
[11] Sharmili K,Jinap S,Sukor R.Food Control,2016,70:152.
[12] LIU J,QIN S S,FENG S H,et al.Food Science(刘进玺,秦珊珊,冯书惠,等.食品科学),2016,37(18):171.
[13] Garrido F A,Marinez J L,Fernandez J L,et al.Journal of Chromatography A,2009,1216(23):4798.
[14] Marinez G M,Lopez L T,Gilgarcia M D,et al.Analytical and Bioanalytical Chemistry,2003,375(5):653.

