影响输尿管移行细胞癌患者预后的术前因素
王逸夫,安瑞华,郭桂迎,于时良,刘亚东
(哈尔滨医科大学附属第一医院泌尿外科,黑龙江哈尔滨 150006)
上尿路移行细胞癌(upper urinary tract urothelial carcinoma,UTUC)是指发生于肾盂和输尿管的尿路上皮恶性肿瘤,其发病率在尿路上皮肿瘤中占5%~10%,流行病学研究报告,中国的发病率略高于西方[1]。随着诊断方法的进步,输尿管肿瘤的发病率正在逐步增加[2]。行患侧根治性肾输尿管全长+膀胱袖状切除术(radical nephroureterectomy,RNU)为UTUC手术的金标准。但是术后患者的预后具有差异,影响其手术预后的预测因素有很多。在现有研究中,已经有相关文献报道输尿管肿瘤相关因素对其预后的影响,并提供了基础研究资料,但未能将众多因素进行整合,建立一个风险评估模型。本文对行RNU手术治疗的输尿管肿瘤患者的预测因素进行回顾性分析,分析这些因素与输尿管肿瘤的T分期、分级之间的关系,并评估患者的手术预后,寻找其相关性,为输尿管肿瘤术前术后的临床治疗提供指导参考。
1 资料与方法
1.1临床资料回顾性分析2012至2017年因输尿管移行细胞癌在我院行RNU手术治疗的患者的临床资料,并对患者进行长期随访。排除非原发性输尿管移行细胞癌患者、术后临床资料不完整者、术后失访者。
本次研究收集了180例因输尿管移行细胞癌在我院行RNU手术治疗的患者的临床资料。包括由术前影像学检查获得输尿管肿瘤位置、肿瘤最大长径、患侧肾积水水平;术前采血化验获得是否贫血、白蛋白-球蛋白比值(albumin-globulin ratio,AGR);询问相关病史获得性别、年龄、高血压史、吸烟史;患者在术前均行肾发射型计算机断层扫描(emission computed tomyraphy,ECT)检查,获得其患侧肾小球滤过率(glomerular filtration rate,GFR)水平。参考相关文献[3-5],对获得的临床资料进行分组统计,结果可见表1。其中肿瘤T分期为Ta、T1、T2患者共89人;T3、T4患者共91人。在180例患者中,48例术后病理回报为低级别尿路上皮癌,132例术后病理回报为高级别尿路上皮癌。
1.2分类方法手术方式包括开放式及腹腔镜辅助,术后切除标本均行病理检查。肿瘤的分级以2002年国际抗癌联盟(Union for International Cancer Control,UICC)的恶性肿瘤TNM分期和2004年世界卫生组织(World Health Organization,WHO)公布的非浸润性尿路上皮癌分类标准进行肿瘤的分级及分期。
1.3随访每位患者均进行术后随访,术后2年内每3月随访1次,2年后每6月随访1次,随访方式包括电话随访及门诊随访。将患者的肿瘤特异性死亡、膀胱肿瘤复发、肿瘤远处转移定义为终点事件。分析患者的肿瘤特定生存率(cancer-specific survival,CSS)、无膀胱肿瘤复发生存率(recurrence-free survival,RFS)、无远处转移生存率(metastasis-free survival,MFS)。
1.4统计学方法使用SPSS19.0对数据进行统计学分析,计量指标运用独立样本t检验、计数资料采用χ2检验分析两组间的差异,P<0.05为差异具有统计学意义。本研究运用K-M(Kaplan-Meier)法进行生存分析,并运用log-rank法进行显著性检验,以双侧P<0.05为差异具有统计学意义。
2 结 果
2.1相关性分析表1显示了180例患者的预测因素与肿瘤的T分期、分级之间的相关性。其中,患者的肾积水程度、肿瘤最大长径、贫血、AGR等预测因素与肿瘤的T分期在统计学上具有显著的相关性(P<0.001);患侧肾小球滤过率、输尿管肿瘤位置、血小板水平等因素与肿瘤的T分期具有统计学意义(P<0.05)。肾积水的程度重、肿瘤最大长径≥2.5 cm、术前患者贫血、肿瘤位于输尿管下段、患侧重度肾功能不全或无肾功能、AGR<1.45、术前高血小板,存在以上情况的输尿管肿瘤患者的肿瘤为高T分期的概率较大。患者的肾积水程度、肿瘤最大长径、贫血、患侧肾小球滤过率、AGR、血小板水平等预测因素与肿瘤的分级之间在统计学上具有显著的相关性(P<0.001)。肾积水的程度越重、肿瘤最大长径≥2.5 cm、术前患者贫血、患侧重度肾功能不全或无肾功能、AGR<1.45、术前高血小板,存在以上预测因素的输尿管肿瘤患者的肿瘤肿瘤为高级别的概率较大。
2.2生存分析对随访患者进行生存分析。截至随访日期,患者1年总生存率88.3%,2年总生存率70.6%,患者随访过程中,有64例因肿瘤死亡、71例出现了膀胱肿瘤复发、27例出现了肿瘤的远处转移。将肾积水的程度重、肿瘤最大长径≥2.5 cm、术前患者贫血、肿瘤位于输尿管下段、患侧重度肾功能不全或无肾功能、AGR<1.45、术前高血小板等7项预测因素纳入风险评估。存在1~3项因素患者为低风险组;存在4~5项因素患者为中风险组;存在6~7项因素患者为高风险组,作生存曲线图,可见不同风险组间的生存率差异。其中,图1A可见患者的CSS差异具有显著的统计学意义(P<0.001);图1B可见不同风险组患者的RFS差异具有显著的统计学意义(P<0.001);图1C可见不同风险组患者的MFS差异具有显著的统计学意义(P<0.001)。由此可见,患者存在风险因素越多,肿瘤预后越差。综合以上统计学分析结果,可以认为:在输尿管移行细胞癌患者中,肾积水的程度重、肿瘤最大长径≥2.5 cm、术前患者贫血、肿瘤位于输尿管下段、患侧重度肾功能不全或无肾功能、AGR<1.45、术前高血小板等7项因素能够反映患者输尿管肿瘤的T分期及分级程度,并与输尿管肿瘤的预后具有密切的相关性。

图1不同风险组患者的CSS、RFS、MFS差异
Log-Rank检验:P<0.01。A:CSS风险分组(P<0.001);B:RFS风险分组(P<0.001);C:MFS风险分组(P<0.001)。
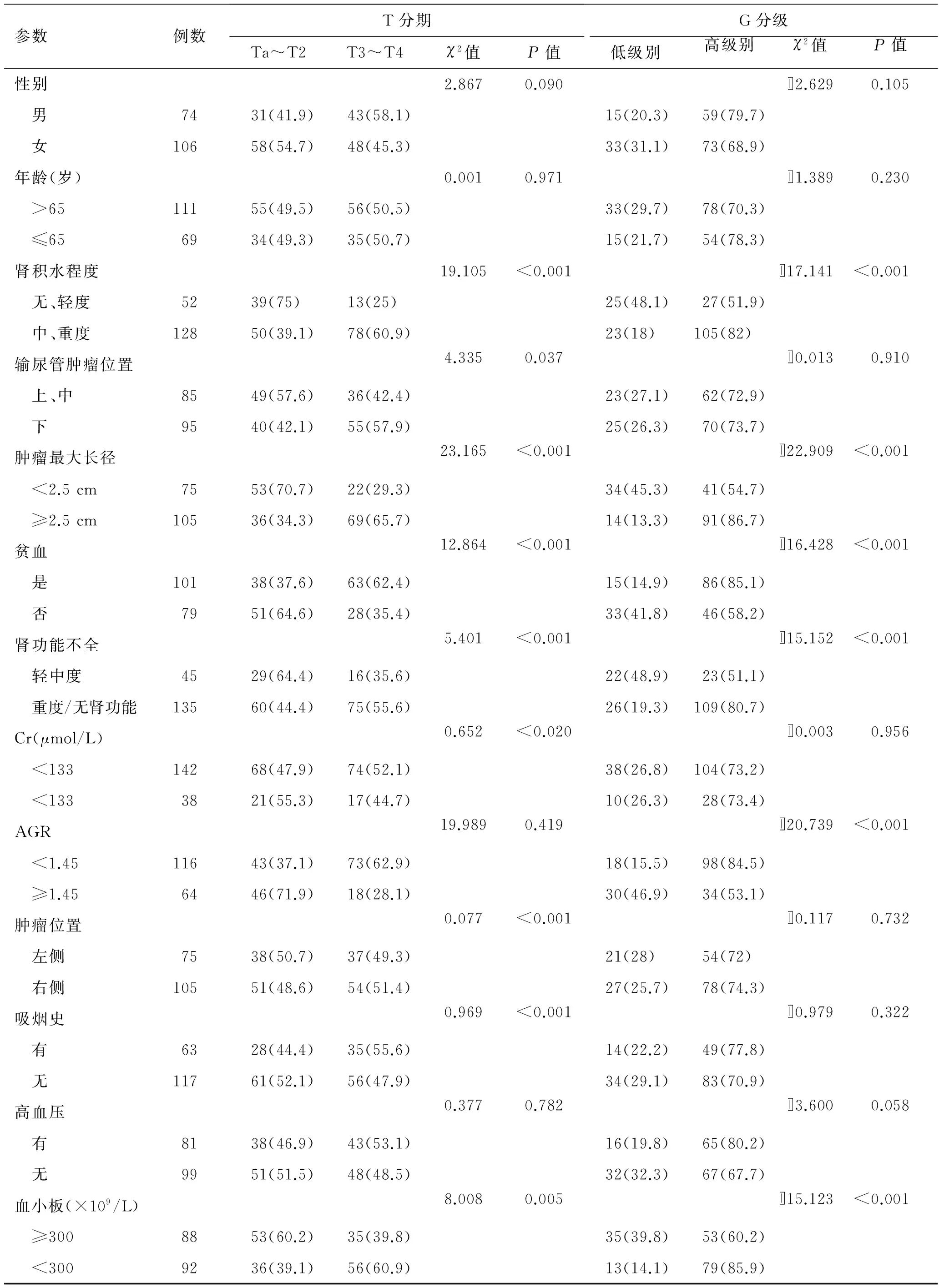
表1 输尿管移行细胞癌术前预后相关预测因素与肿瘤T分期、分级的相关性分析 [例(%)]
AGR:白蛋白-球蛋白质值。
3 讨 论
输尿管移行细胞癌的发病率较其他的泌尿系肿瘤来说相对较低。输尿管是腹膜后器官,其位置相对隐蔽,因此诊断较为困难。绝大多数患者是因体检无意发现,少量是因血尿就诊。肿瘤容易发生浸润、转移,复发率高[6]。输尿管肿瘤的预后较差,相关文献报道,其5年的生存率仅为41%~67%。输尿管肿瘤的预后与肿瘤的分级及分期有关[7]。高分级或高分期的输尿管肿瘤其预后自然较差。在恶性程度较高的肿瘤病例中,其病程的进展较快,患者就诊时更容易出现上述研究的预测因素,而上述因素又能反作用于肿瘤,促进肿瘤的进展。
肾积水为输尿管肿瘤常见的并发症之一。产生肾积水的原因可能有肿瘤向管腔内的浸润、输尿管管腔的堵塞以及腔外肿瘤的压迫[8]。相关研究报道,肿瘤的T分期越高,肾积水的程度就越重[3]。在临床中对于出现肾积水的高龄患者要引起重视,近年肾输尿管三维螺旋CT的应用为输尿管肿瘤的诊断提供了极大的帮助,可以清晰显示输尿管肿瘤的位置及大小、肾积水的程度,并辅助进行肿瘤的T分期[4]。CHUNG等[9]指出,肾积水可能会导致已经狭窄的肾盂及输尿管壁的外展扩张以及管壁的纵向变薄,其可能会促使癌细胞向临近器官及远处器官的转移。除此之外肾积水可能会产生向外的离心压力,会导致淋巴管及脉管系统的反向流动,从而导致更大机会的癌扩散。免疫组化及相关形态学研究发现,肾积水能导致缺血性相关改变,在上尿路移行细胞癌中增加了低氧诱导因子a(hypoxia-inducible factors-a,hif-a)的表达,该因子被认为与促肿瘤细胞生长和新生血管的形成有关。这一结果也表明了肾积水与癌症的活跃行为有关[10]。
输尿管肿瘤患者的肾功能不全原因可能与肾积水有关。出现肾积水的输尿管肿瘤患者往往伴随着肾功能不全。长期的泌尿系梗阻会导致肾功能的进行性破坏。然而,输尿管肿瘤一般不会造成完全性梗阻,在恶性程度较高的肿瘤患者中极少会出现重度肾积水的情况。在恶性程度较高的输尿管肿瘤中,会很快产生梗阻,引起轻、中度肾积水,进而迅速出现肾脏萎缩,GFR明显下降,肾脏体积并不会出现明显的增大。另一方面,预后较差的输尿管肿瘤患者往往伴随着慢性肾功能不全的存在。慢性肾功能不全会导致慢性炎症反应的发生[11]。系统的慢性炎症会对肿瘤产生不良的影响。一些炎症相关蛋白,如白介素、C反应蛋白等,会促进纤维蛋白原的生成。大量的研究报道血浆纤维蛋白原升高会促进肿瘤的进展、远处转移[12]。值得注意的是,在积极行患侧RNU的伴有慢性肾功能不全的输尿管肿瘤患者中,由于术后仅存有单侧肾脏,肾脏负荷加重,促使健侧肾脏功能衰竭进展,加重慢性肾功能不全,反而会引起促炎因子的产生对肿瘤预后产生不良的影响[13]。
国外相关文献报道术前的贫血程度影响输尿管肿瘤的预后。患者肿瘤的恶性程度越高,越容易出现贫血症状,并且可能已经持续了很长时间才确诊。这对患者的全身状态影响较大[14]。人体中的白蛋白水平与患者的营养水平有关,KIM等[15]的研究表明,患者的身体质量指数 (body mass index,BMI)水平影响着UTUC的预后。同时白蛋白与球蛋白的水平还反映了机体的炎症反应水平,这也会对肿瘤细胞的进展产生影响[16]。本次研究提示在AGR<1.45的输尿管肿瘤患者中术后生存较差。FOERSTER等[17]指出输尿管肿瘤的患者术前会出现血小板增多症,提示肿瘤恶性程度较高,预后较差的风险较大。这在本研究中也得到了反映。
输尿管肿瘤的预后还与肿瘤的最大长径及位置有关。本研究发现,在最大长径≥2.5 cm的输尿管肿瘤患者中,肿瘤的T分期较高,术后生存预后较差。位于输尿管下段的输尿管肿瘤更容易因为肿瘤细胞的脱落、输尿管镜检查、手术操作等原因发生膀胱肿瘤种植性转移[5]。PARK等[18]的研究也同样指出了输尿管下段的肿瘤的分期较高,更容易发生肿瘤的侵润,预后较差。值得一提的是,多发肿瘤的和膀胱肿瘤复发的相关性已经得到多篇文献的证实[19],其应也会是一项影响因子被列入研究,但因本次收集肿瘤的多发性数据资料不完整,因此未将其进行分析,有待之后的进一步研究。
综上所述,术前肾积水的程度、肿瘤最大长径、贫血、肿瘤位置、患侧肾功能、AGR、高血小板等预测因子对输尿管移行细胞癌的术后预测具有重要意义。通过本研究,临床医生可以根据患者的临床资料,对患者的病情进行初步的评估,指导医生作出临床治疗方案。在出现多项风险因素的输尿管肿瘤患者中,肿瘤进展风险较大,患者的预后不良。临床医生可在积极行根治性手术的同时,尝试纠正风险因素,术后行相关后续治疗,改善患者预后,提高患者的生存质量。
参考文献:
[1] ROUPRET M,BABJUK M,COMPERAT E,et al.European guidelines on upper tract urothelial carcinomas:2013 update[J].Eur Urol 2013,63(6):1059-1071.
[2] MCCARROM JP,MillS C,VAUGHN ED JR.Tumors of the renal pelvis and ureter:current concepts and management[J].Seminars in Urology,1983,1(1):75.
[3] 陈晓博,乔宝民,姜行康,等.肾积水程度和肿瘤直径作为输尿管移行细胞癌术前预测因素分析[J].天津医科大学学报,2015,21(03):236-238.
[4] 张继伟,王海涛,阎乙夫,等.低分期和低分级原发性输尿管癌的临床特点分析[J].中华泌尿外科杂志,2013,34(10):742-745.
[5] 邢云超,熊耕砚,方东,等.上尿路尿路上皮癌术前预后相关因素分析及初步风险分层模型构建[J].北京大学学报:医学版,2016,48(6):1032-1037.
[6] HOLST L M,JENSEN J B,BUE P,et al.Primary adenocarcinoma of the ureter[J].Ugeskrift Laeger,2009,171(7):534.
[7] 刘刚,关英华,任小强,等.输尿管癌手术预后的临床病理多因素分析[J].肿瘤防治研究,2013,40(12):1163
[8] NG C K,SHARIAT S F,LUCARS S M,et al.Does the presence of hydronephrosis on preoperative axial CT imaging predict worse outcomes for patients undergoing nephroureterectomy for upper-tract urothelial carcinoma?[J].Urol Oncol Seminars & Original Invest,2011,29(1):27-32.
[9] CHUNG P H,KRABBE L M,DARWISH O M,et al.Degree of hydronephrosis predicts adverse pathological features and worse oncologic outcomes in patients with high-grade urothelial carcinoma of the upper urinary tract[J].Urol Oncol,2014,32(7):981-988.
[10] STRAVODIMOS K G,KORITSIADIS G,LAZARIS A C,et al.Hydronephrosis promotes expression of hypoxia-inducible factor 1α[J].Urol Int,2009,82(1):38-42.
[11] CHEN C Y,LIAO Y M,TSAI W M,et al.Upper urinary tract urothelial carcinoma in eastern Taiwan:high proportion among all urothelial carcinomas and correlation with chronic kidney disease[J].J Formosan Med Assoc=Taiwan yi zhi,2007,106(12):992-998.
[12] FOX P,HUDSON M,BRONW C,et al.Markers of systemic inflammation predict survival in patients with advanced renal cell cancer[J].Br J Cancer,2013,109(1):147-153.
[13] FUKUSHIMA H,SAITO K,ISHIOKA J,et al.Equivalent survival and improved preservation of renal function after distal ureterectomy compared with nephroureterectomy in patients with urothelial carcinoma of the distal ureter:A propensity score‐matched multicenter study[J].Inte J Urol,2014,21(11):1098-1104.
[14] RINK M,SHARIFI N,FRITSCHE H M,et al.Impact of preoperative anemia on oncologic outcomes of upper tract urothelial carcinoma treated with radical nephroureterectomy[J].J Urol,2014,191(2):316-322.
[15] Kim H S,CHANG W J,KWAK C,et al.Can body mass index predict survival outcomes in patients treated with radical nephroureterectomy for upper-tract urothelial carcinoma?[J].Int Urol & Nephrolo,2015,47(8):1311-1320.
[16] BO Z,WEI Y,ZHOU L Q,et al.Prognostic Significance of Preoperative Albumin-Globulin Ratio in Patients with Upper Tract Urothelial Carcinoma[J].PLoS One,2015,10(12):e0144961.
[17] FOERSTER B,MOSCHINI M,ABUFARAJ M,et al.Predictive and prognostic value of preoperative thrombocytosis in upper tract urothelial carcinoma[J].Clin Genitourin Cancer,2017,15(6):1039-1045.
[18] PARK S,HONG B,KIM C S,et al.The impact of tumor location on prognosis of transitional cell carcinoma of the upper urinary tract[J].J Urol,2004,171(1):621-625.
[19] NARUKAWA T,HARA T,ARAI E,et al.Tumour multifocality and grade predict intravesical recurrence after nephroureterectomy in patients with upper urinary tract urothelial carcinoma without a history of bladder cancer[J].Japan J Clin Oncol,2015,45(5):488-493.

