论非肌层浸润性膀胱癌二次电切后的治疗抉择:立即全切还是继续膀胱灌注?
范晋海,杨 涛,吴开杰,贺大林
(西安交通大学第一附属医院泌尿外科,陕西西安 710061)
膀胱癌分为非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC),分别占70%~80%和20%~30%。对于NMIBC的治疗,首选经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURB-t)。然而,这些肿瘤具有很高的复发率和进展率,尤其是T1G3等高危肿瘤。最新的一项主要针对T1G3的大样本Meta分析(共纳入15 215个病例)结果表明,T1期患者的5年的复发率及进展率分别高达41.8%和20.7%[1]。
对此,各大指南都推荐对高危患者行二次电切术,可大大降低术后患者的复发率及进展率。然而,不同患者行二次电切后其肿瘤复发或进展程度不尽相同。例如有些患者二次电切后辅助膀胱灌注即可达到较好的治疗效果,而有些患者仍会迅速发生肿瘤复发,甚至转移等,而这类患者复发后再行根治性膀胱全切术(radical cystectomy,RC)效果不佳[2]。因此,提早甄别出这类患者行立即全切术有望提高患者生存率。我们综合最新文献报道,认为需要根据二次电切的结果来个性化制定每位患者的最佳后续治疗方案。
1 二次电切为T2
毫无疑问,对于二次电切术后病理证实为T2期的患者,首次电切术低估了这类患者肿瘤的临床分期,而RC应是他们的治疗方案。NIELSEN等[3]探讨了最近TURB-t到RC之间的间隔时间与患者预后关系,结果显示延迟手术时间与肿瘤分期进展或肿瘤特异生存期(cancer specificity survival,CSS)降低并无关联,然而AYRES等[4]单独分析了T2期肿瘤患者后发现,在90 d内实施手术达到更好的生存效果。这与GORE等[5]研究结果相似。
2 二次电切为T1期
对二次电切术后病理证实为T1期的患者,5年内有82%的概率会发展为MIBC,远远高于二次电切为Ta/Cis或无瘤的患者(19%)[6],且这类患者行立即全切后,肿瘤细胞已侵犯肌层的比例多达46.7%[7],因此HERR[6]建议对这类患者应行RC。然而,FELDMAN[8]认为,二次电切后行卡介苗(bacillus calmette-guérin,BCG)灌注治疗便可达到很好的疗效,他认为除了过度治疗外,RC引起的并发症及围手术期死亡率亦不可忽视[9]。此外,近期一些研究对比了立即全切和继续灌注治疗患者的生存率,结果显示立即全切并无明显生存优势[10]。对此,HERR分析认为,出现这种情况的部分原因是选择立即全切的患者往往是一些比较高危的患者。
所以在临床需要特别注意的是,确定在二次电切为T1的患者中哪些是真正需要行立即全切,而哪些只需BCG灌注治疗便可达到很好的疗效。对此,EORTC风险评估表和CUETO表所列的危险因素被广泛应用。但遗憾的是,其仍不能准确地评估肿瘤的复发及进展等预后情况[11]。所以,近年来已有其他危险因素受到重视,并被加入到评估中,以期更准确地评估肿瘤的预后状况。
2.1T1的分层T1分层(substage of T1)是指以肿瘤浸润黏膜肌层(muscularis mucosae,MM)为界限,进一步分为T1a(未超过MM)、T1b(到MM)及T1c(超过MM)。且多个研究已证明它的分层与肿瘤的预后有关[12],例如MARTIN-DOYLE等[1]在Meta分析中证实T1b/T1c与肿瘤的进展和CSS有关(HR3.34,95%CI2.04~5.49;HR2.02,95%CI1.32~3.07),而与复发无关(HR1.29,95%CI0.93~1.78)。
然而,临床实践中,术后肿瘤组织中MM较难确认,所以,一种新的分层方法是以浸润到固有层中的肿瘤的直径是否超过0.5 mm为界,将T1分为T1m(直径≤0.5 mm)和T1e(直径>0.5 mm)。研究显示,T1e与肿瘤进展和CSS密切相关[13]。此外,一些研究尝试利用分子标志物来区分T1分层,包括成纤维细胞因子受体3(fibroblast growth factor receptor 3,FGFRs)、错构瘤蛋白(hamartin)、14-3-3σ、Aurora-A和E-cadherin等,结果显示这些分子表达量与T1分层均无关[14]。然而,ERDEMIR等[15]对比了T1a和T1b中E-cadherin表达量,发现T1b组织中的E-cadherin表达量较T1a低(P<0.05)。
尽管关于T1分层的研究已有多年,但目前准确的分层定义尚未统一,加上病理很难准确确认(电切时肿瘤基底组织有所灼烧,以及MM的判断困难),因此,目前在TNM分期系统中尚未包含进去。
2.2淋巴管浸润(lymphovascularinvasion,LVI) 淋巴管浸润是癌细胞进行全身转移的重要一步。在淋巴结转移阴性的膀胱全切标本中LVI是肿瘤复发(HR1.68,P<0.001)和CSS(HR1.70,P<0.001)的独立预后因子[16]。若在膀胱电切标本中发现LVI,预示着肿瘤进展,甚至转移的可能性较大,且是无复发生存期(recurrence-free-survival,RFS)、无进展生存期 (progression-free-survival,PFS)和CSS等预后因子[17]。
2.3血清、尿液或组织分子标记物如果这类患者选择保守治疗,往往建议行BCG灌注治疗,然而并不是所有患者都可以获益于BCG灌注治疗,事实上大约有30%~50%患者行BCG治疗后发生复发,因此预测电切术后膀胱癌患者对BCG敏感程度至关重要。
谷胱甘肽S转移酶(glutathione s-transferase,GSTs)是体内最重要的Ⅱ相代谢酶之一,可催化化合物或其代谢物与还原性谷胱甘肽相轭合,使其灭活或代谢,从而达到抑制癌症的作用。在人体中,它们被8种不同的基因编码,其中,GSTA1、GSTM1、GSTP1和GSTT1是被认为最重要的。一个纳入79篇文献的Meta分析研究表明,GSTT1阴性基因型(OR=1.11,95%CI1.00~1.22)和GSTM1阴性基因型(OR=1.39,95%CI1.28~1.51)均与膀胱癌易感性有关,而GSTA1和GSTP1与膀胱癌易感性无关[18]。最近,KANG等[19]研究GSTT1基因表型与膀胱对BCG敏感程度的影响,研究结果表明相比于GSTT1阴性基因型,GSTT1阳性基因型患者早期BCG治疗失败风险高达14倍,且GSTT1阳性/GSTM1阴性基因型比GSTT1阴性/GSTM1阴性基因型有着更高的BCG无应答危险,因此他建议以此可以区分哪些患者需立即全切术。
此外,一些学者尝试利用尿液中细胞因子来预测电切术后膀胱对BCG的敏感性。CAI等[20]研究术前尿液中IL-6/IL-10的预测效果,他将患者分为A组(IL6/IL10<0.09)和B组(IL6/IL10>0.1),并且发现B组患者的RFS较A组高(P=0.003),除此之外,多因素分析后发现IL6/IL10(P<0.003)可以独立预测BCG的反应性。尿液中细胞因子(IL-2、IL-8、IL-6、IL-1ra、IL-10、IL-12、TRAIL、TNF-ɑ)在灌注前后变化可以预测肿瘤复发,且正确率达85.5%[21]。然而,这些试验都是BCG灌注之后来加以预测,对BCG灌注之前预测敏感性指导意义不大。
另外,在决定膀胱癌治疗方案时,准确地评估肿瘤的分期是极其重要的。但超过30%的人在第二次电切中发现分期上升,即便首次电切标本中含有肌层,在二次电切中病理为NMIBC的患者行立即全切后仍有超过45%为MIBC[7]。尽管可以通过电切时较高的膀胱内压使得恶性细胞穿透裸露的上皮细胞进而种植来解释[22],但其原因仍不明了。对此,一些细胞周期及增殖的标志物,如cyclin E、p21、p27、p53和Ki67等,已证实可以预测膀胱癌的预后,在2014年,SHARIAT等[23]研究能否利用这些标志物在电切标本中的表达水平来确定全切后病理分期上升的患者,最后发现Ki67和p27可以预测分期错误。
由于T1期肿瘤的高复发及进展率,它的治疗方案尤为棘手,何时对T1期膀胱癌患者行RC术一直困扰着泌尿外科医师。笔者建议,对于二次电切病理分期为T1的患者,需根据EORTC风险表及上述风险因子来综合判断患者预后,若预后较差,则建议行RC术(图1)。
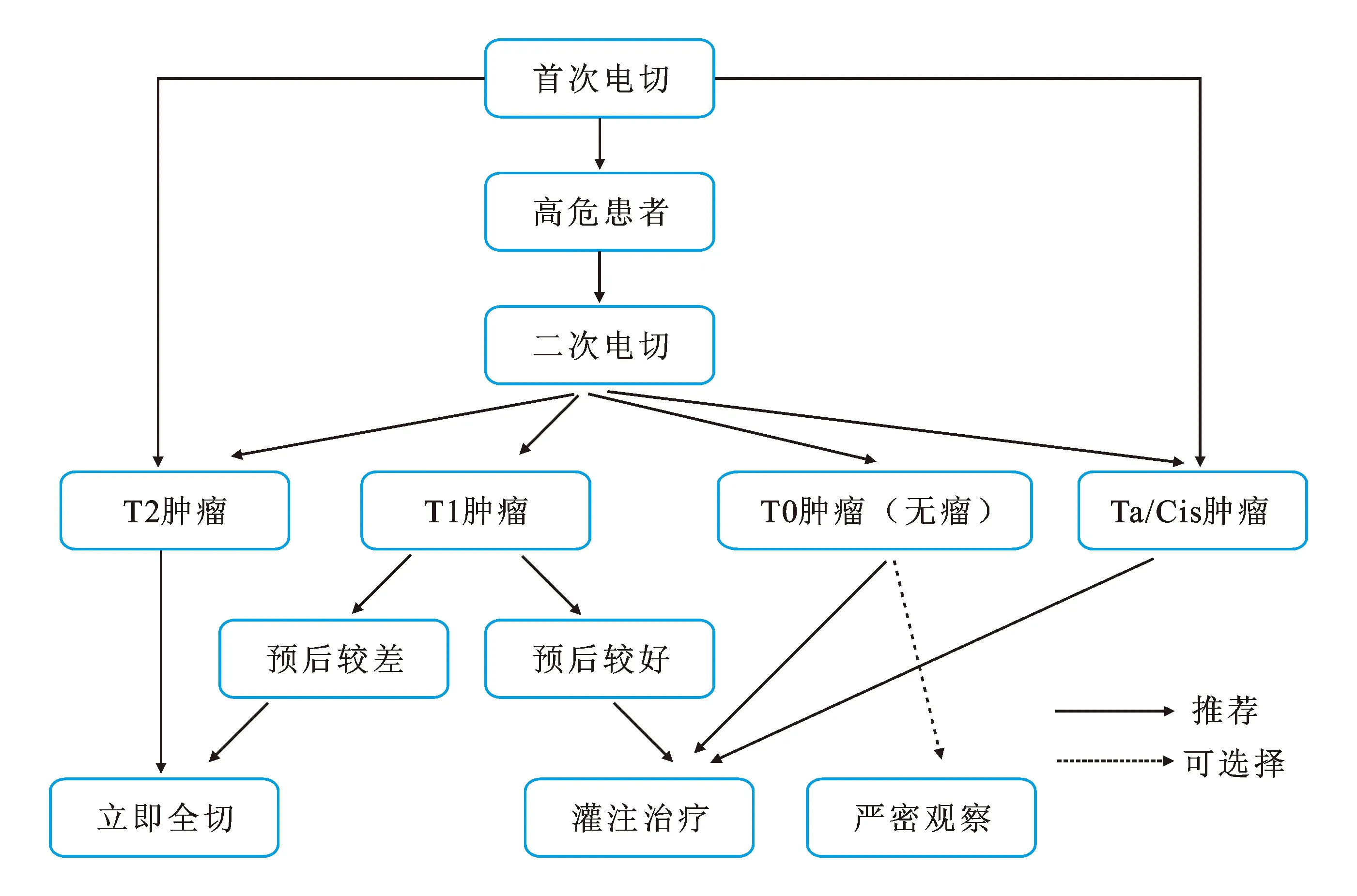
图1高危NMIBC患者治疗流程
注:预后的好坏需根据EORTC风险表和文中所述的风险因子(T1分层、淋巴管浸润、分子标记物)等综合判断。
3 二次电切为Cis
多数研究已证明合并Cis的肿瘤往往具有较差的预后,它是预测复发或进展的重要因子。研究发现合并Cis的T1G3患者1年和5年进展率分别为29%和74%,而没有合并Cis的T1G3患者分别为10%和29%。欧洲泌尿外科协会(European Association of Urology,EAU)指南里将T1G3合并Cis的患者定为极高危患者,并建议考虑立即膀胱全切术。然而对于单独Cis患者,有学者认为立即全切仍属于过度治疗[24]。因此,建议对于单独Cis患者,可先行BCG灌注治疗,治疗失败后再行膀胱全切术。
4 二次电切为Ta
造成这种情况的原因可能是因为首次电切未发现而残留的Ta肿瘤。多数研究发现这类患者和二次电切为Cis一样,仍存在较高的复发率,因此,仍推荐行BCG灌注治疗[25]。
5 二次电切为T0
多数指南都建议T1患者TURBt后行BCG灌注治疗,但这些数据都来源于未曾二次电切的患者。现对二次电切中无瘤(即T0)的T1患者要不要接受灌注治疗尚未定论。目前,日本有研究正进行有一项严密监测和BCG灌注之间对比的Ⅲ期试验[26],我们拭目以待。
6 结 语
非肌层浸润性膀胱癌有着较高的复发率和进展率,尤其是T1期肿瘤,被认为具有和浸润性膀胱癌一样的生物活性,临床上对于它的治疗亦比较棘手,膀胱内灌注何种药物、何时行全切术较为合理等等仍是颇具争议的话题。综上所述,所有的T1患者均应行二次电切,之后根据二次电切的结果以及肿瘤的危险因素去综合判断,为患者选择个体化的最佳的治疗方案。
参考文献:
[1] MARTIN-DOYLE W,LEOW JJ,ORSOLA A,et al.Improving selection criteria for early cystectomy in high-grade t1 bladder cancer:a meta-analysis of 15,215 patients[J].J Clin Oncol,2015,33(6):643-650.
[2] LAMBERT EH,PIERORAZIO PM,OLSSSON CA,et al.The increasing use of intravesical therapies for stage T1 bladder cancer coincides with decreasing survival after cystectomy[J].BJU Int,2007,100(1):33-36.
[3] NIELSEN ME,PALAPATTU GS,KARAKIEWICZ PI,et al.A delay in radical cystectomy of >3 months is not associated with a worse clinical outcome[J].BJU Int,2007,100(5):1015-1020.
[4] AYRES BE,GILLATT D,MCPHAIL S,et al.A delay in radical cystectomy of >3 months is not associated with a worse clinical outcome[J].BJU Int,2008,102(8):1045.
[5] GORE JL,LAI J,SETODJI CM,et al.Mortality increases when radical cystectomy is delayed more than 12 weeks:results from a surveillance,epidemiology,and end results-medicare analysis[J].Cancer,2009,115(5):988-996.
[6] HERR HW,DONAT SM,DALBAGNI G.Can restaging transurethral resection of T1 bladder cancer select patients for immediate cystectomy?[J].J Urol,2007,177(1):75-79,79.
[7] ARK JT,KEEGAN KA,BAROCAS DA,et al.Incidence and predictors of understaging in patients with clinical T1 urothelial carcinoma undergoing radical cystectomy[J].BJU Int,2014,113(6):894-899.
[8] FELDMAN AS.POINT:Is immediate radical cystectomy justified when non-muscle-invasive bladder cancer first presents as high-grade T1 urothelial carcinoma on re-resection?[J].Oncology (Williston Park),2016,30(6):541-542,545.
[9] NOVARA G,CATTO JW,WILSON T,et al.Systematic review and cumulative analysis of perioperative outcomes and complications after robot-assisted radical cystectomy[J].Eur Urol,2015,67(3):376-401.
[10] STERNBERG IA,KEREN PG,CHEN LY,et al.Role of immediate radical cystectomy in the treatment of patients with residual T1 bladder cancer on restaging transurethral resection[J].BJU Int,2013,112(1):54-59.
[11] XYLINAS E,KENT M,KLUTH L,et al.Accuracy of the EORTC risk tables and of the CUETO scoring model to predict outcomes in non-muscle-invasive urothelial carcinoma of the bladder[J].Br J Cancer,2013,109(6):1460-1466.
[12] ORSOLA A,TRIAS I,RAVENTOS CX,et al.Initial high-grade T1 urothelial cell carcinoma:feasibility and prognostic significance of lamina propria invasion microstaging (T1a/b/c) in BCG-treated and BCG-non-treated patients[J].Eur Urol,2005,48(2):231-238,238.
[13] VAN RHIJN BW,VAN DER KWAST TH,ALKHATEEB SS,et al.A new and highly prognostic system to discern T1 bladder cancer substage[J].Eur Urol,2012,61(2):378-384.
[14] MHAWECH-FAUCEGLIA P,FISCHER G,ALVAREZ VJ,et al.Predicting outcome in minimally invasive (T1a and T1b) urothelial bladder carcinoma using a panel of biomarkers:a high throughput tissue microarray analysis[J].BJU Int,2007,100(5):1182-1187.
[15] ERDEMIR F,OZCAN F,KILICASLAN I,et al.The relationship between the expression of E-cadherin and tumor recurrence and progression in high-grade stage T1 bladder urothelial carcinoma[J].Int Urol Nephrol,2007,39(4):1031-1037.
[16] SHARIAT SF,SVATEK RS,TILKI D,et al.International validation of the prognostic value of lymphovascular invasion in patients treated with radical cystectomy[J].BJU Int,2010,105(10):1402-1412.
[17] KIM HS,KIM M,JEONG CW,et al.Presence of lymphovascular invasion in urothelial bladder cancer specimens after transurethral resections correlates with risk of upstaging and survival:a systematic review and meta-analysis[J].Urol Oncol,2014,32(8):1191-1199.
[18] YU Y,LI X,LIANG C,et al.The relationship between GSTA1,GSTM1,GSTP1,and GSTT1 genetic polymorphisms and bladder cancer susceptibility:a meta-analysis[J].Medicine (Baltimore),2016,95(37):e4900.
[19] KANG HW,TCHEY DU,YAN C,et al.The predictive value of GSTT1 polymorphisms in predicting the early response to induction BCG therapy in patients with non-muscle invasive bladder cancer[J].Urol Oncol,2014,32(4):458-465.
[20] CAI T,NESI G,MAZZOLI S,et al.Prediction of response to bacillus Calmette-Guerin treatment in non-muscle invasive bladder cancer patients through interleukin-6 and interleukin-10 ratio[J].Exp Ther Med,2012,4(3):459-464.
[21] KAMAT AM,BRIGGMAN J,URBAUER DL,et al.Cytokine panel for response to intravesical therapy (CyPRIT):nomogram of changes in urinary cytokine levels predicts patient response to bacillus calmette-guerin[J].Eur Urol,2016,69(2):197-200.
[22] EL-ABBADY AA,SHOUKRY MS,HANNO AG,et al.Repeated transurethral resection of recurrent superficial bladder tumors-does it affect the spread and stage of the tumor?[J].Scand J Urol Nephrol,2002,36(1):60-64.
[23] SHARIAT SF,PASSONI N,BAGRODIA A,et al.Prospective evaluation of a preoperative biomarker panel for prediction of upstaging at radical cystectomy[J].BJU Int,2014,113(1):70-76.
[24] TILKI D,REICH O,SVATEK RS,et al.Characteristics and outcomes of patients with clinical carcinoma in situ only treated with radical cystectomy:an international study of 243 patients[J].J Urol,2010,183(5):1757-1763.
[25] TAKAOKA E,MATSUI Y,INOUE T,et al.Risk factors for intravesical recurrence in patients with high-grade T1 bladder cancer in the second TUR era[J].Jpn J Clin Oncol,2013,43(4):404-409.
[26] KUNIEDA F,KITAMURA H,NIWAKAWA M,et al.Watchful waiting versus intravesical BCG therapy for high-grade pT1 bladder cancer with pT0 histology after second transurethral resection:Japan clinical oncology group study(JCOG1019)[J].Jpn J Clin Oncol,2012,42(11):1094-1098.

