ALDH2在肾透明细胞癌中的表达及临床意义
范龙龙,王 燕,史本涛,周靖程,郑文忠,张士强,张恩溥,程 冉,朱昱宏,马洪飞,张 洋,李贤新,4
(1.深圳北京大学香港科技大学医学中心、北京大学深圳医院,广东深圳 518036;2.中山大学附属第七医院,广东深圳 518107;3.罗湖区人民医院,广东深圳 518001;4.深圳市孙逸仙心血管医院,广东深圳 518112)
肾癌(renal cell carcinoma,RCC)最常见的类型是透明细胞癌[1],全球每年超过10万人死于肾癌[2]。但是肾癌的发病机制仍然不是很清楚。根治性肾切除手术是早期RCC有效治疗方法,由于早期缺乏特异性的诊断标志物,RCC初诊时高达20%~40%患者已出现转移,术后有20%~40%患者出现复发。近年来,分子靶向治疗在中晚期RCC患者治疗中取得一定疗效,但由于肾癌对放、化疗不敏感,临床上仍缺乏有效的术后辅助治疗方法[3]。
人类ALDH2基因(Aldehyde dehydrogenase 2,又名ALDM、ALDHI或 ALDH-E2)位于染色体12q24.2,全长43 099 bp,包含13个外显子[4]。人ALDH2 mRNA长约1 635 bp (NM_001204889.1),编码一个470个氨基的蛋白质(NP_001191818.1)。该基因属于人类醛脱氢氧化酶家族,是乙醇氧化过程中重要的酶[5]。文献显示,ALDH2在肝癌、食管癌、胃癌等均低表达[6],未见在肾癌中的深入研究。本研究组在前期分析10例肾透明细胞癌及癌旁正常组织的转录组测序结果,发现ALDH2基因的表达在癌组织中显著下调[7],现进一步检测其在肾癌组织及其癌旁组织中ALDH2的表达,并分析其表达与患者临床病理特征的相关性,探讨ALDH2在肾癌发生发展中的作用机制。
1 材料与方法
1.1材料
1.1.1组织标本 选取2012年9月至2014年9月深圳重大疾病临床资料与样本库中的17例肾癌和配对癌旁组织(取自根治性肾切除术距肾癌组织>2 cm的肾组织),均得到医院医学伦理委员会批准,患者签署知情同意书。每对标本包括肾癌组织及癌旁正常组织各1份,经北京大学深圳医院病理科病理切片证实肾癌组织均为肾透明细胞癌,且含肾癌细胞80%以上,癌旁组织中无癌细胞。标本切除后立即放入RNA保护液中,然后置于-80 ℃冰箱中以备后用。
1.1.2组织芯片 90例肾透明细胞癌及癌旁一一对应的组织芯片,购于上海芯超生物科技有限公司,临床资料基本完整,年龄在29~82岁,平均年龄为59岁。肾癌病理分级参考Fuhrman分级[8],临床分期参考国际抗癌联盟(Union for International Cancer Control,UICC)的临床分期(tumor node metastasis,TNM)。
1.2方法
1.2.1实时荧光定量PCR(quantitative real-time PCR,qPCR)检测ALDH2表达 采用Trizol试剂提取组织或细胞总RNA。进行定性和定量分析后,采用Super Script Ⅲ First-Strand Synthesis System试剂盒,按照说明书进行总RNA的逆转录。使用实时荧光定量PCR检测ALDH2的表达。采用SYBR®GreenER®qPCRSuperMix Universal试剂盒,按说明书进行。ALDH2引物为(正向:CCAACCAGCAGCCCGAGGTC;反向:AAGGCCTTGTCCCCTTCAGCTACC)。β-actin作为对照(正向:GGCACCACACCTTCTACAATGAG;反向:GGATAGCACAGCCTGGATAGCA)。
1.2.2免疫组化检测ALDH2蛋白表达 含90例肾癌和癌旁一一对应的组织芯片,梯度乙醇逐级水化。3%H2O2室温孵育10~15 min以消除内源性过氧化物酶的活性。将芯片或切片放入盛有0.01 mmol/L枸橼酸盐缓冲液的容器中,置微波炉内加热修复抗原。正常血清室温封闭30 min。加1∶8 000稀释的ALDH2抗体(Abcam)4 ℃过夜,二抗37 ℃孵育60 min。二氨基联苯胺(diaminobenzidine,DAB)显色,显微镜下观察并及时终止反应。苏木素复染,1%盐酸乙醇分化,温水返蓝。常规脱水透明,中性树脂封片,镜检分析[9]。
观察阳性细胞染色强度计数阳性细胞百分数并进行评分:1分为阳性细胞百分率≤25%;2分为阳性细胞百分率25%~50%(含50%);3分为阳性细胞百分率50%~75%(含75%);4分为阳性细胞百分率75%~100%(含100%)。染色强度计算分数主要根据平均吸光度,分为以下梯度:1分、2分、3分。结果取两者评分的乘积计总分,总分<6分为低表达组,≥6分为高表达组。
1.2.3分析ALDH2表达与临床病理特征的关系 90例组织芯片的免疫组化结果,有3例脱片,所得结果为87例患者的肾癌及癌旁组织ALDH2表达情况。根据上述总得分将87例患者分为高表达组和低表达组,分别对性别、年龄、肿瘤大小、肿瘤位置、病理分级、临床分期进行分析。
1.2.4分析ALDH2的表达水平与患者术后累计无瘤生存率的关系 绘制Kaplan-Merier曲线分析ALDH2的表达水平与肾癌患者术后2~106个月累积无瘤生存率的关系、使用癌症基因组图谱(the cancer genome atlas,TCGA)数据库制作ALDH2对肾癌预后的生存曲线。
1.3统计学方法采用SPSS20.0软件包对实验结果进行统计分析。采用配对t检验比较17例肾癌组织及配对癌旁组织的qPCR结果。在87例肾透明细胞癌和癌旁组织间,ALDH2的表达比较采用配对卡方检验。各临床病理参数间ALDH2表达水平的比较采用卡方检验。用graphpad prism 6根据生存资料绘制Kaplan-Meier生存曲线,采用Log-Rank检验进行生存分析。P<0.05表示差异有统计学意义。
2 结 果
2.1在肾癌组织中ALDH2mRNA低表达采用qPCR技术,检测17对肾癌和癌旁组织中ALDH2的表达水平,结果显示差异具有统计学意义,肾癌组织相比癌旁组织明显ALDH2表达降低(P<0.05,图1)。
2.2ALDH2在肾癌组织中的蛋白表达检测87例肾透明细胞癌组织和癌旁中ALDH2蛋白表达。对统计数据进行配对卡方检验,结果差异有统计学意义(P<0.05,表1)。ALDH2蛋白阳性表达定位主要位于细胞质(图2)。
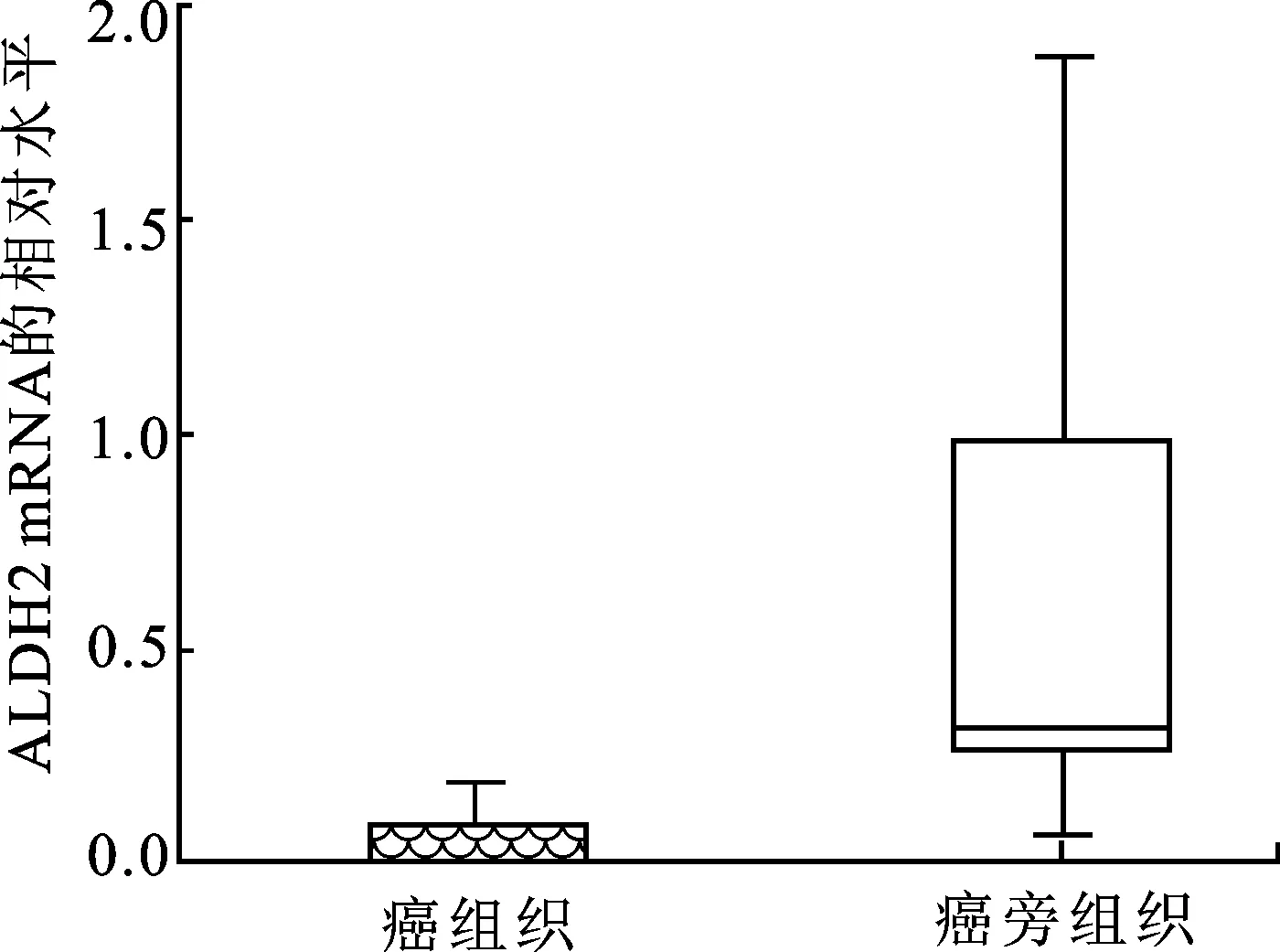
图1qPCR检测癌和癌旁组织ALDH2mRNA的表达
肾癌与癌旁组织比较,P<0.05。

表1 ALDH2在87例肾癌及癌旁组织中的表达 (例)

图2 ALDH2在肾癌及癌旁组织中的表达(×200,标尺:100 μm)
A:肾癌组织。箭头所示为阳性表达细胞,ALDH2蛋白在癌组织染色浅,相比癌旁组织表达明显减少;B:癌旁组织。箭头所示为阳性表达细胞,ALDH2蛋白主要表达在肾小管周围,胞质中,相比癌组织表达明显增强。
2.3ALDH2的表达水平与肾癌临床病理特征的关系整理ALDH2不同表达水平组及肾癌临床病理参数(表2)。在年龄<59岁和≥59岁的肾癌组织中,两组低表达率分别为63.64%(28/44)和53.49%(23/43),二者比较差异无统计学意义(表2)。在男性和女性肾癌组织中,ALDH2低表达率分别为57.14%(28/49)和60.53%(23/38),差异无统计学意义(P>0.05)。在TNM分期中,有完整TNM分期信息的例数是83例,T1期和>T1期的低表达率分别为57.38%(35/61)、63.64%(14/22),两组比较差异无统计学意义(P>0.05)。在Fuhrman分级Ⅰ级和>Ⅰ级的两组肾癌组织中,低表达率分别为57.78%(26/45),78.57%(33/42),两组比较差异有统计学意义(P<0.05)。在肿瘤直径≥5.8 cm和<5.8 cm两组中,低表达率分别为56.86%(29/51)和61.11%(22/36),两组间的差异没有统计学意义。在左肾和右肾肿瘤组中,两组低表达率分别为63.41%(26/41)和52.17%(24/46),差异无统计学意义(P>0.05)。
2.4ALDH2的表达水平与肾癌患者术后2~106个月累积无瘤生存率的关系统计完整随访信息的79例患者,其中失访1例,ALDH2高表达组32例,失访0例,随访结束时存活10例;ALDH2低表达组47例,失访1例,随访结束时存活20例。绘制Kaplan-Merier曲线(图3A),Log-rank检验结果,P>0.05。使用TCGA(The Cancer Genome Atlas)数据库制作ALDH2对肾癌预后的生存曲线(图3B)。
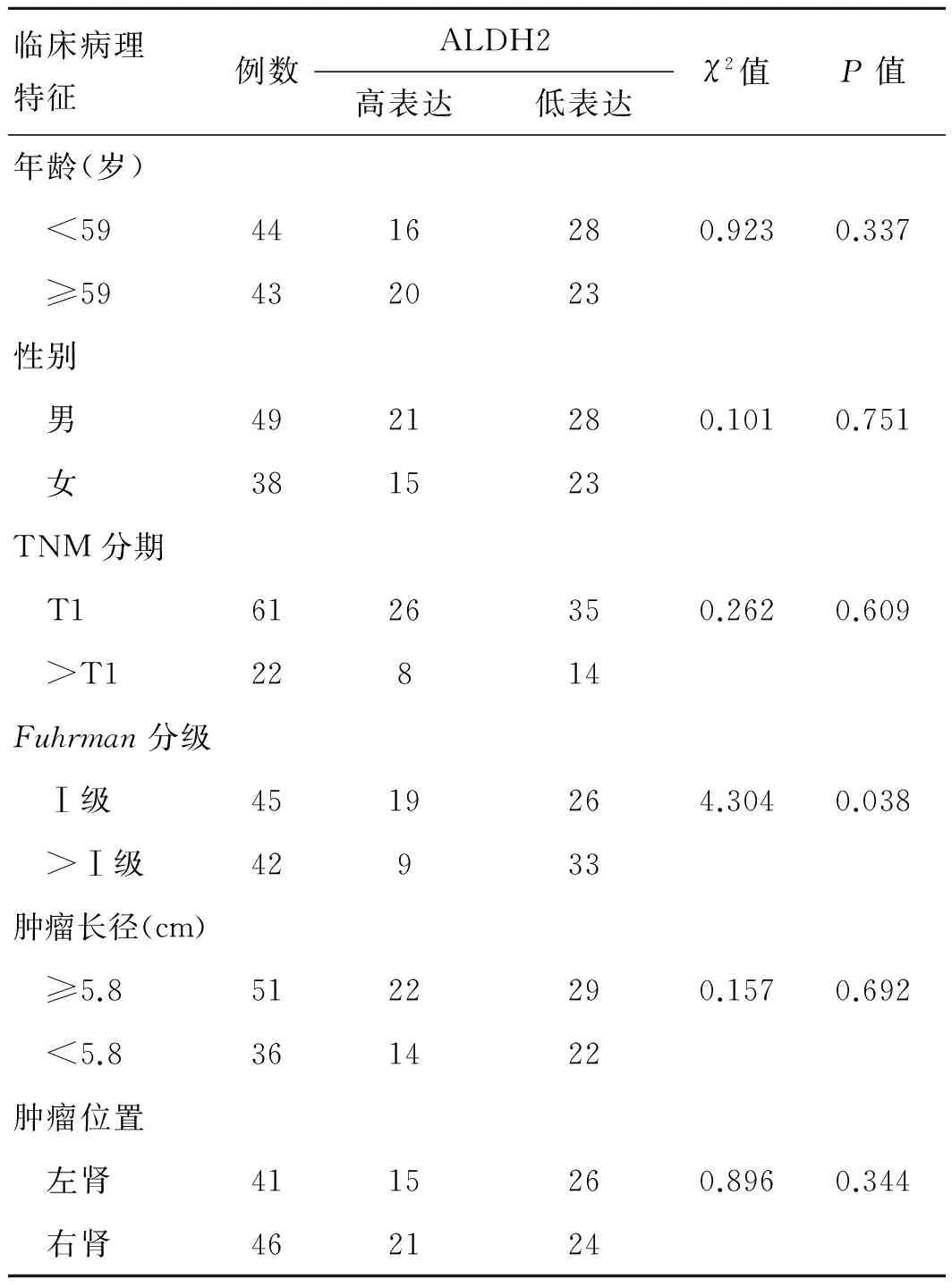
表2 ALDH2在肾癌组织表达与临床病理特征的关系 (例)
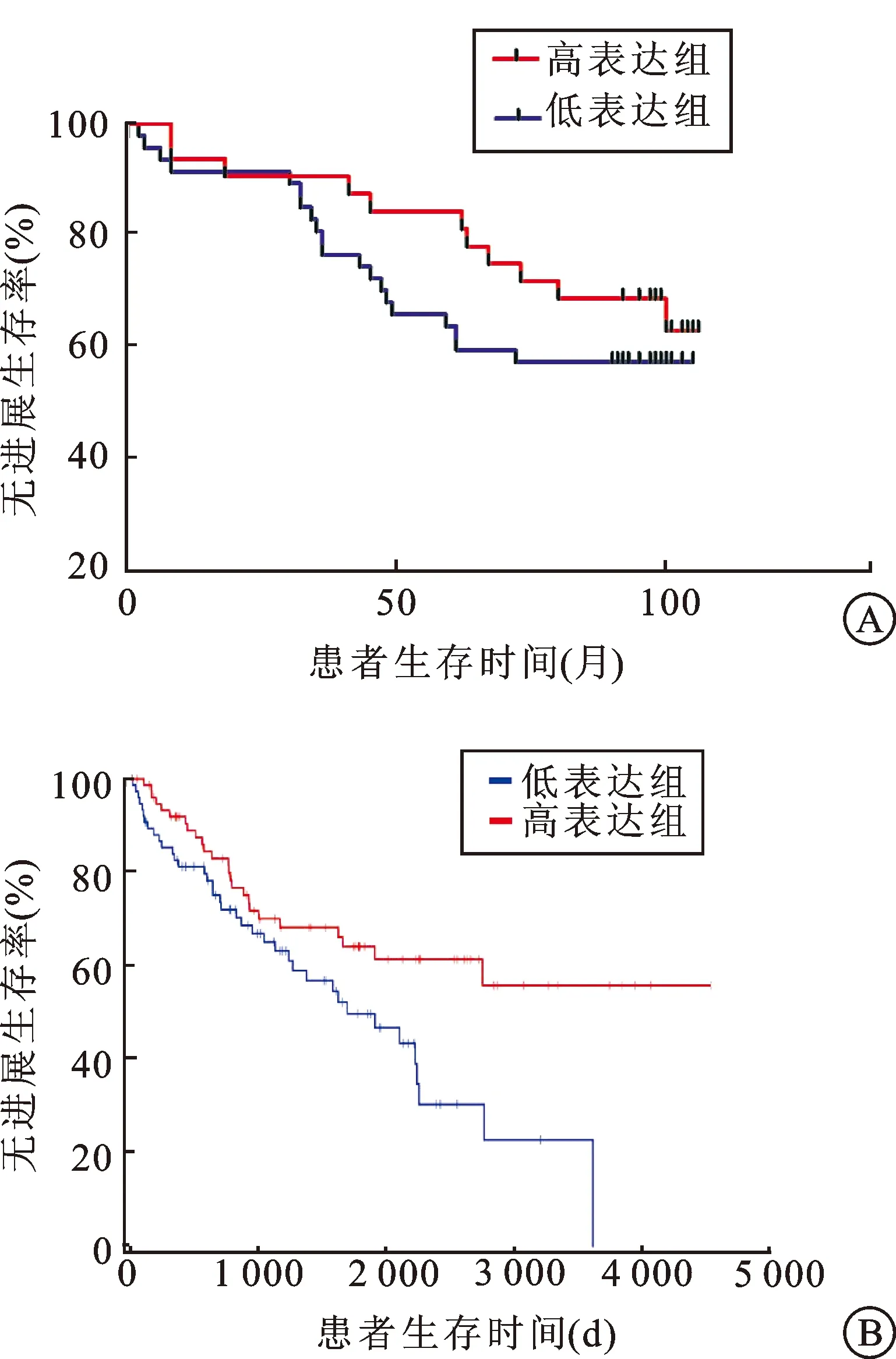
图3 ALDH2不同表达组与肾癌患者的生存曲线
A:样本量为79例,P>0.05;B:来源于TCGA数据库,样本量为144例,P=0.012 4。
3 讨 论
RCC占成人恶性肿瘤的2%~3%,起源于肾小管上皮细胞,约占全部肾脏恶性肿瘤的85%,是泌尿系统高发性肿瘤,具有易漏诊、易转移、恶性程度高、晚期RCC治疗手段少、预后差等特点[10-11]。 RCC中75%~80%是肾透明细胞癌(clear cell renal cell carcinoma,ccRCC),且20%~30%的ccRCC患者首次诊断时存在转移[12]。已知75%~85%的肾细胞癌是高度血管化的肿瘤,一些促进血管生成的生长因子受体过度表达或活化与肾细胞癌发生发展和转移密切相关。肾癌的发生发展与抑癌基因VHL缺失引起的膜受体细胞信号通路异常密切有关。有研究报道过表达肾透明细胞癌786-O细胞中的VHL基因,ALDH2的表达也随之增高;敲低caki-1中的VHL基因,ALDH2的表达随之减少[13]。说明VHL是调控ALDH2表达的靶基因之一。
ALDH2是位于线粒体内的乙醛脱氢酶家族的一员,是体内参与乙醇代谢的关键酶,主要是催化致癌物质乙醛代谢为无毒性的乙酸,在肝脏、心脏、脑以及肾脏中表达丰富。目前的研究报道,ALDH2在肝癌组织中相对癌旁组织低表达[14];西南地区人群中,主要乙醇代谢酶基因多态性与结直肠癌易感性相关[15];ALDH2基因的突变及功能的缺失与消化系统肿瘤发生及发展有关;ALDH2基因多态性增加饮酒人群患头颈部肿瘤的风险[16]。LANG等[17]研究发现三维结构突变型ALDH2能够催化静脉血管中硝酸甘油(glyceryl trinitrate neoplasia,GTN)的活化,使血管内一氧化氮浓度升高,致使血管舒张。一氧化氮在肿瘤环境中的多重作用与异质细胞反应有关,特别是在由缺氧诱导因子一1α(hypoxia inducible factor-1α,HIF-1α)和p53介导的应激反应的调节中,通常导致肿瘤细胞生长停滞、凋亡或适应,因此一氧化氮可以抑制或促进肿瘤的进展或转移,其作用的差别取决于一氧化氮的暴露时间和剂量[18-19]。ALDH2在多种肿瘤中的研究报道提示ALDH2可能是一个抑癌基因,但是在肾癌中的作用未见报道,本研究在肾癌组织和癌旁组织的对比发现ALDH2在肾癌组织中特异性低表达,提示ALDH2可能是一个肾癌保护性基因。
本研究在87例肾癌组织中研究发现,在TNM分期中,去除4例无TNM分期的组织,在83例组织标本中,由于T2期、T3期相对T1数目偏少,故分为T1期和>T1期两组进行分析讨论,两组差异无统计学意义。在病理分级的分析中也是因为这个原因分为Ⅰ级和>Ⅰ级进行讨论,统计结果有显著差异。前期通过TCGA网站预测发现ALDH2对肾癌的生存曲线是有统计学意义的(图3B),在进行生存分析的过程中,87例病例信息有8例无随访资料,故统计79例含随访资料的结果,可能是由于样本数量还是偏少,导致本次研究未得出明显统计学差异的生存分析(图3A)。为进一步深入研究ALDH2与肾癌发生的关系,我们将进一步扩大样本量,并深入探究ALDH2低表达对肾癌细胞生物学行为的影响以及相关信号通路的调控。
综上所述,本研究结果显示,肾癌组织和癌旁组织比较,ALDH2不仅在蛋白水平上表达显著降低,而且在mRNA水平上也显著降低,且差异都具有统计学意义(P<0.05),这些结果说明了,伴随着肾癌的发生,ALDH2基因表达在转录水平上受到了抑制。本研究进一步发现ALDH2的低表达与肾癌病理分级负相关,根据TCGA数据库的分析预测ALDH2低表达者的预后较差,提示ALDH2可能作为一项新的诊断肾癌的分子标记物,并且为肾癌预后提供潜在的参考意义。如果能在肾癌中找到影响ALDH2基因表达的更多上下游调控因子,不只对肾癌发病机制的理论有重要意义,而且也能为研发干预治疗药物提供新的方向,这一发现也将具有重要的潜在临床意义。
参考文献:
[1] 刘耀雷,秦书娟,王继征,等.Polo样激酶1在肾癌组织中的表达及其抑制剂BI2536对肾癌细胞株A498增殖的影响[J].中华泌尿外科杂志,2016,37(3):219-222.
[2] GUO XQ,ZHANG,QX.The emerging role of histone demethylases in renal cell carcinoma[J].J Kidney Cancer VHL,2017,4(2):1-5.
[3] 陈琛,郑文忠,李贤新,等.SMTNL2在肾细胞癌中的研究进展[J].当代医学,2015,21(14):7-9.
[4] GHOSH S,BANKURA B,GHOSH S,et al.Polymorphisms in ADH1B and ALDH2 genes associated with the increased risk of gastric cancer inWest Bengal,India[J].BMC Cancer,2017,17(1):782.
[5] 哈斯图雅,毕力夫,苏秀兰.乙醛脱氢酶2(ALDH2)基因研究进展[J].中国优生与遗传杂志,2007,15(5):3-4.
[6] 罗怀容,张亚平,等.乙醛脱氢酶2(ALDH2)基因研究进展及其与饮酒行为的关系[J].遗传,2004,26(2):263-266.
[7] ZHOU L,CHEN JH,LI ZZ,et al.Integrated profiling of micrornas and mrnas:micrornas located on xq27.3 associate with clear cell renal cell carcinoma[J].PLoS One,2010,5(12):e15224.
[8] BADOWSKA-KOZAKIEWICZ AM,BUDZIK MP,KOCZKODAJ P,et al.Selected tumor markers in the routine diagnosis of chromophobe renal cell carcinoma[J].Arch Med Sci,2016,12(4):856-863.
[9] YU L,WANG GY,ZHANG Q,et al.Karyopherin alpha 2 expression is a novel diagnostic and prognostic factor for colorectal cancer[J].Oncol Lett,2017,13(3):1194-1200.
[10] MINOR EA,COURT BL,YOUNG JI,et al.Ascorbate inducesten-eleven translocation (Tet) methylcytosine dioxygenase-mediated generation of 5-hydroxymethylcytosine[J].J Biol Chem,2013,288(19):13669-13674.
[11] 唐晓龙,李冠儒,贾占奎,等.碳酸酐酶Ⅸ在肾癌中的表达及临床意义[J].中华实验外科杂志,2013,30(6):1116-1118.
[12] SCHANZA LM,SELES M,STOTZ M,et al.MicroRNAs Associated with von hippel-lindau pathway in renal cell carcinoma:a comprehensive review[J].Int J Mol Sci,2017,18(11).
[13] GAO Y,WU Z,XIE L,et al.VHL deficiency augments anthracycline sensitivity of clear cell renal cell carcinomas by down-regulating ALDH2[J].Nat Commun,2017,8:15337.
[14] 谢宵梦.ADH1和ALDH2基因在男性肝癌患者中的异常表达及其与患者的预后关系分析[D].郑州:郑州大学,2016.
[15] 杨桓.主要乙醇代谢酶编码基因及JWA基因单核苷酸多态性与结直肠癌遗传易感性的关联研究[D].重庆:第三军医大学,2009.
[16] 陈传萍,李鲁平,ALDH2基因rs671多态性与饮酒人群肿瘤易感性之间相关性的研究进展[J].中华医学遗传学杂志,2015,32(1):113-116.
[17] LANG BS,GORREN AC,OBERDORFER G,et al.Vascular bioactivation of nitroglycerin by aldehyde dehydrogenase-2:reaction intermediates revealed by crystallography and mass spectrometry[J].J Biol Chem,2012,287(45):38124-38134.
[18] MUNTANE J,MATA L.Nitric oxide and cancer[J].World J Hepatol,2010,2(9):337-344.
[19] 肖文,袁长斐,熊之勇,等.神经型一氧化氮合酶在肾透明细胞癌中的表达及判断临床预后的价值[J].中华泌尿外科杂志,2017,38(7).

