前列腺癌经典内分泌治疗安全共识
(中国医促会泌尿健康促进分会;中国研究型医院学会泌尿外科学专业委员会)
我国前列腺癌的发病率虽然低于西方国家,但随着人口老龄化、人群健康意识提高、饮食结构改变及前列腺特异性抗原(prostate specific antigen,PSA)检查的临床应用,其检出率逐年升高,并正在成为影响我国男性健康的重要恶性肿瘤[1-2]。
与欧美前列腺癌人群不同的是,中国前列腺癌患者中晚期、转移性前列腺癌患者的比例更高[3]。
1941年HUGGINS[4]首次报道前列腺癌细胞生长依赖雄激素,并应用睾丸切除手术治疗晚期前列腺癌取得惊人疗效,手术切除双侧睾丸的外科去势手术随即成为治疗前列腺癌的标准方法。HUGGINS因此获得了1966年的诺贝尔医学奖。1971年人类首次分离得到了黄体生成素释放激素(luteinizing hormone-releasing hormone,LHRH)[5],并于1977年荣获诺贝尔医学奖,为人工合成LHRH激动剂(LHRH agonist,LHRHa)、开创前列腺癌内分泌治疗药物去势新时代奠定了重要的理论基础[6-7]。
为了进一步抑制前列腺癌患者机体下丘脑-垂体-睾丸轴以外雄激素的作用,甾体类(雌激素、孕酮等)和非甾体类抗雄药物(比卡鲁胺、氟他胺、尼鲁米特)先后被尝试在前列腺癌内分泌临床治疗中与手术/药物去势联合应用(combined androgen blockade,CAB)。由于非甾体类药物在疗效和安全性方面的明显优势[8],非甾体类药物已经成为前列腺癌联合内分泌治疗的首选。
尽管由LHRH激动剂、睾丸去势手术和非甾体类/甾体类抗雄药物单独或联合使用已经成为治疗前列腺癌的经典方案,但如何针对前列腺癌的不同阶段、不同治疗目的、不同病理类(亚)型及不同患者采用安全合理的内分泌治疗方案仍需引起医患双方的高度重视。
本共识将从条件保障、人员培训、内分泌治疗适应证和治疗方案的合理化选择、内分泌治疗并发症防治和患者管理等方面,以安全为主线,多角度推荐前列腺癌患者经典内分泌治疗的原则意见,希望本共识能使经典的前列腺癌内分泌治疗方案在中国前列腺癌患者治疗中得到更加合理、安全的应用,造福患者。
1 医院及科室开展内分泌治疗的条件保障
1.1医院及科室的组织架构前列腺癌内分泌治疗是贯穿前列腺癌整个病程的重要临床治疗方案。目前,国内前列腺癌患者人群特征仍然以中老年、中晚期为主,患者合并症较多、门诊访视意识不强、病情复杂多变,医患双方临床内分泌治疗决策制定及方案执行力有待加强。内分泌治疗在以门诊治疗为主要模式的背景下,如何实现方案的合理化选择、疗效和毒副反应的精细化管理是所有临床医护人员应该面对的重要问题。开展内分泌治疗的医疗单位和相关临床科室切实可行的条件保障,将是保证安全有效实施内分泌治疗的重要前提。
1.1.1医院保障
专家共识推荐:与会专家一致认为,前列腺癌的内分泌治疗应该在专科(泌尿外科或泌尿肿瘤科)医师指导下进行。由于前列腺癌大都病程长且复杂多变,推荐开展前列腺癌内分泌治疗的医院应该具备多学科会诊机制及疑难危重病例多学科讨论机制。医院应具备处置前列腺癌患者肿瘤相关及内分泌治疗相关严重不良反应的应急处理机制。有条件的单位,建议组建前列腺癌多学科诊疗团队(mutidisciplinary treatment,MDT)和专科护理团队,进一步保证前列腺癌及内分泌治疗的全程一体化管理。
1.1.2科室管理
专家共识推荐:开展前列腺癌内分泌治疗的科室应该具备制定针对不同人群、不同疾病阶段的规范化内分泌治疗方案的临床决策能力; 应该具备保证包括内分泌治疗在内的前列腺癌治疗方案顺利实施的临床执行能力; 应该具备保证及时有效处理内分泌治疗不良事件的临床应急处理能力; 以及开展针对不同治疗目的、不同前列腺癌阶段内分泌治疗新方案的临床探索能力。
1.2医护人员的配置前列腺癌内分泌治疗方案多、药物种类多、相关毒副反应差异性较大。从事前列腺癌内分泌治疗的相关医护人员应接受过规范的专科培训,并掌握前列腺癌各阶段特点、不同内分泌治疗方案的适应证和禁忌证、内分泌治疗方案选择和剂量疗程、不同内分泌治疗药物或方式的毒副反应及处理原则,以及与接受内分泌治疗的前列腺癌患者进行身心教育的沟通能力。实施手术去势的外科医师必须取得外科医师执业证书,实施药物去势的相关护理人员则需要经过去势药物注射的专门培训并熟练掌握不同去势药物注射的有关技术。
专家共识推荐:前列腺癌内分泌治疗要求专业的医护人员,他们必须熟练掌握前列腺癌疾病特点、内分泌治疗适应证/禁忌证、内分泌治疗方案选择和剂量疗程制定、内分泌治疗毒副反应的防治等,同时做好患者的身心健康教育,最终保证患者的内分泌治疗安全。
1.3患者的教育及管理前列腺癌患者整体生存期较长,大量患者在接受治疗过程中会短期或长期接受内分泌治疗,且绝大多数接受内分泌治疗的患者是门诊用药,有针对性的开展充分的患者教育及管理极为重要。通过与患者的定期交流,可以提高患者对自身疾病的认知,提升患者治疗和随访的依从性,及时发现并处理内分泌治疗过程中的毒副反应,实现前列腺癌的全程、全面追踪和管理[9]。多数与会专家认为,有条件的医院及科室鼓励建立前列腺癌专科医疗护理团队,配备专业的患者管理专员或专职人员,建立规范的前列腺癌随访制度和随访流程,以患者教育、会谈、小组讨论、电话及网络等方式完成对患者治疗相关安全数据的收集、分析及全程管理。
患者教育内容包括但不限于: 前列腺癌疾病状态、内分泌治疗(包括药物或手术去势及抗雄药物)的必要性和优劣、规范化内分泌治疗方案的选择及副作用、肿瘤预后判断及疗效评价、肿瘤定期随访的重要性和随访内容、患者报告的肿瘤治疗结局(生活质量及疼痛等)等方面。
专家共识推荐:应重视内分泌治疗患者的教育及全程管理,方能保证患者的依从性和治疗的连续性。建议建立规范完善的患者随访制度,对前列腺癌患者全程治疗进行随访监管,为医患双方提供疾病信息和身心支持,从而进一步提高患者对内分泌治疗的依从性。
2 实施操作
2.1内分泌治疗前患者评估、内分泌治疗适应证及方案的合理化选择
2.1.1内分泌治疗前患者评估 在确定内分泌治疗方案前,全面系统地评估患者的治疗前基线状态和疾病状态是实现内分泌治疗安全的重要体现。前列腺癌患者治疗前体力状态的美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、血生化指标(包括:血红蛋白、白细胞、血小板、碱性磷酸酶等)、重要脏器功能状态以及合并症和合并用药等,均可能影响内分泌治疗方案的临床运用和安全性评测。更为重要的是,随着高危局限性前列腺癌、寡转移性前列腺癌、非转移性去势抵抗性前列腺癌等概念的提出,以及伴随而来的治疗理念的更新,采用更规范、更先进、更精准的检测手段/技术和临床评估标准,更为准确的评估前列腺癌患者治疗前的肿瘤状态,将会很大程度上决定包括内分泌治疗在内的前列腺癌治疗方案的制定和临床实施的有效性。前列腺癌内分泌治疗适应证选择不当将必然带来后续的安全隐患。
专家共识推荐:推荐前列腺癌患者在确定内分泌治疗方案前均需完成对患者身体和疾病基线状态的评估;推荐所有患者在确定治疗方案前利用磁共振成像(magnetic resonance imaging,MRI)、骨显像、计算机断层扫描(computed tomography,CT)、正电子发射断层显像/X线计算机体层成像(positron emission tomography/X-ray computation of body layer imaging,PETCT),甚至前列腺特异性膜抗原-PETCT(prostate specific membrane antigen PETCT,PSMA-PETCT)、磁共振全身成像(whole-body MRI)等检查手段及肿瘤相关血生化指标如前列腺特异抗原(prostate-specific antigen,PSA)、睾酮等,准确全面评估肿瘤状态;推荐采用美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)或欧洲泌尿外科协会(European Association of Urology,EAU)的风险评估模型评估局限性前列腺癌患者的疾病风险;推荐参考现有标准评估转移性前列腺癌患者的肿瘤负荷状态,并鼓励有条件的中心探索适合中国人群的肿瘤负荷评估标准;强调针对可能长期接受内分泌治疗患者,尤其是合并骨转移患者骨质密度(dual energy X-ray absorptiometry,DEXA)和骨折风险(fracture risk assessment tool,FRAX)的评估; 以及心脑血管和代谢等基础疾病的评估。
2.1.2局限性前列腺癌的内分泌治疗适应证和方案的合理化选择 局限性前列腺癌内分泌治疗方案的临床模式包括:前列腺癌根治性放疗联合内分泌治疗;前列腺癌根治手术联合辅助内分泌治疗;前列腺癌根治性手术联合辅助放疗和内分泌治疗; 前列腺癌根治性手术术前新辅助内分泌治疗或新辅助内分泌联合化疗。
大量前瞻性临床研究证实[10-13],高危局限性前列腺癌患者接受前列腺癌根治性放疗同时,联合长疗程的内分泌治疗可以明显延长患者生化复发的时间; 而中危局限性前列腺癌患者接受根治性放疗时,联合4~6个月的短程内分泌治疗即可延长此类患者的总生存期和前列腺癌特异性生存期[14-16]。但低危局限性前列腺癌患者仅需接受单纯放疗即可获得良好的长期生存。
专家共识推荐:针对接受根治性放疗的局限性前列腺癌患者,需根据患者的复发风险决定是否同期联合内分泌治疗及内分泌治疗的疗程。低危患者根治性放疗时无需联合内分泌治疗,中危患者根治性放疗时建议同期联合短疗程内分泌治疗;高危患者根治性放疗时建议同期联合长疗程内分泌治疗。
长期随访的临床证据显示[17-18],前列腺癌根治手术术后发现淋巴结阳性转移的患者,长期接受辅助内分泌治疗可以明显延长患者的总生存期。虽然针对根治术后病理切缘阳性、T3期或GS8-10 等不良预后因素的患者还没有充足证据显示辅助内分泌治疗的生存获益[19-20],但2017年ASCO-GU会议上有关S9921研究的最新报道则显示了高危局限性前列腺癌根治术后辅助内分泌治疗的良好生存获益[21]。
专家共识推荐:对于根治术后淋巴结阳性的患者,推荐长疗程辅助内分泌治疗;对于根治术后具有其他不良因素的患者,大部分专家建议术后应及时全面评估患者肿瘤复发风险。对高复发风险患者,应在充分考虑患者身体状况和意愿后,尽早制定个性化的术后辅助治疗方案,多数专家推荐长疗程内分泌治疗或辅助放疗联合内分泌治疗。
对于内分泌治疗甚至内分泌联合化疗在高危前列腺癌根治术前新辅助治疗中的价值尚存在争议[22-25],通过对多项前瞻性小样本临床研究的系统评价至少证实新辅助内分泌/联合化疗能够获得更低的切缘阳性率和无生化复发生存时间等临床结局指标[26-27]。 值得注意的是,内分泌治疗作为新辅助治疗在根治性放疗中的作用得到了前瞻性临床研究的证实[15,28]。
多数专家建议:前列腺癌根治术前的新辅助治疗应在患者充分了解其潜在获益以及安全性风险的情况下,选择适当患者人群应用;对于根治性放疗的患者,放疗前的新辅助内分泌治疗方案值得推荐,并建议可以考虑6个月的内分泌治疗疗程。
对于预期寿命小于10年、高龄、伴发其他严重疾病、不适合或拒绝接受局部治疗的局限性前列腺癌患者,单纯内分泌治疗也是一种选择。但临床观察结果显示:不同风险度局限性前列腺癌患者接受单纯内分泌治疗的临床获益差异较大,与观察等待或主动监测相比,低危局限性患者似乎无法从单纯内分泌治疗中获得更多的生存获益[29-30]。
多数专家建议:在不具备接受根治性治疗的情况下,中高危局限性前列腺癌患者在充分评估风险的基础下可选择单独内分泌治疗。
2.1.3根治性治疗后生化复发患者内分泌治疗适应证和方案的合理化选择 局限性前列腺癌患者在接受前列腺癌根治性治疗后8~10年生化复发率约16%~22%[31-32],而高危局限性前列腺癌患者5~8年生化复发率则高达40%以上[32-33]。对于根治手术术后生化复发患者,补救性放疗结合内分泌治疗(短期单纯去势或长疗程非甾体抗雄药物)与单纯补救性放疗相比可以使患者有更好的生存获益[34-35]。作为辅助治疗,间歇性内分泌治疗在降低毒副反应的同时,并不影响辅助治疗效果[36]。
专家共识推荐:对于接受补救性放疗的根治术后生化复发患者,推荐同期联合3个月单纯去势治疗或2年大剂量比卡鲁胺口服,以增加补救性放疗的疗效; 若考虑长疗程内分泌治疗,间歇内分泌治疗也有相当的临床疗效。对根治术后生化复发患者单独使用内分泌治疗的长期疗效需要更大样本的前瞻性研究进一步证实。
2.1.4晚期/转移性前列腺癌内分泌治疗适应证及方案合理化选择 内分泌治疗一直是晚期/转移性前列腺癌的标准治疗方案,为了进一步改善患者的总体生存,新的治疗模式一直在尝试、调整和改进之中。亚洲的临床研究数据显示,去势联合雄激素阻断治疗与单纯去势相比,可以延长转移性患者的总生存期[37-38]。2017年欧洲肿瘤内科学会议(European Society for Medical Oncology,ESMO)报道的最新文献荟萃分析结果同样提示联合内分泌治疗(去势联合雄激素阻断)与单独去势相比有生存优势[39]。
甾体类抗雄药(孕酮类、雌激素和酮康唑等)的生存获益不显著且毒副作用较大,目前临床上已很少使用。
对于转移性前列腺癌患者,间歇性内分泌治疗的疗效并不优于连续性内分泌治疗[40]。
新近的临床研究报道,去势联合新型抗雄药物或化疗在晚期转移性前列腺癌,尤其是高肿瘤负荷患者中具有延长总生存期的优越性[41-45]。NCCN和EAU先后推荐上述两种新的联合治疗可以作为转移性前列腺癌患者的标准选择。
专家共识推荐:去势联合雄激素阻断的内分泌治疗应该作为晚期/转移性前列腺癌患者的首选治疗。药物去势和手术去势疗效相当,但手术去势具有不可逆性,而且会对患者心理造成一定影响,因此越来越多的临床医生将药物去势做为临床首选。针对多种不同的联合内分泌治疗方式,在临床选择时需要综合考虑患者体力状态、基础疾病、肿瘤负荷、肿瘤分子表型、药物的毒副反应、患者经济状况及意愿等因素,尽量做到精准的个性化治疗。
2.1.5去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)内分泌治疗适应证 CRPC是前列腺癌患者病程进展的最终表现,化疗、新型抗雄药物、同位素药物以及免疫药物等可以一定程度上改善患者的总体生存。1993年TALYOR[46]研究证实,即使在CRPC阶段患者仍然需要维持去势状态。有关CRPC治疗的临床试验都是在维持去势状态下进行的。
专家共识推荐:在CRPC阶段,无论是否接受其他治疗,患者都应该继续维持去势治疗。
2.2临床操作
2.2.1手术去势的规范化操作及安全性 前列腺癌患者的手术去势是指通过实施单纯睾丸切除术或者白膜下睾丸实质剜除术的外科方式将患者的双侧睾丸切除,达到降低雄激素水平的目的。手术去势被认为是去势治疗的标准方式,其能在12 h内使血清睾酮水平迅速下降并持续维持于低水平状态[47]。尽管双侧睾丸切除手术是泌尿外科最基本的手术术式,与会专家仍一致推荐:前列腺癌患者的双侧睾丸切除手术需严格按照《吴阶平泌尿外科学》或《Campbell泌尿外科学》手术操作步骤进行[48-49],要求做好充分术前准备和评估,并详细告知患者家属该手术的必要性及危险性;术中规范化手术操作,完整剥除睾丸实质无残留,结扎止血确实,严防术中术后出血及阴囊血肿形成;对于高转移负荷患者,建议在患者转运、麻醉及复苏过程中要重视防止病理性骨折等危险的发生。
2.2.2药物去势的护理规范化操作及安全性 目前国内有3种不同的黄体生成素释放激素(luteinizing hormone releasing hormone,LHRH)激动剂药物(戈舍瑞林、曲普瑞林和亮丙瑞林),同一种药物还有不同剂型的针剂,每种不同的药物其注射操作流程不尽相同。因此,在进行去势药物注射前,护士最好经过专门的培训和学习,保证安全有效地完整注射过程。注射药物有可能发生注射反应,包括注射区域疼痛、红肿、红斑及硬结形成,极个别患者也有可能发生急性变态反应,出现过敏性休克、过敏反应、血管性水肿及荨麻疹等,注射前需要做好抢救准备[50-51]。
专家共识推荐:进行去势药物注射前,护士需仔细检查药物包装是否完整、注射针头是否弯曲、药物是否在有效期内等;严格按照“三查七对”和“无菌操作”原则进行操作;注射前应与患者充分沟通,使其了解注射可能出现的不良反应,消除对治疗的紧张和恐惧;首次接受注射的患者,详细询问过敏史,按照过敏反应抢救预案和流程充分准备抢救器材和药品;请严格按照不同类型和剂型药物说明书上操作流程完成药物的配置和注射过程。
2.3疗效评估
2.3.1生化指标评估 在内分泌治疗过程中,应尽量在同一实验室进行以PSA为主的生化指标监测,以准确评估治疗效果。
① PSA PSA及其衍生指标目前仍然是判断接受传统内分泌治疗的前列腺癌患者预后、疗效评价和监测进展的最重要指标。PSA在治疗初期的下降水平和程度与总生存期(overall survival,OS)显著相关[38,52]。对接受内分泌治疗转移性前列腺癌患者,治疗初期的PSA监测尤为重要,建议每月检测PSA。当PSA降至4 ng/mL以下,可改为每3~6个月复查PSA。在内分泌治疗全程,规律的PSA监测可及时发现患者病情变化,便于调整治疗策略。
尽管多数生化复发早于临床症状数月出现,但确有部分临床进展患者,并没有生化复发(PSA并不升高),因此,还应结合患者临床症状和影像学改变做出病情是否进展的判断。
专家共识推荐:接受内分泌治疗期间,应规律检测PSA;结合PSA变化和临床症状、影像学改变综合评估治疗效果。
②睾酮 睾酮监测是评价去势治疗(手术去势和药物去势)后血清睾酮是否达到去势水平的唯一手段。在睾酮监测指导下的内分泌治疗可显著降低治疗失败风险[53],睾酮水平亦可预测进展风险及生存情况[54]。需要检测睾酮水平的时间点至少包括:去势治疗前;去势治疗后半年内每月;接受间歇内分泌治疗患者间歇期每月或每3~6个月;发现PSA升高时;症状或影像学提示出现临床进展时;拟改变治疗方式前。
专家共识推荐:接受去势治疗的前列腺癌患者都应定期检测血清睾酮水平,以确保维持有效的去势治疗状态。
③其他化验 内分泌治疗开始后3个月,如出现血红蛋白下降等贫血症状,则患者无进展生存期(progression-free survival,PFS)和OS会明显缩短[55];碱性磷酸酶(alkalinephosphatase,ALP)升高可能与骨转移或雄激素剥夺引起的骨质疏松有关[56];肝功能监测主要用于评估内分泌治疗的肝毒性。
专家共识推荐:为保证内分泌治疗安全持续进行,建议接受治疗的患者除了在治疗前检测血红蛋白、碱性磷酸酶及其他生化指标外,在治疗期间应每3~6月或出现病情进展或相关症状时及时复查有关指标。
2.3.2影像指标评估 接受传统内分泌治疗的前列腺癌患者,若PSA正常稳定且无症状,患者在治疗前全面影像学评估后,治疗期间不需要常规进行影像学复查。当治疗过程中出现PSA升高或临床症状加重,则应进行相应的影像学检查。而对于维持去势状态的CRPC患者,则需按照前列腺癌临床试验工作组3(the Prostate Cancer Clinical Trials Working Group3,PCWG3)的影像评估标准进行相关指标的监测评估[57]。前列腺癌骨转移灶的监测尤为重要,但骨转移灶属不可测量病灶,对其评估有一定难度。同时,骨扫描结果可能受到“闪烁”现象的影响,这种“闪烁”现象发生在开始内分泌治疗后的最初8~12周,可能造成疾病进展的假阳性判断。因此,PCWG建议,使用骨扫描评价骨转移病灶进展时采用“2+2”原则评估[57]。此外,随着高危局限性前列腺癌、寡转移性前列腺癌、非转移性去势抵抗性前列腺癌等概念的提出,以及伴随而来的治疗理念的更新,影像学评估的技术手段及准确性亟待提高。
专家共识推荐:在按照常规影像指标评估原则对不同疾病阶段的前列腺癌患者进行评估以外,对一些可能接受新的治疗方案的前列腺癌患者,鼓励采用包括PSMA-PETCT、whole-body MRI等新兴检测技术更加精准地对患者病情进行评估。
2.3.3患者报告结局(patient reported outcomes,PROs)评估 近年来,医疗服务强调以患者为中心,PROs作为一种新的结局分类,由于它从患者的角度为临床研究和实践提供研究疾病活动和评价治疗效果的独特指标,已获得越来越多的研究者关注和提倡。晚期前列腺癌的PROs的评价内容包括记录患者的疼痛强度、止痛药物的剂量和方案、患者生活质量评分以及患者报告的药物治疗毒副反应等。PCWG3建议在治疗过程中,患者疼痛评分增加超过2分则可以判定PROs进展;除此以外,止痛药物的方案更改或因为疼痛需要增加其他止痛治疗方案(如放疗等),亦可以考虑为进展。PCWG3还特别强调了PROs的进展时间。目前尚无公认专门针对内分泌治疗的高质量前列腺癌患者报告结局测量工具(patient-reported outcomes measurement information system,PROMs)。
专家共识推荐:PROs是来自患者自我评价内分泌治疗疗效的重要指标,在内分泌治疗过程中,需要重视PROs的记录和分析。PROs仍然算是新鲜事物,鼓励大家组织力量开展多中心研究,建立适合中国人群的前列腺癌RPOMs。
2.4内分泌治疗不良反应的预防和处理对策雄激素具有维持认知、兴奋心理、促进肌肉骨骼发达、保持男性性欲、刺激造血等生理功能。接受内分泌治疗的患者,由于雄激素水平显著降低可能引发一系列相应并发症,包括:潮热、性欲减退、勃起功能障碍、男性乳房发育和骨矿物质密度丢失。就治疗安全性而言,勃起障碍、性欲减退和潮热是最常见的不良反应。特别需要重视的是,血中睾酮水平降低可以引起胰岛素抵抗、动脉粥样硬化、糖尿病和代谢综合征等,这些合并症的发生已经成为前列腺癌患者非肿瘤特异性死亡的最主要原因。如何预防和处理因为激素水平降低导致的并发症,保证内分泌治疗的安全性,同时又保证前列腺癌患者的肿瘤良好控制,非常值得临床医师重视和掌握。
2.4.1急性不良事件 前列腺癌内分泌治疗的急性不良事件主要与药物去势和手术去势治疗有关。尽管药物去势已经成为去势治疗的主流,但临床上仍然会有前列腺癌患者采用手术去势的治疗方式。尽管睾丸切除手术是泌尿外科的一项基本手术操作,但对于罹患前列腺癌的患者仍然具有一些特殊的风险。手术最常见的并发症是阴囊血肿;此外,需要特别提出的是,接受外科去势的前列腺癌患者多并发骨转移,而前列腺癌骨转移多以中柱骨为主,患者转运、活动甚至麻醉均有可能导致患者截瘫,需要在临床护理过程中倍加小心。这部分患者手术风险较高,在治疗前需与患者充分沟通。LHRH激动剂(戈舍瑞林、曲普瑞林、亮丙瑞林)的使用会出现血清睾酮一过性升高,继而导致发生PSA Flare(PSA闪烁)现象,在注射前2~3周,给予常规剂量或大剂量非甾体类抗雄激素药物进行预处理,以对抗睾酮的一过性升高所导致的病情加剧。
专家共识推荐:前列腺癌内分泌治疗的急性不良事件大多数是可以预防的。对于高龄、慢性贫血一般情况较差的患者,手术风险较高,推荐首选药物去势治疗。已有骨转移脊髓压迫或肿瘤相关梗阻性肾病的患者,以及年老体衰、合并症严重的患者,选择药物去势时,为避免血清睾酮水平一过性升高可能导致的病情加重,在接受药物去势治疗前常规使用非甾体类抗雄药物进行2~3周的预处理。
2.4.2骨质疏松与骨不良相关事件 前列腺癌患者多为老年男性,其骨质疏松发生率高。内分泌治疗则加速患者骨质丢失,骨吸收增加,引起骨密度下降、骨质疏松及骨质疏松相关骨折风险增加[59]。骨不良相关事件(skeleton related events,SREs)包括:为缓解骨骼疼痛或治疗、预防病理性骨折或脊髓压迫进行的放疗、病理性骨折、脊髓压迫、骨骼手术、因骨病而改变抗癌治疗及恶性肿瘤所致高钙血症等。前列腺癌骨转移发生率高,前瞻性临床研究证实,前列腺癌骨转移导致的SREs将会明显降低患者的生存率[60]。唑来膦酸和Denosumab(地诺单抗)不仅可以维持骨质密度,减少骨质疏松发生[61-63],而且还是目前唯一两个被证实可以延缓骨转移性前列腺癌患者SREs发生的药物[61,64],但遗憾的是,与标准内分泌治疗联合没有观察到延长总生存的疗效[65-66]。因此,一般并不推荐在初诊转移性前列腺癌患者中常规使用。
专家共识推荐:内分泌治疗前,建议行骨质密度测定(DEXA检查)以了解患者骨质基线水平,并在治疗后每1~2年进行骨质变化监测;建议适当体育锻炼,戒烟酒,补充钙剂及维生素D;推荐采用WHO的FRAX量表评价骨折风险,并建议骨折风险高的患者(>3%)在内分泌治疗同时联合唑来膦酸或地诺单抗治疗防治骨质疏松骨折发生; 若以预防或纠正骨质疏松为目的使用唑来膦酸时,推荐每6~12个月输注1次即可;若以延缓SREs为治疗目的使用唑来膦酸时,推荐每月输注1次标准剂量,并建议用药前评估下颌骨坏死风险和肾小球滤过功能,以保证患者安全。
2.4.3代谢相关不良事件
①潮热 潮热是手术或药物去势治疗常见的副作用,发生率约为58%~76%。典型症状为发作性脸面部及上半身伴随出汗的潮热。常见诱因包括炎热、紧张、体位改变或进食等。潮热症状在内分泌治疗过程中会一直反复出现,仅有小部分患者可自行缓解。尽管潮热发生率高,但绝大多数患者无需药物治疗。严重潮热患者,可使用激素类(甲地孕酮、甲羟孕酮)、5-羟色胺重吸收抑制剂(舍曲林、帕罗西丁)、加巴喷丁等药物治疗。但需警惕这些药物对本病治疗的影响及其他药物毒副反应[67]。极少部分症状严重的患者,可以考虑行间歇治疗甚至停药。
专家共识推荐:接受内分泌治疗期间出现潮热副作用的患者,一般不需要给予特殊处理。特别严重者可适当使用药物治疗。
②糖/脂代谢异常及代谢综合征 前列腺癌内分泌治疗后的糖脂代谢异常,以血糖、总胆固醇、低密度脂蛋白及甘油三酯升高为主要表现,有心脑血管疾病发生升高的风险[68]。研究表明,短期(12周)内分泌治疗即可降低非糖尿病患者胰岛素敏感性,而长期(12个月以上)内分泌治疗可使患者代谢综合征和糖尿病的风险分别增加75%和56%。
专家共识推荐:由于前列腺癌合并代谢综合征的患者并不少见,这类患者在接受内分泌治疗后其代谢异常加重的可能性大。因此,在启动内分泌治疗前应详细询问患者有无糖尿病等代谢综合征病史,并在病史中予以记录; 对于术前合并糖尿病或糖耐量异常的患者,治疗前应详细了解空腹血糖、糖化血红蛋白、胰岛素使用情况及肝肾功能等;接受内分泌治疗期间,注意调整饮食结构并适当锻炼,保持体重; 内分泌治疗后,应对患者血糖密切监测,尽早发现糖尿病并进行干预治疗;必要时应用降脂药物纠正脂代谢异常;对于合并代谢综合征或糖尿病的患者,内分泌治疗期间,应积极监测空腹血糖、糖化血红蛋白及血脂,必要时请内分泌专科医师协助会诊制定个性化治疗方案。
③贫血 睾酮通过下丘脑-垂体反馈系统促进促红细胞生成素的释放,并激活造血干细胞促进骨髓造血。内分泌治疗后,90%前列腺癌患者会出现不同程度的贫血,但绝大多数患者无需处理。但前列腺癌伴有严重贫血患者的死亡危险性则高达47%。因此,在内分泌治疗的同时,仍然需要关注患者的贫血情况。
专家共识推荐:前列腺癌内分泌治疗相关贫血多为正色素性贫血,一般无需处理;贫血严重但骨髓造血功能正常者,可考虑使用促红细胞生成素。
④乏力、肌肉萎缩及活动障碍 长期内分泌治疗过程中,乏力的发生率高达43%。可能与机体肌肉量减少,脂肪增加,同时合并疼痛和抑郁等原因有关。改善乏力的唯一办法是在充分进行心理疏导的基础上,鼓励患者参加体育锻炼。锻炼形式主要包括:在专业人士指导下根据患者心血管功能情况进行抗阻训练结合有氧训练(2~3次/周,连续12周);患者自行完成包括行走、慢跑、拉伸及轻度抗阻运动(3~5次/周,连续16周)[69]。
专家共识推荐:要重视内分泌治疗前的患者心理干预;推荐患者摄入优质蛋白饮食,并适当进行体育锻炼;有条件的患者可选择在专业人士指导下进行适当体育锻炼或制定适合个体的自我监督锻炼。
2.4.4心(脑)血管不良事件 心(脑)血管不良事件主要包括心肌梗死、心律失常、缺血性心脏病、心力衰竭及脑卒中等。目前,心(脑)血管事件已成为前列腺癌患者的第2位死因。去势治疗可能直接通过影响心肌细胞钙离子交换和心肌收缩力,或间接通过降低雄激素水平导致高胰岛素血症、胰岛素抵抗、高血压、异常脂代谢等机制诱导心(脑)血管疾病的发生[68]。部分基于人群的回顾性研究数据显示,前列腺癌患者,尤其是本身合并心血管基础疾病的患者,其心血管不良事件的发生率和死亡率与所接受的内分泌治疗有关[14,70-73]。但是,随后的系统评价结果发现,心血管事件在前列腺癌患者的发生与内分泌治疗之间的相关性似乎并不确定[68,74]。尽管如此,鉴于心血管不良事件的危险性,美国食品药品监督局、美国泌尿外科协会及美国心血管协会仍然建议在去势药物说明书中特别注明内分泌药物对心血管疾病影响,并提出了降低心血管不良事件发生率的一系列应对策略。
专家共识推荐:针对没有合并心血管基础疾病的患者,接受内分泌治疗期间,建议调节饮食和锻炼控制体重和体重指数;戒烟;高血压患者同时控制血压;定期监测血糖和血脂改变,早期发现糖尿病并采取适当治疗。对于合并心血管基础疾病者,应根据美国心血管协会指南,建议患者采取调节饮食、减少饱和脂肪及胆固醇摄入、控制体重、戒烟,并积极控制高血压,使用低剂量阿司匹林等综合防治措施[75],特别建议合并症较重的患者应在治疗期间同时在泌尿外科、肿瘤科和心血管内科就诊,必要时申请联合会诊。
2.4.5性功能异常 采用内分泌治疗后,由于血清睾酮水平下降导致患者性欲下降、勃起功能障碍及乳房发育等十分常见。
专家共识推荐:在开展内分泌治疗之前,医护人员需仔细评估患者的勃起功能和影响性功能的相关危险因素,深入了解患者夫妻双方对性功能的需求,并向夫妻双方详细解释治疗对性功能必然的影响,使其达到充分的心理认知。对有性功能需求的患者,可在病情允许的情况下选择间歇内分泌治疗,其他选择包括服用磷酸二酯酶-5(phosphodiesterase type 5,PDE-5)抑制剂、阴茎海绵体内注射、负压缩窄装置以及阴茎假体植入等[75]。
2.4.6身心(精神)改变 患者在接受内分泌治疗后可出现抑郁、紧张、焦虑、疲倦、易怒等情绪状态,绝大部分可在停药后恢复至基线水平。研究表明,接受内分泌治疗的患者47%~69%存在至少一个认知域的损害,如视觉空间认知能力和执行能力,严重者可发展为轻度认知功能障碍[76-77]。
专家共识推荐:医护人员需加强患者心理干预,关注患者的心理和社会需要,让患者在家人的支持下提升其生活质量;推荐抗阻练习结合有氧运动改善认知功能障碍;不推荐内分泌治疗同时口服雌二醇。
2.4.7其他非特异性改变
①水肿 内分泌治疗引起的水肿十分常见,通常开始于下肢并可能发展至全身,停药后多可缓解。重视患者血压、血清钾和体液潴留的监测,特别是对于存在充血性心力衰竭等重大风险的患者,应增加监测频率。水肿的主要治疗手段是及时合理使用利尿剂。
②肝功能异常 除甾体类抗雄药物醋酸环丙孕酮和非甾体类药物氟他胺肝毒性发生率较高外,其他内分泌治疗药物仅有偶发肝功能损害的报道,也没有报道显示内分泌治疗能加重合并肝功能损害。
专家共识推荐:胆红素高于1倍ULN,或AST/ALT>1.5倍ULN且ALP>2.5倍ULN时,应尽量避免或谨慎使用具有肝毒性的内分泌治疗药物,对合并肝功能异常的患者在用药期间建议定期复查肝功能,若肝功能损害加剧,应更换内分泌治疗药物类型或终止治疗,优先考虑保肝治疗。
编辑和执笔专家(按姓氏拼音排序)
董柏君 上海交通大学附属仁济医院泌尿外科
贺大林 西安交通大学第一附属医院泌尿外科
李名钊 中山大学附属第三医院泌尿外科
李永红 中山大学附属肿瘤医院泌尿外科
李振华 中国医科大学附属第一医院泌尿外科
刘冉录 天津医科大学附属第二医院泌尿外科
刘振华 四川大学华西医院泌尿外科
盛锡南 北京大学肿瘤医院肿瘤内科
王 龙 中南大学湘雅医院泌尿外科
王行环 武汉大学中南医院泌尿外科
魏 强 四川大学华西医院泌尿外科
吴开杰 西安交通大学第一附属医院泌尿外科
杨中华 武汉大学中南医院泌尿外科
曾 浩 四川大学华西医院泌尿外科
张 争 北京大学第一医院泌尿外科
朱 耀 复旦大学附属肿瘤医院泌尿外科
参与审稿和讨论专家(按姓氏拼音排序)
程 跃 宁波市第一医院泌尿外科
傅 强 上海市第六人民医院泌尿外科
高 新 中山大学附属第三医院泌尿外科
龚 侃 北京大学第一医院泌尿外科
黄翼然 上海交通大学附属仁济医院泌尿外科
金讯波 山东省立医院泌尿外科
孔垂泽 中国医科大学附属第一医院泌尿外科
李建兴 北京清华长庚医院泌尿外科
梁朝朝 安徽医科大学第一附属医院泌尿外科
齐 琳 中南大学湘雅医院泌尿外科
王东文 山西医科大学第一医院泌尿外科
王 健 青海大学附属医院泌尿外科
王玉杰 新疆医科大学第一附属医院泌尿外科
魏金星 郑州大学第一附属医院泌尿外科
吴小候 重庆医科大学附属第一医院泌尿外科
徐 勇 天津医科大学第二医院泌尿外科
附表1内分泌治疗用药情境的合理化选择简表[78-79]
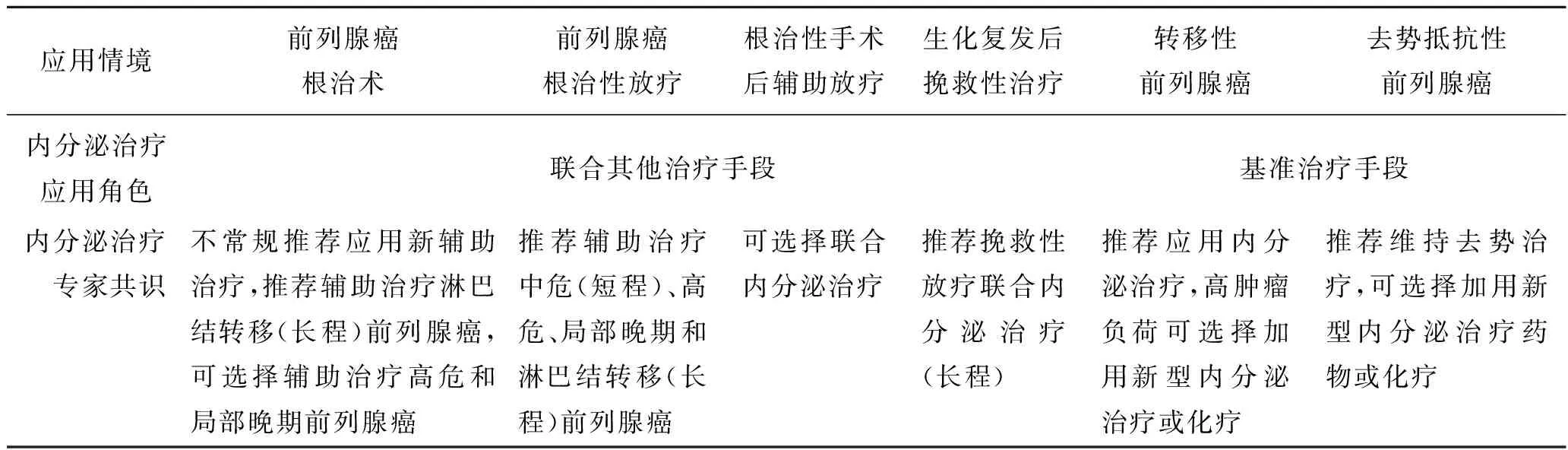
应用情境前列腺癌根治术前列腺癌根治性放疗根治性手术后辅助放疗生化复发后挽救性治疗转移性前列腺癌去势抵抗性前列腺癌内分泌治疗应用角色 联合其他治疗手段基准治疗手段内分泌治疗 专家共识不常规推荐应用新辅助治疗,推荐辅助治疗淋巴结转移(长程)前列腺癌,可选择辅助治疗高危和局部晚期前列腺癌推荐辅助治疗中危(短程)、高危、局部晚期和淋巴结转移(长程)前列腺癌可选择联合内分泌治疗推荐挽救性放疗联合内分泌治疗(长程)推荐应用内分泌治疗,高肿瘤负荷可选择加用新型内分泌治疗或化疗推荐维持去势治疗,可选择加用新型内分泌治疗药物或化疗
注:短程、长程分别指4~6个月和2~3年的内分泌治疗; “推荐”依据来源于Ⅲ期随机对照临床试验,“可选择”依据来源于队列研究。
附表2前列腺癌风险评估简表[78-79]

危险度分组低危中危高危局部晚期淋巴结转移低转移肿瘤负荷高转移肿瘤负荷定义T1~T2a且Gl-eason评分≤6且PSA<10ng/mLT2b~T2c或Glea-son评分=7或PSA=10~20ng/mLT3a或Gleason评分≥8或PSA>20ng/mLT3b~T4或主要的Glea-son评分=5髂总血管分叉以下淋巴结转移无内脏转移且骨转移≤3处内脏转移或≥4处骨转移(至少有1处转移位于骨盆外)
参考文献:
[1] SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics,2018[J].CA Cancer J Clin,2018,68(1):7-30.
[2] CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016.66(2):p.115-132.
[3] KIM CS,LEE JY,CHUNG BH,et al.Report of the second asian prostate cancer (A-CaP) study meeting[J].Prostate Int,2017,5(3):95-103.
[4] HUGGINS C,HODGES CV,Studies on prostate cancer:i.the effect of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate[J].Cancer Res,1941,1(1):293-297.
[5] ARIMURA A,MATSUO H,BABA Y,et al.Ovulation induced by synthetic luteinizing hormone-releasing hormone in the hamster[J].Science,1971,174(4008):511-512.
[6] LABRIE F,DUPONT A,BELANGER A,et al.New hormonal therapy in prostatic carcinoma:combined treatment with an LHRH agonist and an antiandrogen[J].Clin Invest Med,1982,5(4):267-275.
[7] SEIDENFELD J,SAMSON DJ,HASSELBLAD V,et al.Single-therapy androgen suppression in men with advanced prostate cancer:a systematic review and meta-analysis[J].Ann Int Med,2000,132(7):566-577.
[8] PROSTATE CANCER TRIALISTS’ COLLABORATIVE GROUP.Maximum androgen blockade in advanced prostate cancer:an overview of the randomised trials[J].Lancet,2000,355(9214):1491-1498.
[9] 秦晓健,叶定伟.前列腺癌精准内分泌治疗的全程管理[J].中华泌尿外科杂志,2017,38:17-19.
[10] PILEPICH MV,CAPLAN R,BYHARDT RW,et al.Phase III trial of androgen suppression using goserelin in unfavorable-prognosis carcinoma of the prostate treated with definitive radiotherapy:report of Radiation Therapy Oncology Group Protocol 85-31[J].J Clin Oncol,1997,15(3):1013-1021.
[11] HORWITZ EM,BAE K,HANKS GE,et al.,Ten-year follow-up of radiation therapy oncology group protocol 92-02:a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer[J].J Clin Oncol,2008,26(15):2497-2504.
[12] BOLLA M,DE REIJKE TM,VAN TIENHOVEN G,et al.Duration of androgen suppression in the treatment of prostate cancer[J].N Engl J Med,2009,360(24):2516-2527.
[13] WIDMARK A,KLEPP O,SOLBERG A,et al.,Endocrine treatment,with or without radiotherapy,in locally advanced prostate cancer (SPCG-7/SFUO-3):an open randomised phase III trial[J].Lancet,2009,373(9660):301-308.
[14] D’AMICO AV,CHEN MH,RENSHAW AA,et al.Androgen suppression and radiation vs radiation alone for prostate cancer:a randomized trial[J].JAMA,2008,299(3):289-295.
[15] DENHAM JW,STEIGLER A,LAMB DS,et al.Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer:10-year data from the TROG 96.01 randomised trial[J].Lancet Oncol,2011,12(5):451-459.
[16] JONES CU,HUNT D,MCGOWAN DG,et al.Radiotherapy and short-term androgen deprivation for localized prostate cancer[J].N Engl J Med,2011,365(2):107-118.
[17] MESSING EM,MANOLA J,SAROSDY M,et al.Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer[J].N Engl J Med,1999,341(24):1781-1788.
[18] MESSING EM,MANOLA J,YAO J,et al.Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy[J].Lancet Oncol,2006,7(6):472-479.
[19] DORFF TB,FLAIG TW,TANGEN CM,et al.Adjuvant androgen deprivation for high-risk prostate cancer after radical prostatectomy:SWOG S9921 study[J].J Clin Oncol,2011,29(15):2040-2045.
[20] STUDER UE,WHELAN P,WIMPISSINGER F,et al.Differences in time to disease progression do not predict for cancer-specific survival in patients receiving immediate or deferred androgen-deprivation therapy for prostate cancer:final results of EORTC randomized trial 30891 with 12 years of follow-up[J].Eur Urol,2014,66(5):829-838.
[21] GLODÉ,L.M.Mitoxantrone/prednisone fails to improve outcomes when added to adt in high-risk prostate cancer[OL]SCO Genitourinary Cancers Symposium,2017.02.https://gucasym.org/daily-news/mitoxantroneprednisone-fails-improve-outcomes-when-added-adt-high-risk-prostate-cancer
[22] Berglund RK,Tangen CM,Powell IJ,et al.Ten-year follow-up of neoadjuvant therapy with goserelin acetate and flutamide before radical prostatectomy for clinical T3 and T4 prostate cancer:update on Southwest Oncology Group Study 9109[J].Urology,2012,79(3):633-637.
[23] SILBERSTEIN JL,POON SA,SJOBERG DD,et al.Long-term oncological outcomes of a phase II trial of neoadjuvant chemohormonal therapy followed by radical prostatectomy for patients with clinically localised,high-risk prostate cancer[J].BJU Int,2015,116(1):50-56.
[24] CHI KN,CHIN JL,WINQUIST E,et al.Multicenter phase II study of combined neoadjuvant docetaxel and hormone therapy before radical prostatectomy for patients with high risk localized prostate cancer[J].J Urol,2008,180(2):565-570.
[25] SCHULMAN CC,DEBRUYNE FM,FORSTER G,et al.4-Year follow-up results of a European prospective randomized study on neoadjuvant hormonal therapy prior to radical prostatectomy in T2-3N0M0 prostate cancer.European Study Group on Neoadjuvant Treatment of Prostate Cancer[J].Eur Urol,2000,38(6):706-713.
[26] HU J,XU H,ZHU W,et al.Neo-adjuvant hormone therapy for non-metastatic prostate cancer:a systematic review and meta-analysis of 5,194 patients[J].World J Surg Oncol,2015,13:73.
[27] SHELLEY MD,KUMAR S,WILT T,et al.A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma[J].Cancer Treat Rev,2009,35(1):9-17.
[28] KUMAR S,SHELLEY M,HARRISON C,et al.Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer[J].Cochrane Database Syst Rev,2006(4):CD006019.
[29] POTOSKY AL,HAQUE R,CASSIDY-BUSHROW AE,et al.Effectiveness of primary androgen-deprivation therapy for clinically localized prostate cancer[J].J Clin Oncol,2014,32(13):1324-1330.
[30] LU-YAO GL,ALBERTSEN PC,MOORE DF,et al.Fifteen-year survival outcomes following primary androgen-deprivation therapy for localized prostate cancer[J].JAMA Int Med,2014,174(9):1460-1467.
[31] BOORJIAN SA,THOMPSON RH,TOLLEFSON MK,et al.Long-term risk of clinical progression after biochemical recurrence following radical prostatectomy:the impact of time from surgery to recurrence[J].Eur Urol,2011,59(6):893-899.
[32] ZUMSTEG ZS,SPRATT DE,ROMESSER PB,et al.The natural history and predictors of outcome following biochemical relapse in the dose escalation era for prostate cancer patients undergoing definitive external beam radiotherapy[J].Eur Urol,2015,67(6):1009-1016.
[33] BRIGANTI A,KARNES RJ,GANDAGLIA G,et al.Natural history of surgically treated high-risk prostate cancer[J].Urol Oncol,2015,33(4):163.e7-13.
[34] CARRIE C,HASBINI A,DE LAROCHE G,et al.Salvage radiotherapy with or without short-term hormone therapy for rising prostate-specific antigen concentration after radical prostatectomy (GETUG-AFU 16):a randomised,multicentre,open-label phase 3 trial[J].Lancet Oncol,2016.17(6):747-756.
[35] SHIPLEY WU,SEIFERHELD W,LUKKA HR,et al.Radiation with or without antiandrogen therapy in recurrent prostate cancer[J].N Engl J Med,2017.376(5):p.417-428.
[36] CROOK,J M,O’CALLAGHAN CJ,DUNCAN Get al.Intermittent androgen suppression for rising PSA level after radiotherapy[J].N Engl J Med,2012.367(10):895-903.
[37] AKAZA H,HINOTSU S,USAMI M,et al.Combined androgen blockade with bicalutamide for advanced prostate cancer:long-term follow-up of a phase 3,double-blind,randomized study for survival[J].Cancer,2009,115(15):3437-3445.
[38] CHEN XQ,HUANG Y,LI X,et al.Efficacy of maximal androgen blockade versus castration alone in the treatment of advanced prostate cancer:a retrospective clinical experience from a Chinese medical centre[J].Asian J Androl,2010,12(5):718-727.
[39] SUN Y,YANG Y,CHEN R,et al.Efficacy and safety of first-line combined androgen blockade in advanced prostate cancer:a meta-analysis (805P)[C].ESMO Poster,2017,28(suppl 5):290.
[40] HUSSAIN M,TANGEN CM,BERRY DL et al.Intermittent versus continuous androgen deprivation in prostate cancer[J].N Engl J Med,2013,368(14):1314-1325.
[41] GRAVIS G,FIZAZI K,JOLY F,et al.Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15):a randomised,open-label,phase 3 trial[J].Lancet Oncol,2013,14(2):149-158.
[42] SWEENEY CJ,CHEN YH,CARDUCCI M,et al.Chemohormonal therapy in metastatic hormone-sensitive prostate cancer[J].N Engl J Med,2015,373(8):737-746.
[43] JAMES ND,SYDES MR,CLARKE NW,et al.Addition of docetaxel,zoledronic acid,or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE):survival results from an adaptive,multiarm,multistage,platform randomised controlled trial[J].Lancet,2016,387(10024):1163-1177.
[44] JAMES ND,DE BONO JS,SPEARS MR,et al.Abiraterone for prostate cancer not previously treated with hormone therapy[J].N Engl J Med,2017,377(4):338-351.
[45] FIZAZI K,TRAN N,FEIN L,et al.Abiraterone plus prednisone in metastatic,castration-sensitive prostate cancer[J].N Engl J Med,2017,377(4):352-360.
[46] TAYLOR CD,ELSON P,TRUMP DL.Importance of continued testicular suppression in hormone-refractory prostate cancer[J].J Clin Oncol,1993.11(11):2167-2172.
[47] GOMELLA LG.Effective testosterone suppression for prostate cancer:is there a best castration therapy?[J].Rev Urol,2009,11(2):52-60.
[48] 李希华.睾丸切除术[J].吴阶平泌尿外科学,2009,第一版:2122-2123.
[49] CAMPBELL MF,WALSH PC; WEIN AJ,et al,Campbell-Walsh Urology,9th ed,2007:3246.
[50] 侯树坤.应重视雄激素撤除治疗的不良事件[J].中华泌尿外科杂志,2005,26(6):365-366.
[51] 阮玲祥.诺雷得联合康士得治疗前列腺癌的护理[J].护理与康复,2009,8(4):355-356.
[52] HUSSAIN M,TANGEN CM,HIGANO C,et al.Absolute prostate-specific antigen value after androgen deprivation is a strong independent predictor of survival in new metastatic prostate cancer:data from southwest oncology group trial 9346 (INT-0162)[J].J Clin Oncol,2006,24(24):3984-3990.
[53] BLUMBERG JM,KWON EO,CHEETHAM TC,et al.Early development of castrate resistance varies with different dosing regimens of luteinizing hormone releasing hormone agonist in primary hormonal therapy for prostate cancer[J].Urology,2011,77(2):412-416.
[54] BERTAGLIA V,TUCCI M,FIORI C,AROASIO E,et al.Effects of serum testosterone levels after 6 months of androgen deprivation therapy on the outcome of patients with prostate cancer[J].Clin Genitourin Cancer,2013,11(3):325-330.
[55] BEER TM,TANGEN CM,BLAND LB,et al.The prognostic value of hemoglobin change after initiating androgen-deprivation therapy for newly diagnosed metastatic prostate cancer:a multivariate analysis of southwest oncology group study 8894[J].Cancer,2006,107(3):489-496.
[56] DANIELL HW.Osteoporosis due to androgen deprivation therapy in men with prostate cancer[J].Urology,2001,58(2 Suppl 1):101-107.
[57] SCHER HI,MORRIS MJ,STADLER WM,et al.Trial design and objectives for castration-resistant prostate cancer:updated recommendations from the prostate cancer clinical trials working group 3[J].J Clin Oncol,2016,34(12):1402-1418.
[58] PAGLIARULO V,BRACARDA S,EISENBERGER MA,et al.Contemporary role of androgen deprivation therapy for prostate cancer[J].Eur Urol,2012,61(1):11-25.
[59] SHAHINIAN VB,KUO YF,FREEMAN JL,et al.Risk of fracture after androgen deprivation for prostate cancer[J].N Engl J Med,2005,352(2):154-164.
[60] DEPUY V,ANSTROM KJ,CASTEL LD,et al.Effects of skeletal morbidities on longitudinal patient-reported outcomes and survival in patients with metastatic prostate cancer[J].Support Care Cancer,2007,15(7):869-876.
[61] SAAD F,GLEASON DM,MURRAY R,et al.Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer[J].J Natl Cancer Inst,2004,96(11):879-882.
[62] MICHAELSON MD,KAUFMAN DS,LEE H,et al.Randomized controlled trial of annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer[J].J Clin Oncol,2007,25(9):1038-1042.
[63] SMITH MR,EGERDIE B,HERNNDEZ TORIZ N,et al.Denosumab in men receiving androgen-deprivation therapy for prostate cancer[J].N Engl J Med,2009,361(8):745-755.
[64] FIZAZI K,CARDUCCI M,SMITH M,et al.Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer:a randomised,double-blind study[J].Lancet,2011,377(9768):813-822.
[65] SMITH MR,HALABI S,RYAN CJ,et al.Randomized controlled trial of early zoledronic acid in men with castration-sensitive prostate cancer and bone metastases:results of CALGB 90202 (alliance)[J].J Clin Oncol,2014,32(11):1143-1150.
[66] KAMBA T,KAMOTO T,MARUO S,et al.A phase III multicenter,randomized,controlled study of combined androgen blockade with versus without zoledronic acid in prostate cancer patients with metastatic bone disease:results of the ZAPCA trial[J].Int J Clin Oncol,2017,22(1):166-173.
[67] AHMADI H,DANESHMAND S.Androgen deprivation therapy:evidence-based management of side effects[J].BJU Int,2013,111(4):543-548.
[68] CONTEDUCA V,DI LORENZO G,TARTARONE A,et al.The cardiovascular risk of gonadotropin releasing hormone agonists in men with prostate cancer:an unresolved controversy[J].Crit Rev Oncol Hematol,2013,86(1):42-51.
[69] CULOS-REED SN,ROBINSON JW,LAU H,et al.Physical activity for men receiving androgen deprivation therapy for prostate cancer:benefits from a 16-week intervention[J].Support Care Cancer,2010,18(5):591-599.
[70] KEATING NL,O’MALLEY A,FREEDLAND SJ,et al.Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer[J].J Natl Cancer Inst,2012,104(19):1518-1523.
[71] TSAI HK,D’AMICO AV,SADETSKY N,et al.Androgen deprivation therapy for localized prostate cancer and the risk of cardiovascular mortality[J].J Natl Cancer Inst,2007,99(20):1516-1524.
[72] NANDA A,CHEN MH,BRACCIOFORTE MH,et al.Hormonal therapy use for prostate cancer and mortality in men with coronary artery disease-induced congestive heart failure or myocardial infarction[J].JAMA,2009,302(8):866-873.
[73] KEATING NL,O’MALLEY AJ,FREEDLAND SJ,et al.Diabetes and cardiovascular disease during androgen deprivation therapy:observational study of veterans with prostate cancer[J].J Natl Cancer Inst,2010,102(1):39-46.
[74] NGUYEN PL,JE Y,SCHUTZ FA,et al.Association of androgen deprivation therapy with cardiovascular death in patients with prostate cancer:a meta-analysis of randomized trials[J].JAMA,2011,306(21):2359-2366.
[75] ALLAN CA,COLLINS VR,FRYDENBERG M,et al.Androgen deprivation therapy complications[J].Endocr Relat Cancer,2014,21(4):T119-129.
[76] JOLY F,ALIBHAI SM,GALICA J,et al.Impact of androgen deprivation therapy on physical and cognitive function,as well as quality of life of patients with nonmetastatic prostate cancer[J].J Urol,2006,176(6 Pt 1):2443-2447.
[77] CHERRIER MM,AUBIN S,HIGANO CS.Cognitive and mood changes in men undergoing intermittent combined androgen blockade for non-metastatic prostate cancer[J].Psychooncology,2009,18(3):237-247.
[78] CORNFORD P,BELLMUNT J,BOLLA M,et al.EAU-ESTRO-SIOG guidelines on prostate cancer.Part II:treatment of relapsing,metastatic,and castration-resistant prostate cancer[J].Eur Urol,2017,71(4):630-642.
[79] MOTTET N,BELLMUNT J,BOLLA M,et al.EAU-ESTRO-SIOG guidelines on prostate cancer.Part 1:screening,diagnosis,and local treatment with curative intent[J].Eur Urol,2017,71(4):618-629.

