半乳糖凝集素-1在膀胱癌中的表达及临床意义
吴银霞,周广臣,牛 荃,石 群,许士高,俞俊杰
(江苏省苏北人民医院:1.肿瘤科;2.泌尿外科,江苏扬州 225001)
半乳糖凝集素(Galectins)即β-半乳糖苷结合蛋白,参与多种生理和病理过程,包括细胞生长和凋亡、细胞粘附及新生血管形成和肿瘤浸润与转移等[1]。Galectin-1是Galectins家族的重要成员之一,广泛表达于乳腺癌、膀胱癌、肝癌等多种肿瘤组织中。我们选取90例膀胱癌组织及20例癌旁组织标本进行研究,采用免疫组化检测膀胱癌组织及癌旁组织中Galectin-1的表达水平,并对Galectin-1的表达水平与膀胱癌临床病理参数及预后的关系进行探讨,现报告如下。
1 材料与方法
1.1临床资料收集2005年12月至2015年12月在江苏省苏北人民医院泌尿外科就诊的90例膀胱癌患者及20例癌旁病理标本。所有患者经过膀胱电切或膀胱根治性切除手术,且手术前未行放、化疗等辅助治疗。患者的临床资料包括患者性别、年龄、生存时间和肿瘤的大小、分级、分期情况等,随诊时间36~60个月,前2 年每3 个月随访1 次,之后每6 个月1 次。 总生存期(overall survival,OS)为从手术之日至死亡或最后一次随访时间。
1.2检测方法
1.2.1免疫组化染色 采用免疫组织化学检测膀胱癌及癌旁膀胱样本中Galectin-1蛋白表达,兔抗人Galectin-1单克隆抗体购自美国CST公司;SP免疫组织化学试剂盒、二氨基联苯胺(diamino benzidine,DAB)显色试剂盒均购自碧云天公司。具体操作步骤如下:常规4 μm 连续石蜡切片常规经二甲苯脱蜡、梯度乙醇水化;置于3%过氧化氢甲醇中处理5 min,抑制内源性过氧化酶;经磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗后,滴加1∶200 Galectin-1抗体作为一抗,4 ℃冰箱湿盒孵育过夜;经PBS洗涤后,滴加生物素化抗兔SP 试剂盒的二抗复合物,室温湿盒孵育30 min;经PBS洗涤后,切片滴加DAB 液显色;蒸馏水洗后,苏木素复染、中性树胶封固,置于显微镜下观察。以0.01 mol/L PBS液替代一抗作为阴性对照,每例均有HE 切片作对照观察。
1.2.2结果判断 两名病理科医生采用盲法阅片的方式进行结果判断。观察10个具有代表性的显微镜视野并确定阳性染色细胞的数量和所占的比例。染色强度评分:无阳性反应细胞为0分,染色强度淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比评价染色面积:<0%~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,75%~100%为4分。两项评分相乘为最后结果。
1.3统计学分析采用SPSS19.0软件进行统计分析,利用卡方检验分析Galectin-1蛋白表达与临床病理参数之间的关系。P<0.05为差异有统计学意义。
2 结 果
2.1Galectin-1在膀胱癌及癌旁组织的表达情况免疫组织化学技术检测膀胱癌组织及癌旁组织样本中Galectin-1表达情况,结果显示:20例癌旁组织样本有6例Galectin-1染色阳性,阳性表达率为30%;90例膀胱癌组织中Galectin-1阳性染色为50例,阳性表达率为55.6%,Galectin-1在膀胱癌组织的表达水平显著高于癌旁组织,差异有统计学意义(P<0.05,表1)。Galectin-1阳性染色为在细胞质内出现黄色或棕黄色颗粒状(图1)。
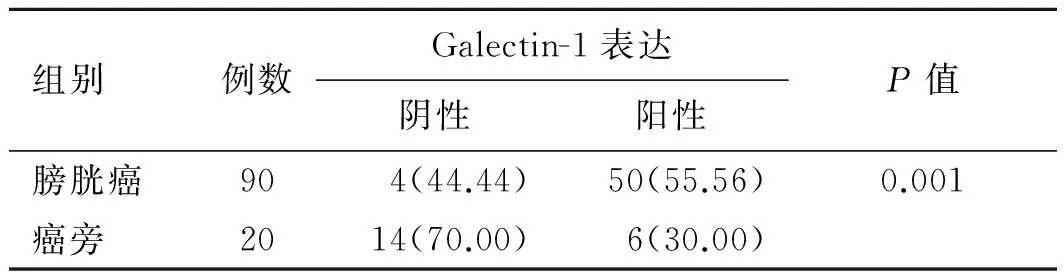
表1 Galectin-1在膀胱癌组织及癌旁组织中的表达 [例(%)]
2.2Galectin-1表达与膀胱癌临床病理的关系分析Galectin-1表达与膀胱癌临床病理特征的关系发现,Galectin-1的表达与性别、年龄、肿瘤的大小无相关性(P>0.05)。Galectin-1蛋白在低级别膀胱癌中的阳性率低于高级别膀胱癌(40.5%vs.68.8%,P<0.05); Galectin-1蛋白在病理分期T2~T4 期膀胱癌中的阳性率高于Ta~T1 期膀胱癌的阳性率(70.4%vs.33.3%,P<0.05),两者差异有统计学意义(P<0.05,表2)。
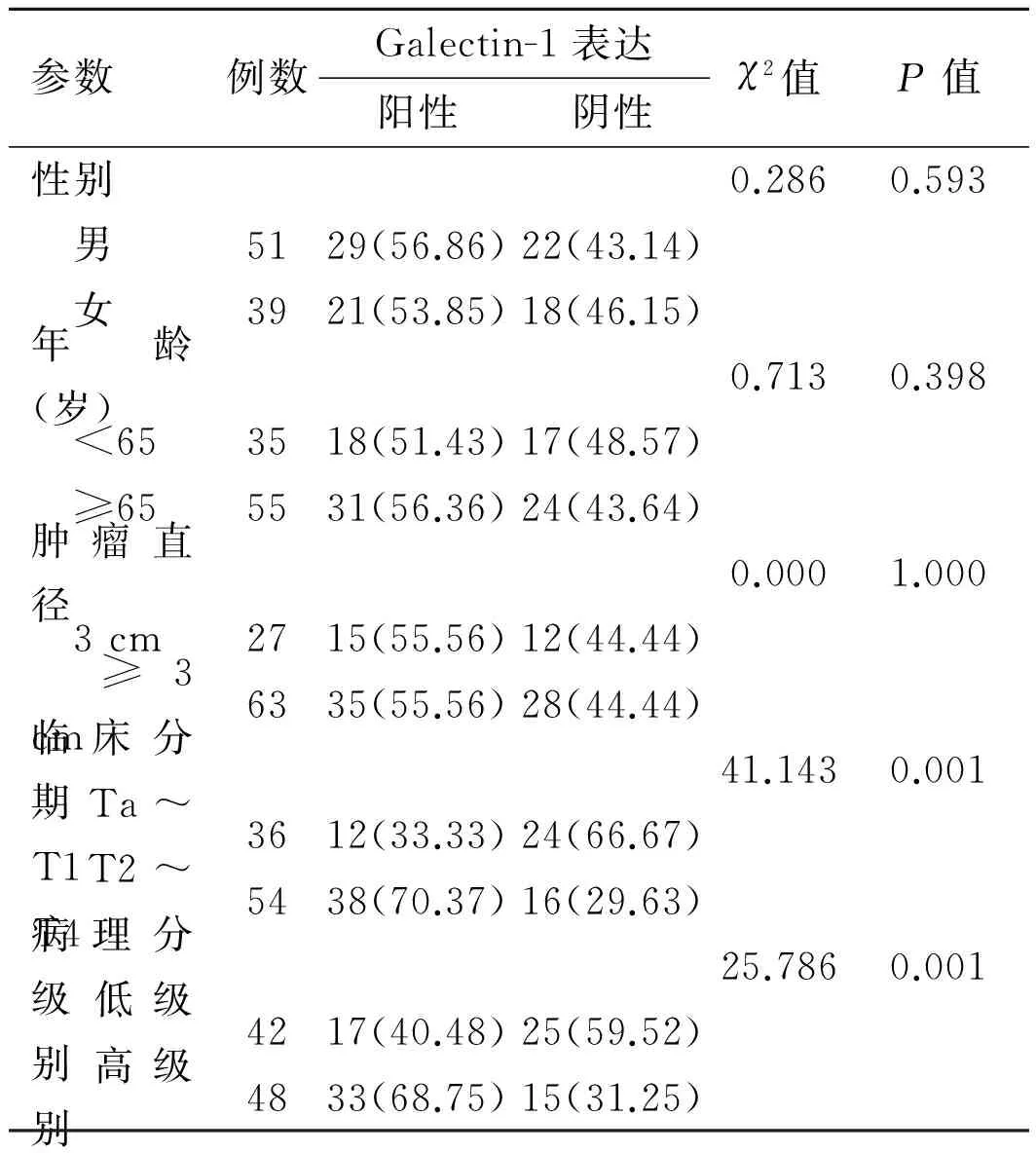
表2 Galectin-1的表达同膀胱癌临床病理参数的关系 [例(%)]

图1 Galectin-1在膀胱癌组织的表达情况(×40)
2.3Galectin-1表达与临床预后的关系进一步分析Galectin-1 蛋白阳性表达与3年生存率的关系。膀胱癌组织中Galectin-1蛋白阳性表达50 例,3年生存率为36%,显著低于Galectin-1蛋白阴性表达的67.5%(P<0.05);Galectin-1蛋白阳性表达的3年生存中位时间为24.8个月,显著短于Galectin-1 蛋白阴性表达的38.7个月(P<0.05)。
3 讨 论
膀胱癌的发生发展及转移是一个复杂的过程,其中可能涉及许多肿瘤相关因子的参与和调控。膀胱移行细胞癌的发病率呈上升及年轻化趋势,且肌层浸润性尿路上皮癌具有较强的侵袭能力,患者的预后较差。如何进一步探究膀胱癌发生、发展的分子机制,寻找可靠的生物标志物和有效的分子治疗靶点对提高膀胱癌患者生存率显得尤为重要。Galectin-1是半乳糖凝集素家族成员,其分布广泛,在细胞粘附、细胞的生长和凋亡、炎症反应、新血管形成以及肿瘤侵袭与转移等许多生理和病理过程中发挥着重要作用。研究表明,在多种恶性肿瘤中,Galectin-1表达上调有助于致瘤性转化,肿瘤细胞的存活、血管生成和肿瘤侵袭,并可能在肿瘤细胞免疫逃逸中发挥关键作用[2-3]。Galectin-1可诱导激活的T 细胞凋亡进而促使肿瘤免疫逃逸,也可以调节同型肿瘤细胞的粘附以及肿瘤细胞与细胞外基质的作用[4-5]。Galectin-1通过调节肿瘤粘附到内皮细胞,促进肿瘤的侵袭和迁移。肿瘤细胞内的Galectin-1可促进肿瘤的增殖,并且与癌基因H-Ras 相互作用来调节肿瘤的转化[6-7]。 Galectin-1的高表达涉及结肠癌、乳腺癌、肺癌、卵巢癌、膀胱癌、Kaposi 肉瘤和神经胶质瘤等多种肿瘤[8]。最近的研究显表明,分期晚、有淋巴结转移的宫颈癌组织标本中Galectin-1的表达率明显增高[9]。在结肠癌患者血液中能检测出Galectin-1的表达,而且晚期结肠癌患者血液中的Galectin-1水平明显高于早期结肠癌患者[10]。由此推测,Galectin-1参与多种恶性肿瘤的发生发展,深入研究Galectin-1在膀胱癌中的作用对于临床上诊治恶性肿瘤具有现实意义,有望成为膀胱癌的诊断和靶向治疗的新指标。
本组实验结果显示,90例膀胱癌组织和20例癌旁膀胱黏膜组织中Galectin-1的阳性表达率分别为55.6%(50 /90)、30%(6/20),二者差异有统计学意义(P<0.05),提示Galectin-1的高表达可能参与膀胱癌的发生。研究报道,Galectin-1可诱导卵巢癌和肺癌细胞增殖[11-12]。在宫颈癌细胞中,通过RNA 干扰技术抑制Galectin-1 的活性,可显著抑制肿瘤细胞的增殖[9]。 TOUSSAINT等[13]研究发现Galectin-1在体外可增强胶质母细胞瘤的迁移和侵袭能力,而体内高表达者更易浸润、预后更差。Galectin-1通过调节趋化蛋白的合成和分泌,诱导肿瘤相关成纤维细胞,从而增强恶性肿瘤细胞的侵袭和迁移能力[14]。 Galectin-1的表达与病理分级、病理分期相关,并且出现随病理分级、病理分期提升表达率升高的趋势。表明随着膀胱癌临床分期的进展Galectin-1蛋白表达逐渐升高,Galectin-1蛋白可能参与了膀胱癌的进展及侵袭转移。生存分析结果显示,Galectin-1阳性表达组3年生存率显著低于阴性表达组,提示Galectin-1可能可作为判断膀胱癌预后的指标。
综上所述,本研究结果提示Galectin-1在膀胱癌中异常表达,与膀胱癌的临床病理参数具有一定的相关性,其高表达对患者的远期预后产生不良影响,提示Galectin-1与膀胱癌发生发展及生物学行为密切相关,为膀胱癌的基因靶向治疗也提供了一个新的思路。
参考文献:
[1] YANG RY,RABINOVICH GA,LIU FT.Galectins:structure,function and therapeutic potential[J].Expert Rev Mol Med,2008,10:e17.
[2] FANFONE D,DESPRETZ N,STANICKI D,et al.Toward a new and noninvasive diagnostic method of papillary thyroid cancer by using peptide vectorized contrast agents targeted to galectin-1[J].Med Oncol,2017,34(11):184-190.
[3] LIN TW,CHANG HT,CHEN CH,et al.Galectin-3 binding protein and galectin-1 interaction in breast cancer cell aggregation and metastasis[J].J Am Chem Soc,2015,137(30):9685-9693.
[4] TANG D,GAO J,WANG S,et al.Apoptosis and anergy of T cell induced by pancreatic stellate cells-derived galectin-1 in pancreatic cancer[J].Tumour Biol,2015,36(7):5617-5626.
[5] WU M,LIU P,CHENG L.Galectin-1 reduction and changes in T regulatory cells may play crucial roles in patients with unexplained recurrent spontaneous abortion[J].Int J Clin Exp Pathol,2015,8(2):1973-1978.
[6] REESINK HL,SUTTON RM,SHURER CR,et al.Galectin-1 and galectin-3 expression in equine mesenchymal stromal cells (MSCs),synovial fibroblasts and chondrocytes,and the effect of inflammation on MSC motility[J].Stem Cell Res Ther,2017,8(1):243-249.
[7] SU YC,DAVULURI GV,CHEN CH,et al.Galectin-1-Induced autophagy facilitates cisplatin resistance of hepatocellular carcinoma[J].PLoS One,2016,11(2):e0148408.
[8] AGGARWAL S,SHARMA SC,DAS SN.Galectin-1 and galectin-3:plausible tumour markers for oral squamous cell carcinoma and suitable targets for screening high-risk population[J].Clin Chim Acta,2015,442:13-21.
[9] KIM HJ,DO IG,JEON HK,et al.Galectin 1 expression is associated with tumor invasion and metastasis in stage IB to IIA cervical cancer[J].Hum Pathol,2013,44(1):62-68.
[10] WATANABE M,TAKEMASA I,KANEKO N,et al.Clinical significance of circulating galectins as colorectal cancer markers[J].Oncol Rep,2011,25(5):1217-1226.
[11] BANH A,ZHANG J,CAO H,et al.Tumor galectin-1 mediates tumor growth and metastasis through regulation of T-cell apoptosis[J].Cancer Res,2011,71(13):4423-4431.
[12] KIM HJ,JEON HK,CHO YJ,et al.High galectin-1 expression correlates with poor prognosis and is involved in epithelial ovarian cancer proliferation and invasion[J].Eur J Cancer,2012,48(12):1914-1921.
[13] TOUSSAINT LG,3RD,NILSON AE,GOBLE JM,et al.Galectin-1,a gene preferentially expressed at the tumor margin,promotes glioblastoma cell invasion[J].Mol Cancer,2012,11:32-46.
[14] WU MH,HONG HC,HONG TM,et al.Targeting galectin-1 in carcinoma-associated fibroblasts inhibits oral squamous cell carcinoma metastasis by downregulating MCP-1/CCL2 expression[J].Clin Cancer Res,2011,17(6):1306-1316.

