原发性高血压患者红细胞分布宽度、中性粒细胞/淋巴细胞比值与内皮功能关系的研究
周亚群 丁存涛 孙希鹏 李 静 华 琦
(首都医科大学宣武医院心脏科, 北京 100053)
原发性高血压是心血管病最主要的危险因素,常导致多种合并症及靶器官损害[1]。全世界目前大约有10亿高血压患者,中国大约有3亿高血压患者,且每年以1千万的速度增长[2]。近年来,研究[3]表明,炎性反应在高血压的病理生理过程中起到了重要作用,炎性反应导致血管内皮受损,进而引起血管内皮功能障碍,进一步加重高血压。红细胞分布宽度(red blood cell distribution width,RDW)及中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)可作为机体炎性反应及氧化应激的炎性反应标志物,其与高血压的发生密切相关,且能预测患者预后。Endo-PAT2000无创血管内皮功能检测仪应用非侵入性的外周动脉张力测定(peripheral artery test, PAT)技术,通过其检测并计算出的反应性充血指数(reactive hyperemia index,RHI)是反映内皮功能的可靠指标[4],本文以原发性高血压患者血压水平、RDW、NLR及RHI为切入点,探讨高血压与炎性反应及内皮功能的关系。
1 对象与方法
1.1 研究对象
选择2016年1月至12月于首都医科大学宣武医院心内科门诊就诊的共111例轻度原发性高血压患者为研究对象。本研究为单中心临床对照研究,经首都医科大学宣武医院伦理委员会批准,所有患者均签署知情同意书。入选标准:未服用降压药物的轻度原发性高血压[高血压1级:140 mmHg≤收缩压<160 mmHg且(或)90 mmHg≤舒张压<100 mmHg,1 mmHg=0.133 kPa]患者。排除标准:高血压2级及3级患者;正在接受降压药物治疗的患者;继发性高血压、恶性高血压患者;高脂血症患者,或口服降脂药物治疗者;糖尿病患者;不稳定性心绞痛、6个月内的心肌梗死病史、心功能不全、严重心律失常者;有3个月内卒中病史者;肝功能受损:丙氨酸氨基转移酶(alanine aminotransferase,ALT)或/和门冬氨酸氨基转移酶(aspartate aminotransferase,AST)超过正常值上限1倍或以上者;肾功能受损:肌酐超过正常值上限(133 μmol/L)。
1.2 研究方法
所有入选患者均在安静状态下测量血压3次,每次间隔≥2 min,取其最接近的2次血压的平均值。 由专人用标准方法规范测量身高、体质量并计算体质量指数(body mass index,BMI)。入选者于次日清晨空腹,静息状态下坐位无菌采肘静脉血,采用日本SYSMEX公司XE-2100型血细胞分析仪及配套试剂和质控品检测血常规,根据血常规测定结果中的中性粒细胞计数和淋巴细胞计数结果计算出患者的NLR。采用日立7060全自动生化分析仪进行血生化检查,包括ALT、AST、血清肌酐(serum creatine, SCr)、尿素氮(blood urea nitrogen,BUN)等。血管RHI由非侵入性血管内皮功能检测仪Endo-PAT2000(Itamar Medical Inc.Caesarea,以色列)测得。RHI>1.67表示血管内皮功能正常,RHI≤1.67表示血管内皮功能异常[5]。患者平卧,将探头嵌套于患者双手食指前端,将标准袖带束于左侧肱动脉肘关节上2 cm处,首先采集双侧食指5 min的基线张力数据,随后袖带充气阻断左侧肱动脉血流5 min并同步采集双侧食指数据,最后将袖带快速放气,双侧食指同时采集快速放气过程中增强的张力信号,由Endo-PAT软件对阻断前后信号幅度比值进行计算,再根据另一侧对照数据对检测结果进行修正,得出RHI。
1.3 统计学方法
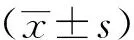
2 结果
2.1 一般情况
111例轻度原发性高血压患者中男性55例,女性56例,年龄25~78岁,平均年龄(49.15±12.88)岁。将本研究中111例高血压患者分为RHI正常组(n=63)及RHI异常组(n=48),将两组数据基本资料进行独立样本t检验。RHI异常组空腹血糖(fasting plasma glucose, FPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)及低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C) 高于RHI正常组,差异有统计学意义(P<0.05)。年龄、性别、心率、体质量指数、吸烟史及ALT、AST等指标在两组间差异均无统计学意义(P>0.05)。详见表1。
2.2 血压、RDW、NLR与RHI之间的关系
RHI异常组收缩压、脉压、中性粒细胞计数、NLR、RDW明显高于RHI正常组,差异有统计学意义(P<0.05)。其余舒张压、白细胞计数、红细胞计数、血红蛋白比较差异无统计学意义(P>0.05)。详见表2。
2.3 血压与RDW、NLR的相关性分析
收缩压与RDW(r=0.254,P=0.007)、NLR(r=0.325,P<0.01)之间呈正相关;脉压与RDW(r=0.366,P<0.01)、NLR(r=0.235,P=0.013)之间呈正相关,差异均具有统计学意义(P<0.05),详见表3。
2.4 血压、NLR与RHI的相关性分析
RHI 与收缩压(r=-0.300,P=0.001)、脉压(r=-0.311,P=0.001)及NLR (r=-0.358,P<0.01)之间呈负相关,且差异有统计学意义(图1、2、3)。
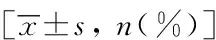
表1 RHI正常组与RHI异常组之间基本资料的比较Tab.1 Comparison of basic information between two groups
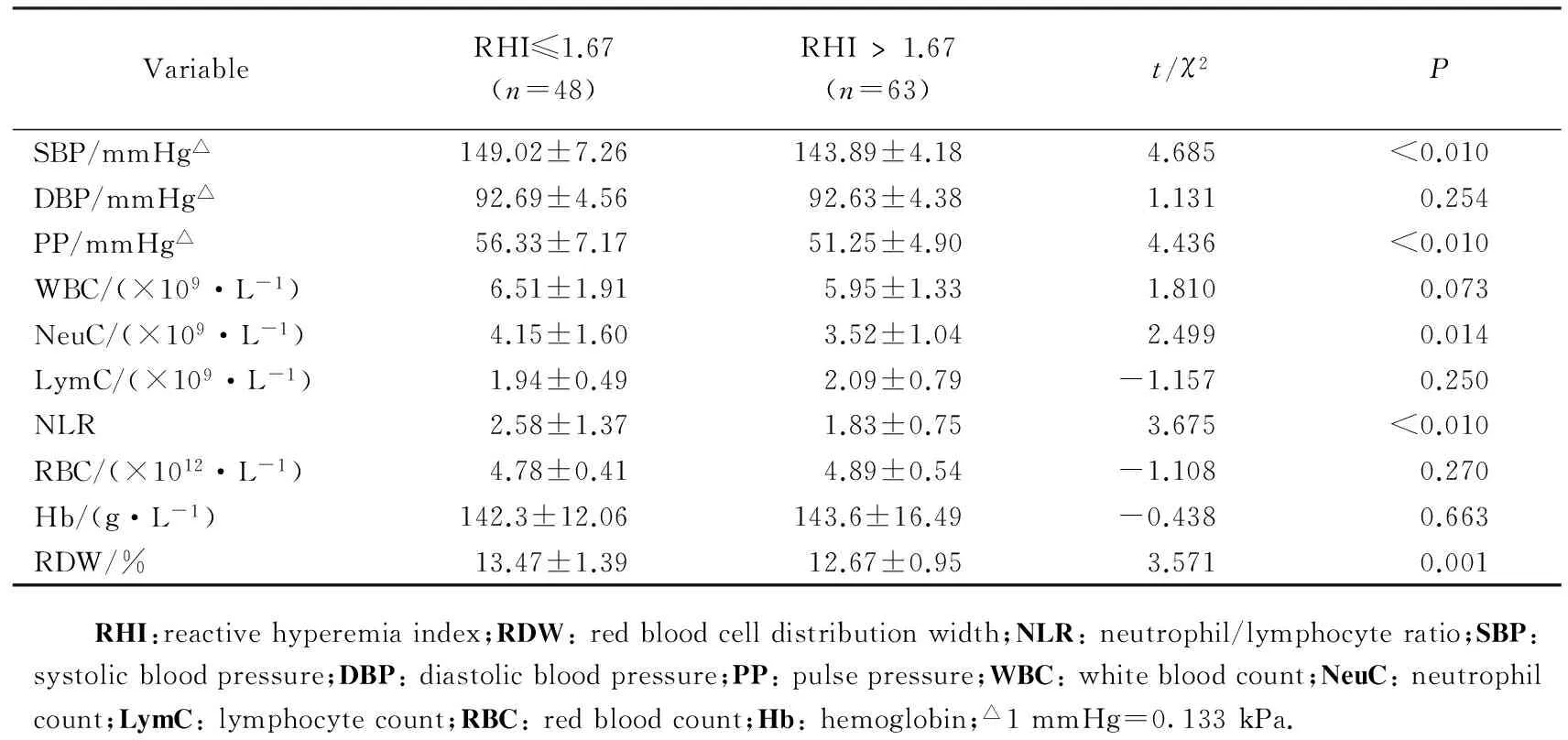
表2 RHI正常组与RHI异常组之间血压、RDW、NLR的比较Tab.2 Comparison of blood pressure,RDW and NLR between two groups
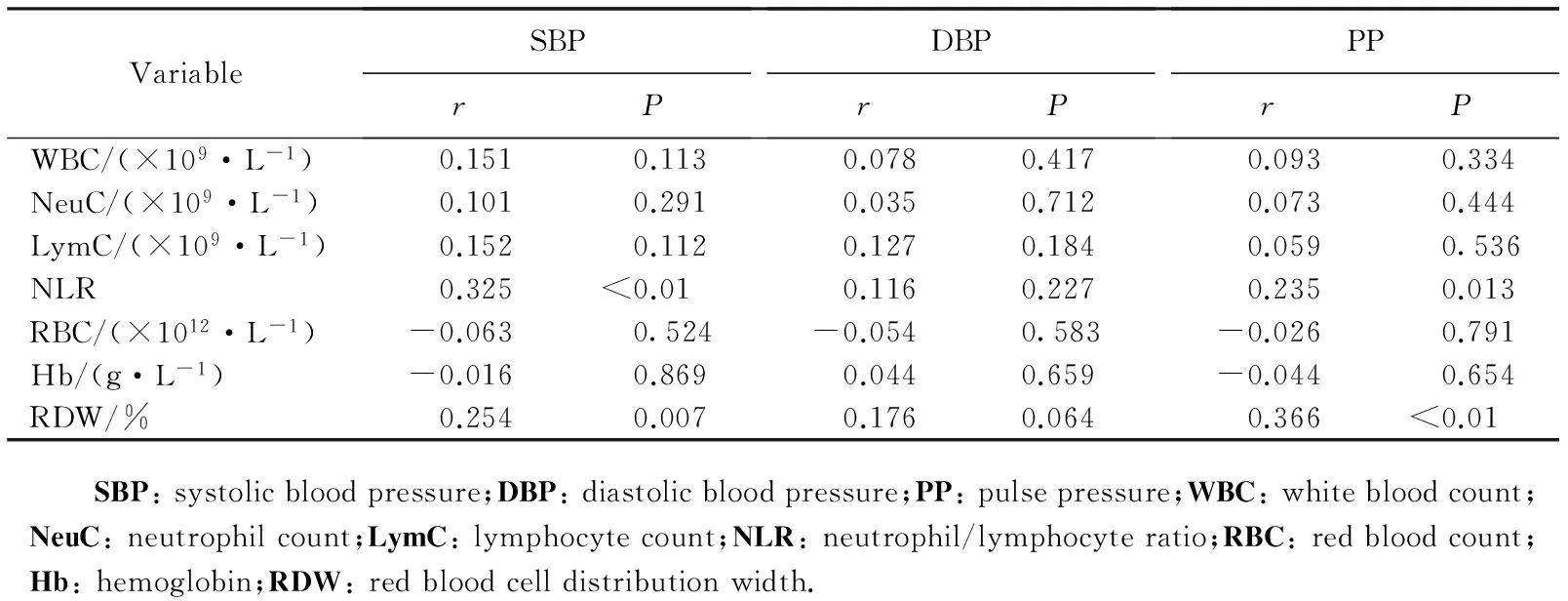
表3 SBP、DBP、PP与各项观察指标之间的Pearson相关分析Tab.3 Pearson correlation analysis of SBP, DBP, PP and various observable indicators
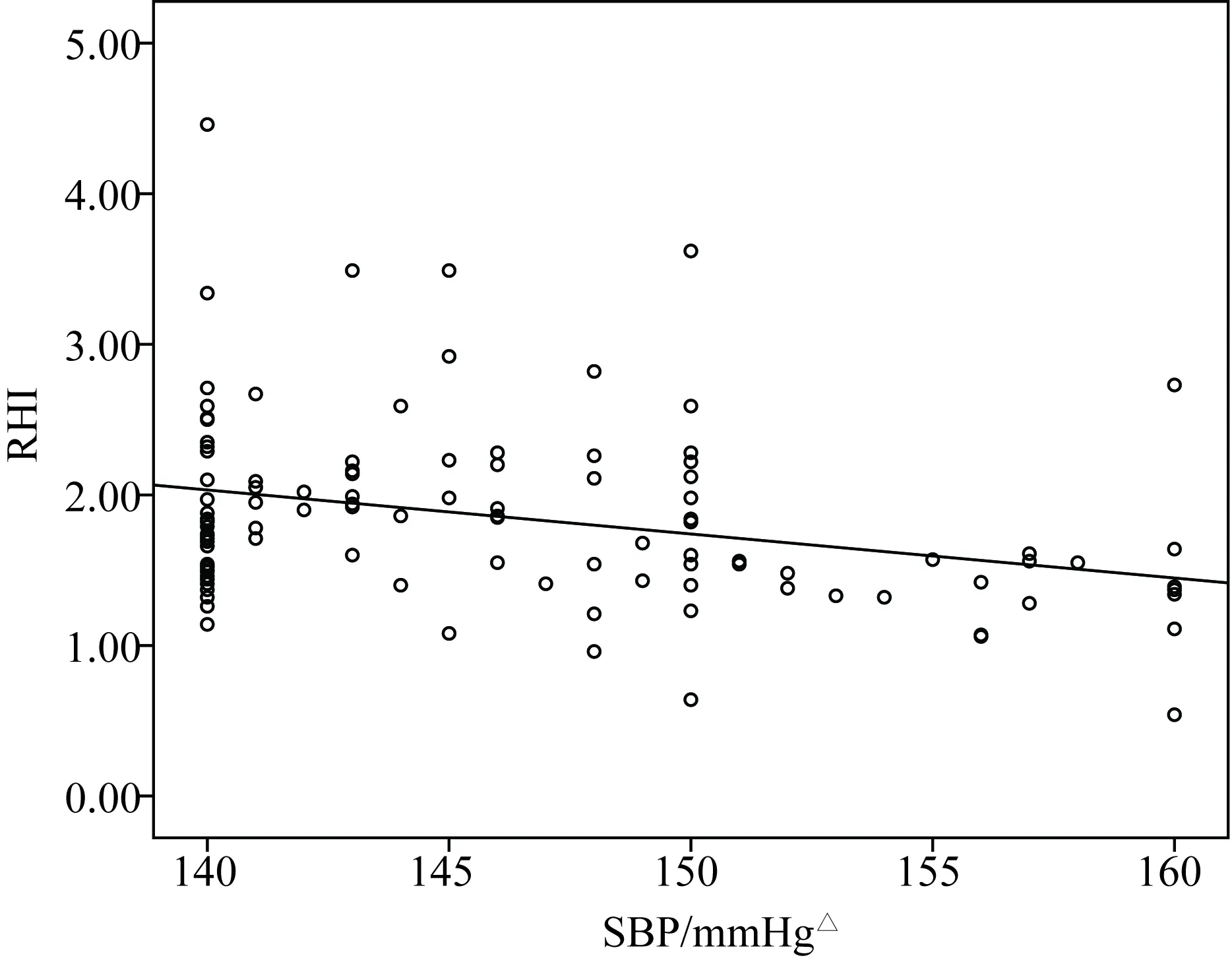
图1 收缩压与RHI之间线性关系Fig.1 Line relationship between SBP and RHI
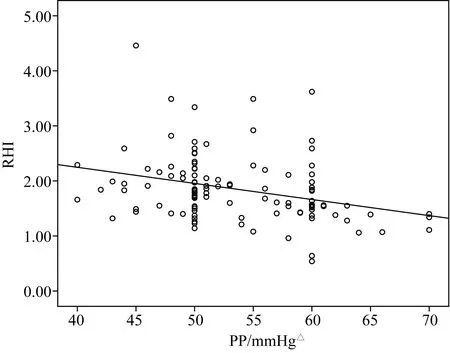
图2 脉压与RHI之间线性关系Fig.2 Line relationship between PP and RHI
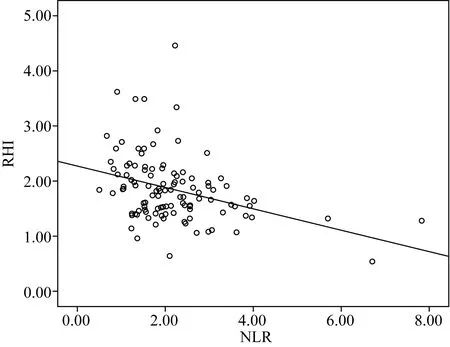
图3 NLR与RHI之间线性关系Fig.3 Line relationship between NLR and RHI
2.5 RHI的多元线性回归分析
采用多元逐步回归进行分析,因变量为RHI,自变量为收缩压、舒张压、脉压、NLR、RDW,所有自变量的引入概率为 α ≤0.05,剔除概率 α ≥0.1。 最终结果提示NLR(t=-3.376,P=0.001)、脉压(t=-2.688,P=0.008)的偏回归系数均有统计学意义,是 RHI 的独立影响因素,与RHI呈独立负相关。详见表4。
3 讨论
RDW是反映红细胞体积大小差异的指标,用于贫血的诊断,其正常参考范围为11%~14%。任何可以影响红细胞成熟的病理过程,如炎性反应状态、氧化应激、神经内分泌的激活、营养不良、肝肾功能不全等,均可导致RDW水平升高。虽然目前尚未有RDW与心血管疾病相关性的准确机制,但多数研究[6-8]认为主要是炎性反应状态、氧化应激及神经内分泌的激活这三方面的影响。高血压、心力衰竭、冠状动脉粥样硬化性心脏病(以下简称冠心病)等疾病均存在慢性炎性反应,长时间高水平的氧化应激状态可能会致使红细胞减少和未成熟的红细胞释放入外周血中,从而使RDW升高。血压升高可使交感神经及肾素-血管紧张素-醛固酮系统激活,这些神经激素可通过红细胞生成素的释放刺激红细胞生成增加,导致外周血RDW水平升高[6]。一项探讨高血压及高血压前期患者血压与RDW相关性的研究[7]显示,在纠正了年龄、血红蛋白、贫血、血清尿酸浓度、平均红细胞容积等因素后提示高血压和高血压前期的RDW要明显高于健康对照组,并且RDW水平越高,收缩压和舒张压越高。Ozcan等[8]对247名高血压患者行24 h动态血压监测,并根据结果将患者分为杓型高血压和非杓型高血压,结果非杓型高血压的RDW水平高于杓型,并且RDW与昼夜收缩压和舒张压水平的变化呈负相关,受试者工作特征(receiver operating characteristic, ROC)曲线分析,RDW预测非杓型高血压的最佳临界值为>13.8%,灵敏度为80%,特异度为75%。本研究对RDW、收缩压、舒张压及脉压作Pearson线性相关分析,结果表明RDW与收缩压及脉压呈正相关,收缩压、脉压越高,RDW水平越高,但与舒张压未见明显相关性。
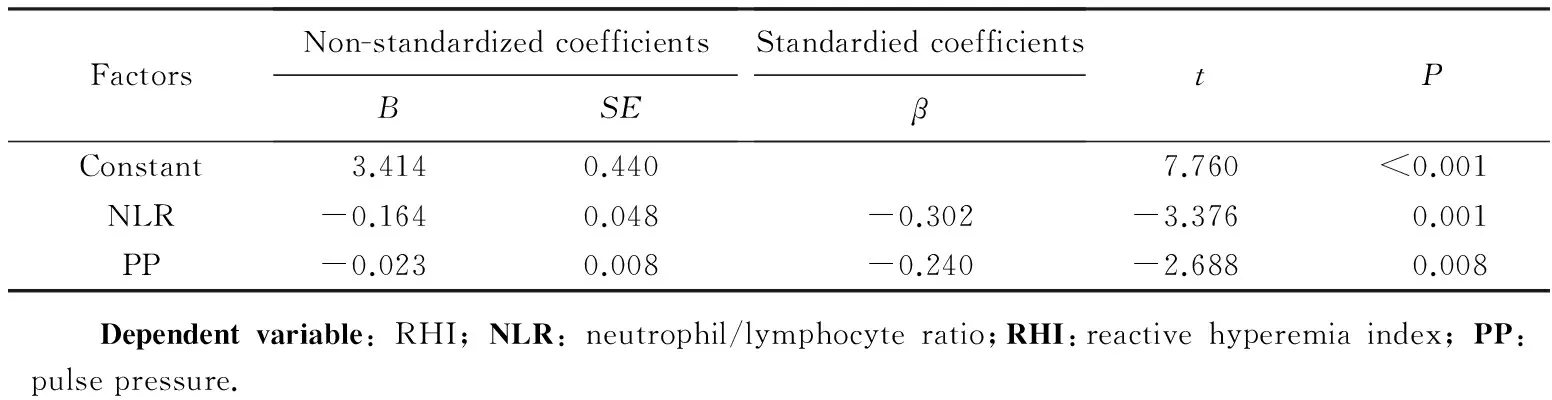
表4 RHI多元回归系数Tab.4 Multiple linear regression of the total population with RHI as the dependent variable
大量研究[9-11]表明,炎性反应在心血管疾病的病理生理过程中起到重要作用,炎性反应的地位逐渐得到提高。中性粒细胞/淋巴细胞比值(NLR)是由中性粒细胞计数和淋巴细胞计数相比组成的一个指标,具有成本低、易获得、方便使用等特点,已成为心血管系统疾病研究的新热点。NLR结合了中性粒细胞和淋巴细胞这两种白细胞亚型的信息,包含了两种互补的免疫途径,中性粒细胞主要是非特异性炎性反应,而淋巴细胞代表的是人体正常的免疫系统调控路径,因此比白细胞计数、中性粒细胞计数更有预测价值。最近的研究[9]证实,NLR可作为机体血栓形成及炎性反应的标志物,其与心血管疾病如高血压、冠心病、心力衰竭的发生及预后密切相关。有研究[10]显示高血压患者中白细胞、中性粒细胞计数及NLR水平高于对照组,单纯收缩期高血压患者上述指标水平明显高于舒张期高血压患者,且Logistic回归分析结果显示中性粒细胞计数是单纯收缩期高血压的独立预测因子。Liu等[11]对28 850例无高血压的研究对象进行为期6年的随访发现,随着NLR水平的升高,高血压患病风险上升。还有一项研究[12]表明,NLR可以作为高血压患者心脏舒张功能不全的预测指标。本研究对NLR、收缩压、舒张压及脉压作Pearson线性相关分析,结果表明NLR与收缩压及脉压呈正相关,差异具有统计学意义,但与舒张压未见明显相关性。白细胞计数、中性粒细胞计数与血压之间也无明显相关性。
有研究[13]结果表明葡萄糖浓度升高可诱导健康个体的内皮功能障碍,正常糖耐量者血糖浓度升高与内皮功能降低呈连续及分级关系。有动物实验[14]证实,急性葡萄糖负荷会加剧单核细胞黏附到主动脉血管内皮,从而导致血管内皮功能紊乱。体外研究[15]也显示,高血糖与氧化应激的升高有关,氧化应激可以抑制一氧化氮(nitric oxide, NO)生成,使内皮细胞受损。同时胰岛素抵抗也可造成血管内皮细胞功能异常[16]。胰岛素在生理条件下可通过刺激NO的产生来发挥血管扩张作用。然而,在胰岛素抵抗状态下,胰岛素介导的NO生成功能受到损害[17]。除了高血糖,脂质代谢紊乱也参与血管内皮功能的受损,高血糖引起的脂质氧化修饰导致氧化型低密度脂蛋白生成增多,并进一步诱导细胞黏附分子的表达,导致血管内皮功能紊乱加速动脉粥样硬化的进程[18]。有研究[19]证实,血脂异常是血管内皮功能障碍的影响因素之一,由于活性氧的生成增加和内皮型NO合酶的产生受抑制,非高密度脂蛋白胆固醇会使NO的生物利用度下降,这将会导致内皮功能障碍与动脉粥样硬化。本研究结果表明高血糖及高血脂均会损害原发性高血压患者的血管内皮功能,RHI与空腹血糖、糖化血红蛋白及低密度脂蛋白呈负相关,这与之前研究[13-15,19]的结果相符合。
高血压与血管内皮损伤之间有着直接的联系。高血压引起机体炎性反应,炎性反应通过损伤血管内皮,导致血管内皮生成的血管舒张因子减少,从而促进高血压病的发生发展[20-21]。两者相互作用,互为因果。RHI是反映内皮功能的指标,当RHI值<1.67时提示血管内皮功能异常,反之则为血管内皮功能正常。RHI越低,说明血管内皮功能障碍越严重;RHI越高,说明内皮功能越好。其评价冠状动脉内皮功能的特异度和灵敏度分别达到了77% 和82%[22]。本研究结果显示RHI异常组收缩压及脉压高于RHI正常组,且收缩压、脉压与RHI呈明显负相关,差异具有统计学意义,说明血压越高,内皮功能越差,高血压引起内皮损伤导致内皮功能障碍。NLR作为新兴的炎性标志物,其与血管内皮功能障碍具有明显相关性。一项研究[23]表明,NLR能作为系统性内皮功能障碍的独立预测因子。Ozturk 等[24]研究表明,NLR与动脉内膜中层厚度呈正相关,且高水平的NLR与内皮功能障碍相关。本研究对NLR与RHI行线性相关分析,结果显示RHI与NLR呈负相关,NLR越高,内皮功能越差,NLR可作为反映血管内皮功能的指标。
综上所述,本研究显示RDW、NLR水平与收缩压及脉压密切相关,且NLR与反映血管内皮功能的指标RHI有明显相关性。在临床工作中,检验RDW及NLR有助于判断高血压病情,且NLR可作为判断内皮功能情况指标,具有指导意义。但本研究样本量小,缺少对照组,且入选患者均为轻度高血压患者,具有一定局限性,其结论需多中心大样本的前瞻性临床研究来证实。
[1] Liu X, Zhang Q, Wu H,et al. Blood neutrophil to lymphocyte ratio as a predictor of hypertension[J].Am J Hypertens,2015,28(11):1339-1346.
[2] Wang W, Hu S S, Kong L Z, et al. Summary of report on cardiovascular diseases in China, 2012[J]. Biomed Environ Sci, 2014,27(7):552-558.
[3] Nidorf S M, Eikelboom J M, Thompson P L.Targeting cholesterol crystal-induced inflammation for the secondary prevention of cardiovascular disease[J]. J Cardiovasc Pharmacol Ther,2014,19(1):45-52.
[4] Michelsen M M, Mygind N D, Pena A,et al. Peripheral reactive hyperemia index and coronary microvascular function in women with no obstructive CAD: the iPOWER study[J].JACC Cardiovasc Imaging,2016, 9(4):411-417.
[5] Moerland M, Kales A J, Schrier L, et al. Evaluation of the EndoPAT as a tool to assess endothelial function[J]. Int J Vasc Med,2012,2012:904141.
[6] Liu X M,Ma C S,Liu X H,et al.Relationship between red blood cell distribution width and intermediate—term mortality in elderly patients after percutaneous coronary intervention[J].J Geriatr Cardiol,2015,12(1):17-22.
[7] Tanindi A, Topal F E, Topal F, et al. Red cell distribution width in patients with prehypertension and hypertension[J]. Blood Press,2012,21(3):177-181.
[8] Ozcan F, Turak O, Durak A, et al.Red cell distribution width and inflammation in patients with non—dipper hypenension[J].Blood Press,2013,22(2):80-85.
[9] Baysal E, Çetin M, Yaylak B,et al.Roles of the red cell distribution width and neutrophil/lymphocyte ratio in predicting thrombolysis failure in patients with an ST-segment elevation myocardial infarction[J]. Blood Coagul Fibrinolysis,2015,26(3):274-278.
[10] Pusuroglu H,Akgul O,Erturk M,et al.A comparative analysis of leukocyte and leukocyte subtype counts among isolated systolic hypertensive,systo-diastolic hypertensive,and non-hypertensive patients[J].Kardiol Pol,2014,72(8):748-754.
[11] Liu X,Zhang Q, Wu H, et al .Blood neutrophil to lymphocyte ratio as a predictor of hypertension[J].Am J Hypertens,2015,28(11):1339-1346.
[12] Karagöz A,Vural A, GÜnaydin Z Y, et al.The role of neutrophil to lymphocyte ratio as a predictor of diastolic dysfunction in hypertensive patients[J].Eur Rev Med Pharmacol Sci,2015,19(3):433-440 .
[13] Watanabe K, Oba K, Suzuki T, et al. Oral glucose loading attenuates endothelial function in normal individual[J]. Eur J Clin Invest, 2011, 41(5):465-473.
[14] Ellis A, Cheng Z J, Li Y, et al. Effects of a Western diet versus high glucose on endothelium dependent relaxation in marine micro and macro-vasculature[J]. Eur J Pharmacol, 2008,601(1-3):111-117.
[15] Cosentino F, Hishikawa K, Katusic Z S, et al. High glucose increases nitric oxide synthesis expression and superoxide anion generation in human aortic endothelial cells[J]. Circulation 1997,96(1):25-28.
[16] 邬松林, 朱刚艳, 郝亚荣,等. 二甲双胍对2型糖尿病血管内皮功能的影响[J]. 中华临床医师杂志,2013, 7(10): 26-29.
[17] Tomsa A, Klinepeter Bartz S, Krishnamurthy R, et al. Endothelial function in youth: a biomarker modulated by adiposity-related insulin resistance[J]. J Pediatr, 2016, 178:171-177.
[18] 杨慧,姜海,耿淑坤,等. 2型糖尿病早期血管内皮功能改变的临床研究[J]. 中国医药写报,2011, 8(29):32-33.
[19] Kim J A, Montagnani M, Chandrasekran S, et al. Role of lipotoxicity in endothelial dysfunction[J]. Heart Fail Clin,2012,8(4):589-607.
[20] 林向敏,杨新春,王喆,等.冠心病患者的外周动脉反应性充血指数及其影响因素分析[J].中国医刊,2015,(07):40-42,43.
[21] 周亚群,丁存涛,孙希鹏,等.原发性高血压病人超敏C反应蛋白与血压及血管内皮功能关系的研究[J].首都医科大学学报,2017,38 (3):397-400.
[22] 任雪丽,谭仕芸,陈海波,等.高血压伴心功能不全患者的BNP、Hcy和hs-CRP表达及临床意义[J].解放军医药杂志,2016,28(12):73-76.
[23] Martínez-Urbistondo D, Beltrán A, Beloqui O, et al.The neutrophil-to-lymphocyte ratio as a marker of systemic endothelial dysfunction in asymptomatic subjects[J]. Nefrologia,2016,36(4):397-403.
[24] Ozturk C,Balta S,Balta I,et al. Neutrophil-lymphocyte ratio and carotid-intima media thickness in patients with Behcet disease without cardiovascular involvement[J]. Angiology,2015,66(3):291-296.

