衰老心肌中热休克因子1的表达与线粒体损伤的关系
吴林果 刘 丹 武 烨 马新亮 刘慧荣
(1.首都医科大学基础医学院生理学与病理生理学系, 北京 100069; 2.代谢紊乱相关心血管疾病北京市重点实验室,北京 100069; 3.首都医科大学燕京医学院,北京 101300)
衰老是心血管疾病的主要危险因素之一,心血管疾病的发病率随年龄的增高而增加[1]。因此了解心脏衰老的发生、发展机制,对降低老龄化导致的心血管疾病的发病率具有重要意义。
线粒体被认为是介导心肌细胞衰老的关键细胞器[2-3]。心肌细胞中含有丰富的线粒体,在细胞的功能维持方面起着关键的作用。线粒体通过形态及功能的改变[4]来进行自身的自我更新,有研究[5]表明,线粒体形态及功能的改变在心血管疾病中发挥着重要作用,但在衰老心脏中发挥的作用并不清楚。
热休克因子(heat shock factor 1,HSF1)是热休克蛋白的转录因子,在热应激或者某些损伤刺激条件下可调控热休克蛋白的表达,以提高机体在不良环境下的防御能力[6]。在衰老的大鼠骨骼肌中HSF1的表达增多[7],同时也有研究[8]显示在线粒体损伤之后可激活HSF1,从而促进肝癌细胞的侵袭。衰老伴随着线粒体发生损伤,但在衰老的心肌中HSF1的表达是否发生变化,及与线粒体损伤之间是否存在一定的关系并不清楚,因此在本实验中通过检测衰老心肌中HSF1表达的变化,观察衰老心肌中线粒体的形态及功能方面的改变,来明确衰老心肌中HSF1与损伤的线粒体功能之间的关系,为揭示心肌衰老的发生、发展机制及衰老相关心血管疾病的治疗提供了新的线索。
1 材料与方法
1.1 实验动物
根据小鼠和人的生命周期对比,年轻组(young)使用4月龄,老年组(aging)组使用24月龄SPF级成年雄性C57小鼠(C57BL/6),实验动物由爱尔麦特科技有限公司提供,实验动物许可证号:SCXK(苏)2014-007。本实验获得了首都医科大学动物保护协会的批准,并严格遵守首都医科大学实验动物的管理细则。
1.2 主要试剂与材料
H9C2心肌细胞系,购于协和医科大学基础医学细胞中心。Anti-HSF1(#4356,美国CST公司)、 GAPDH抗体(#2118,美国CST公司)、 30%(体积分数)H2O2(KGF009,南京凯基生物)、山羊抗兔IgG/生物素标记(ZB-2301,北京中杉金桥公司)、山羊抗小鼠IgG/生物素标记(ZB-2305,北京中杉金桥公司)、戊二醛(50%体积分数)(G7651,美国Sigma公司)、胎牛血清(FNA500,上海依科赛生物公司)、DMEM高糖培养基(10817014,美国Corning公司)、线粒体膜电位检测试剂盒(C2006,上海碧云天生物技术有限公司)、ATP 含量测定试剂盒(A095-2,南京建成生物工程研究所)、增强型ATP 检测试剂盒(S0027,上海碧云天生物技术有限公司)、活性氧(reactive oxygen species,ROS)测定试剂盒(化学荧光法)(E004,南京建成生物工程研究所)。
1.3 主要仪器
酶标仪(美国Molecular Devices公司); Western blotting电泳仪、Western blotting电转仪、凝胶成像系统(美国Bio-Rad公司);JEM-1400EX透射电子显微镜(日本电子公司)、激光共聚焦显微镜(德国Leica公司)。
1.4 透射电镜观察心肌组织超微结构的改变
小鼠眼球取血处死后,快速剪取新鲜心脏的心尖部,在预冷的2.5%(体积分数)戊二醛中切割成0.5~1.0 mm3,4℃固定2~4 h,1%(体积分数)PB溶液洗3次,每次10 min,所有操作均在冰上进行。处理好的组织送电镜室进行标本制备,所有操作均在冰上进行,用透射电子显微镜观察心肌线粒体的结构改变。
1.5 细胞培养及给药
用含有10%(体积分数)胎牛血清和1%(质量分数)青链霉素的DMEM高糖培养基培养H9C2细胞,置于37 ℃细胞培养箱中,待细胞密度达到90%时传代至6孔板中继续培养,当6孔板中细胞密度达到60%~80%时,给予200 μmol/L H2O2刺激4 h,之后更换为正常培养基培养48 h,进行后续相关实验。
1.6 心肌组织及细胞中ROS的检测
1.6.1 组织ROS检测
称取小鼠心肌组织,按1 g组织20 mL的比例加入缓冲液进行匀浆,1 000×g 离心10 min,取上清液,BCA法测浓度后加入1 mmol/L 2′,7-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA) 的荧光探针,用酶标仪测其荧光强度。
1.6.2 细胞ROS检测
在H2O2刺激后的H9C2心肌细胞中将 DCFH-DA探针加入培养基中,使其浓度达到10 μmol/L, 37 ℃孵育1 h,之后用PBS洗2次,加入0.25%(质量分数)胰酶消化,终止消化后 1 000×g 离心10 min收集细胞,PBS洗2次后进行荧光检测。
1.7 心肌组织及细胞中ATP检测
1.7.1 心肌组织中ATP的检测
准确称取小鼠的心肌组织,按照1 g组织9 mL沸水的比例加入沸双蒸水,使其变成10%(质量分数)匀浆液,并置于沸水中水浴10 min,之后混匀,3 500 r/min离心10 min,取上清液进行检测。
1.7.2 细胞中ATP含量的检测
吸除细胞培养液,按照6孔板每孔加入200 μL裂解液裂解细胞。收集裂解液4℃ 12 000×g离心5 min,取上清,按照试剂盒操作说明配制ATP工作液和标准品,然后进行荧光检测。
1.8 Western blotting法检测心肌组织中相关蛋白表达
剪取适量的心肌组织,按照1 mg组织∶10 μL裂解液比例加入RIPA裂解液,提取心肌组织蛋白,BCA法测蛋白浓度,取30~50 μg的蛋白加入上样缓冲液, 99 ℃变性8 min,SDS-PAGE凝胶电泳后采取湿转方法转膜,转膜条件:400 mA,1 h。5%(质量分数)脱脂奶粉室温封闭1 h,之后加入一抗4 ℃孵育过夜,次日加入辣根过氧化物酶标记的二抗,室温孵育1 h, TBST缓冲液洗涤3次,每次10 min,加入化学发光试剂显影。
1.9 JC-1 检测H9C2 心肌细胞线粒体膜电势
将细胞种至3.5cm细胞培养皿中,用H2O2刺激4 h后弃去培养基,用PBS清洗1次,加入1 mL完全培养基,之后在培养基中加入1 mL JC-1染色工作液混匀,放入细胞培养箱中37 ℃孵育20 min,在孵育期间,冰上配制1×JC-1染色缓冲液。37 ℃孵育结束后,弃上清,用1×JC-1染色缓冲液洗涤2次,之后加入2 mL高糖 DMEM 完全培养基在倒置荧光显微镜下观察。
1.10统计学方法
2 结果
2.1 衰老小鼠心肌中线粒体形态及功能异常
利用透射电镜对年轻小鼠和衰老小鼠心肌的线粒体结构进行观察,结果显示,与年轻组小鼠心肌的线粒体(图1A)相比,衰老小鼠心肌的线粒体轮廓模糊,线粒体膜不完整,线粒体嵴排列紊乱(图1B),在衰老心肌中,心肌细胞中的线粒体结构出现异常。与4月龄的年轻小鼠相比,衰老小鼠心肌组织中ATP的含量降低(1.253±0.059vs0.479±0.122,P=0.012,图1C),而ROS的含量升高(0.853±0.096vs1.550±0.233,P=0.025,图1D),衰老的心肌中线粒体的氧化磷酸化功能出现异常。
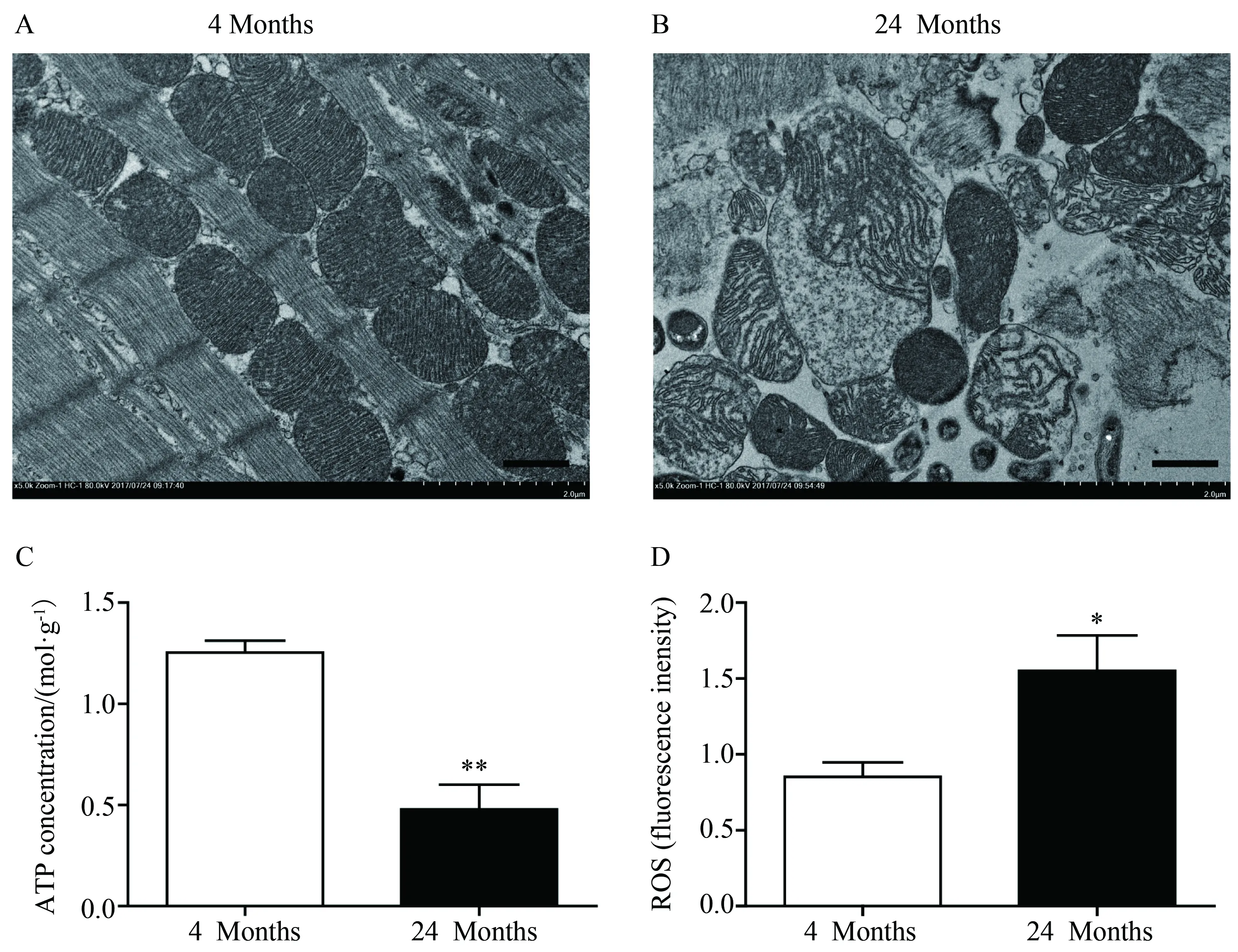
图1 衰老心肌中线粒体的结构及功能的改变Fig.1 Mitochondrial dysfunction in aging myocardium
2.2 衰老小鼠心肌中HSF1表达增高
与年轻组小鼠相比,衰老小鼠心肌组织中HSF1的表达明显升高(0.980±0.112vs1.979±0.175,P=0.013)(图2)。
2.3 衰老心肌中HSF1的表达与ATP含量相关性
对HSF1的蛋白水平与ATP及ROS含量进行了相关性分析,衰老小鼠鼠心肌组织中HSF1的蛋白水平与ATP的含量呈负相关(r=-0.977,P=0.005),与ROS的含量呈正相关(r=0.934,P=0.020)。衰老心肌组织中表达增加的HSF1与线粒体的功能呈负相关(图3)。
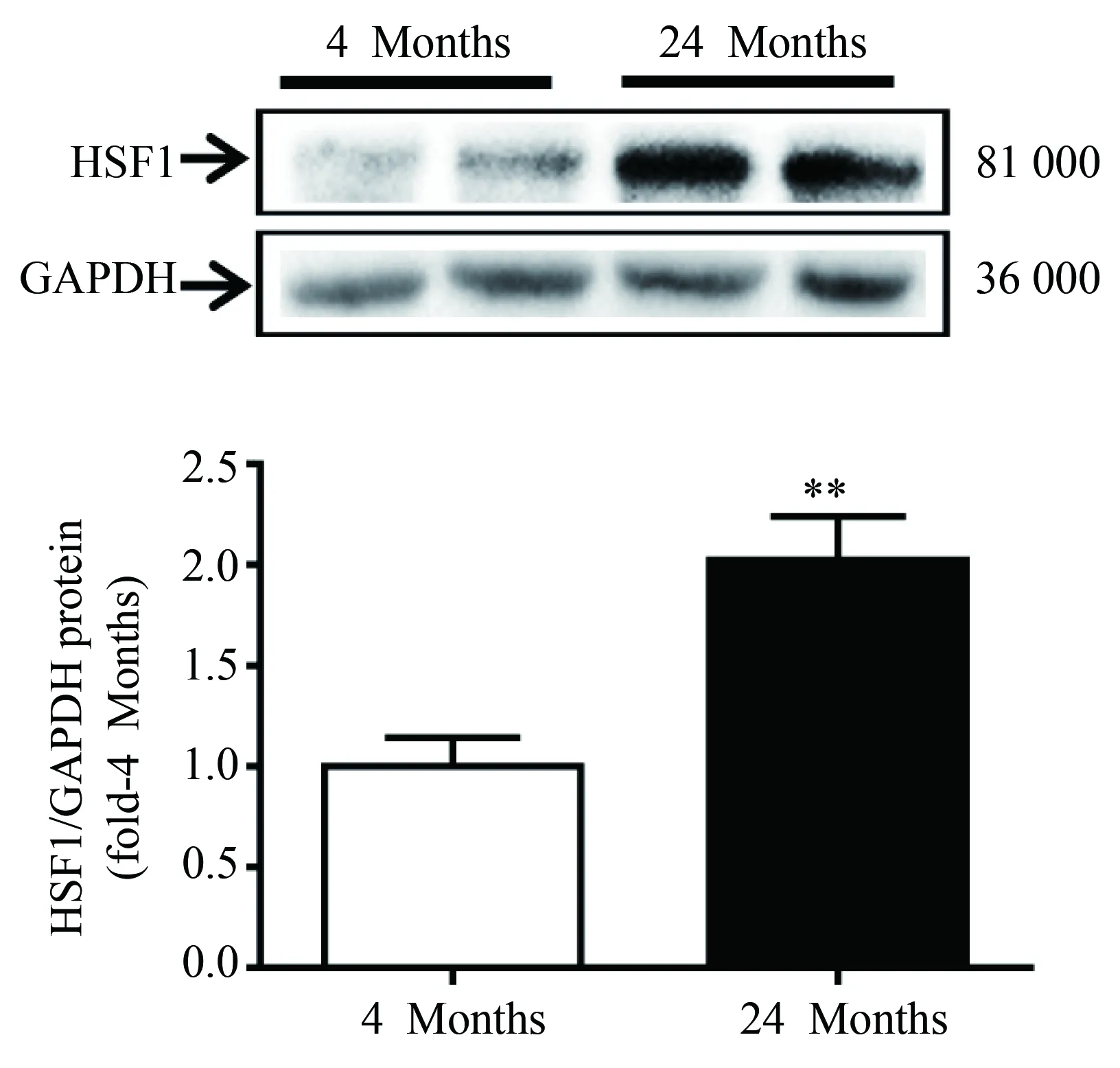
图2 衰老心肌组织中HSF1的表达Fig.2 Expression of HSF1 in the myocardium
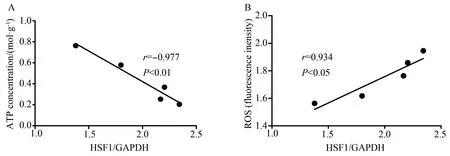
图3 衰老小鼠心肌组织中HSF1的表达与ATP及ROS的相关性分析Fig.3 Correlation analysis between the expression of HSF1 and the function of the mitochondria in aging heart
2.4 H2O2 刺激心肌细胞后线粒体发生损伤
在H2O2刺激后,H9C2心肌细胞的膜电位下降(图4A),同时检测细胞中ATP及ROS含量的变化进一步观察细胞线粒体的功能是否发生损伤,H2O2刺激H9C2细胞中ATP含量下降(1.012±0.071vs0.643±0.095,P=0.007)(图4B),ROS含量上升(1.035±0.046vs1.803±0.28,P=0.020)(图4C)。H2O2刺激后线粒体发生了损伤。
2.5 线粒体损伤的H9C2心肌细胞中HSF1表达升高
在H2O2刺激后心肌细胞中HSF1的表达升高(1.550±0.180vs2.321±0.240,P=0.027)(图5),线粒体的损伤与HSF1的表达存在一定的关系。
3 讨论
衰老是机体多个器官的生理功能随着年龄的增长而逐步减退的过程,引起衰老的原因包括线粒体DNA(mtDNA)突变[9]、氧自由基损伤[10]、DNA损伤[11]等。心脏是重要的能量代谢器官,在心肌细胞中,线粒体体积约占心肌细胞总容积的1/3,并提供心肌所需的90%以上的能量[12],在心脏功能维持方面起着重要的作用。不仅如此,线粒体还是自由基和ROS的主要来源,研究表明,当线粒体的损伤导致其功能发生紊乱时,可直接导致心肌氧化应激水平的升高[13],而ROS是介导衰老相关细胞损伤的主要物质[14],故而线粒体被认为是介导心肌细胞衰老的关键细胞器。而在本实验中通过对心肌组织中线粒体的结构形态和功能变化进行观察,发现在衰老心肌中线粒体形态结构异常,同时衰老心肌中ATP的含量下降,ROS的含量上升,与文献研究[13-14]结果一致。
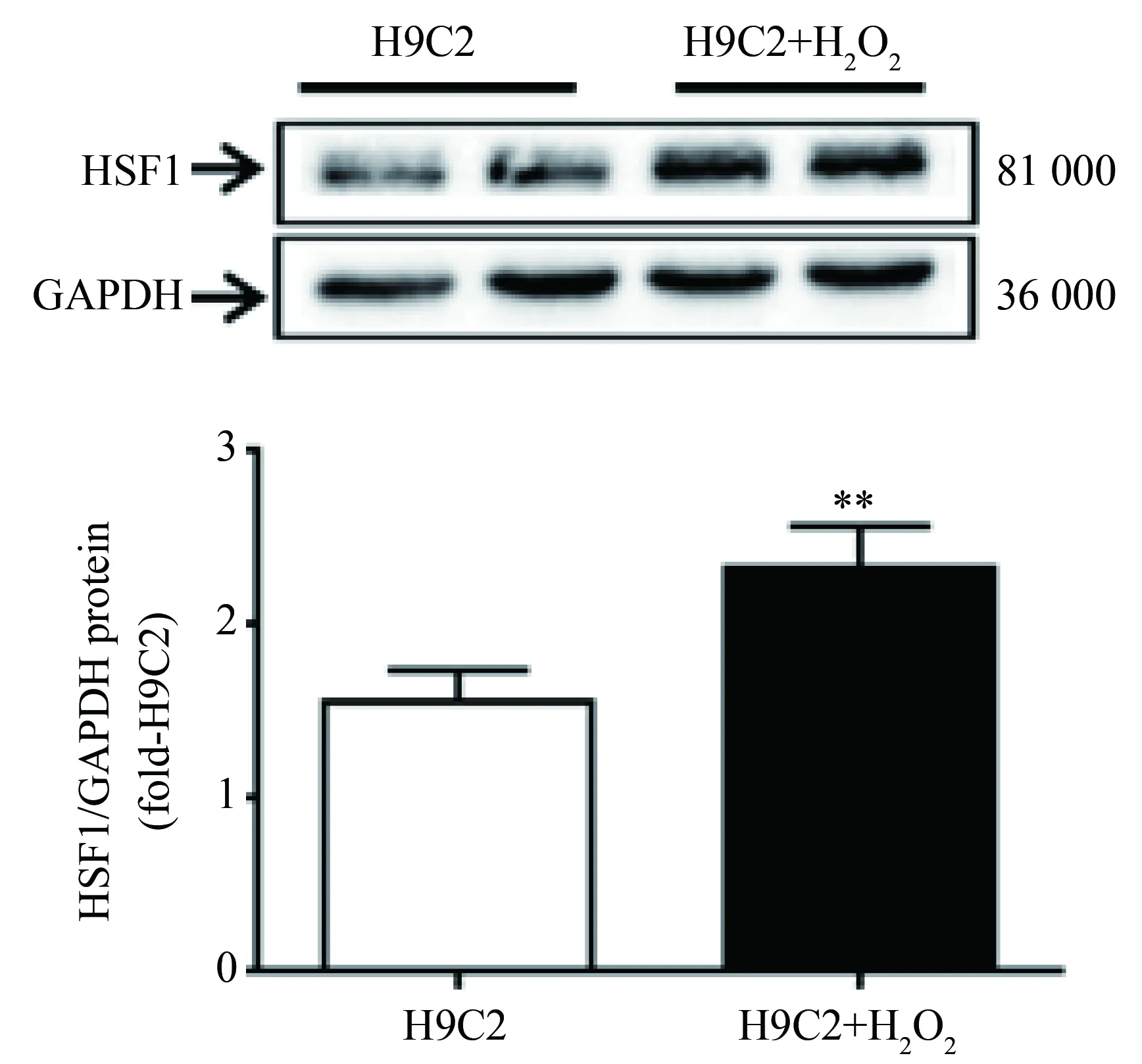
图5 H2O2 刺激引起H9C2细胞中HSF1的表达升高Fig.5 Expression of HSF1 in H9C2 cells after H2O2 treatment compared with H9C2 cell
HSF1是热休克蛋白以及应激蛋白的主要调控因子,参与细胞的分化、应激反应。有文献[15]表明,HSF1可保护心肌细胞免受缺血/再灌注损伤,相关的热休克蛋白也可发挥对心肌细胞的保护作用以此来对抗化疗药物的引起的心肌毒性损伤[16],同时诱导热休克反应还可减轻心房颤动[17]。也有研究[18]显示在氟化物造成的急性损伤中 HSF1在心肌中的表达升高,HSF1还可通过阻断Smad3的激活而作为一种新型的心肌纤维化负性调节剂来抵抗心肌纤维化[19], 这些充分说明了HSF1在心脏疾病中发挥的重要作用。同时HSF1也参与衰老[20]、神经变性[21]、癌症[22]等相关疾病,在维持细胞内平衡等方面发挥着十分重要的作用。
HSF1的降低可使DNA损伤诱导的细胞衰老[23],衰老大鼠的骨骼肌中HSF1的表达升高,这些都提示HSF1参与衰老的进程。但是在衰老的心肌中HSF1的变化并不清楚,因此在本研究中对小鼠心肌组织中HSF1的表达进行了检测,发现在衰老小鼠心肌中HSF1的表达升高,明确了HSF1在衰老心肌中表达的变化。有研究[24]显示,心肌缺血再灌损伤、脓毒血症等因素可诱导HSF1的产生,且在这些过程中均伴随着ROS的增加,另有研究[25-26]显示在肝癌细胞中ROS的产生可以使HSF1激活,这些都表明HSF1和ROS之间有密切的联系。
为了进一步探究线粒体损伤与HSF1之间的关系,笔者用H2O2刺激H9C2细胞构建线粒体损伤的模型,并检测相关指标评估线粒体的功能,JC-1 是一种线粒体定位的荧光染料,可以反映线粒体膜电位的变化,细胞在正常的情况下,JC-1 以红色聚合体(JC-1 aggregates)的形式存在,当线粒体出现膜电位下降时,JC-1 可转变为绿色单体(JC-1 monomer)。
在本实验中也发现在衰老的心肌中线粒体发生损伤,同时心肌组织中ROS的生成增多,且与HSF1的表达呈正相关。所以本研究推测线粒体损伤过程中ROS的变化可能会引起HSF1表达的改变,在小鼠的心肌组织中检测到了线粒体的损伤及ROS含量的升高,而H2O2作为氧化应激模型的常用药物可以使ROS含量升高,使细胞线粒体发生损伤,因此本研究用H2O2刺激H9C2细胞构建线粒体损伤的细胞模型,通过检测细胞中ATP及ROS的变化及线粒体膜电位的变化来评价线粒体的功能,结果显示在线粒体损伤的心肌细胞模型中ATP含量下降,ROS含量上升,线粒体膜电位下降,随后检测HSF1表达的变化,结果显示线粒体损伤后HSF1的表达升高,初步揭示在衰老的心肌中HSF1表达的变化与线粒体是损伤之间存在着一定的联系。
以上研究结果表明,在衰老心肌中线粒体的形态和功能损伤,HSF1的表达升高,且与线粒体的功能呈负相关。本研究初步揭示了衰老心肌中HSF1表达与线粒体损伤的关系,为研究心肌衰老及线粒体损伤提供新的线索,同时也为衰老相关心血管疾病的治疗提供了新的思路。
[1] North B J, Sinclair D A. The intersection between aging and cardiovascular disease[J]. Circ Res,2012,110(8):1097-1108.
[2] Ussher J R, Lopaschuk G D. The malonyl CoA axis as a potential target for treating ischaemic heart disease[J]. Cardiovasc Res, 2008,79(2): 259-268.
[3] Barja G, Herrero A. Oxidative damage to mitochondrial DNA is inversely related to maximum life span in the heart and brain of mammals[J]. FASEB J,2000,14(2):312-318.
[4] Dorn G W, Kitsis R N. The mitochondrial dynamism-mitophagy-cell death interactome: multiple roles performed by members of a mitochondrial molecular ensemble[J]. Circ Res,2015,116(1):167-182.
[5] Hall A R,Burke N,Dongworth R K,et al. Hearts deficient in both Mfn1 and Mfn2 are protected against acute myocardial infarction[J]. Cell Death Dis,2016,7 (5) :e2238.
[6] Christians E S, Yan L J, Benjamin I J. Heat shock factor 1 and heat shock proteins:critical partners in protection against acute cell injury[J]. Crit Care Med,2002,30(1 Suppl):S43-S50.
[7] Karvinen S, Silvennoinen M, Vainio P, et al. Effects of intrinsic aerobic capacity, aging and voluntary running on skeletal muscle sirtuins and heat shock proteins[J]. Exp Gerontol, 2016,79(6):46-54.
[8] Lee J H, Lee Y K, Lim J J, et al.Mitochondrial respiratory dysfunction induces claudin-1 expression via reactive oxygen species-mediated heat shock factor 1 activation,leading to hepatoma cell invasiveness[J]. J Biol Chem,2015,290(35):21421-21431.
[9] Labunskyy V M, Gladyshev V N. Role of reactive oxygen species-mediated signaling in aging[J]. Antioxid Redox Sign, 2013, 19(12): 1362-1372.
[10] Park C B, Larsson N G. Mitochondrial DNA mutations in disease and aging[J]. J Cell Biol, 2011, 193(5): 809-818.
[11] Ou H L,Schumacher B.DNA damage responses and p53 in the aging process[J].Blood,2018,131(5):488-495.
[12] Liu Y, Sato T, O’Rourke B, et al. Mitochondrial ATP-dependent potassium channels: novel effectors of cardioprotection[J]. Circulation,1998, 97(24): 2463-2469.
[13] Liu J, Cao L, Chen J C, et al. Bmi1 regulates mitochondrial function and the DNA damage response pathway[J]. Nature,2009,459(7245):387-392.
[14] Chakrabarti S, Munshi S, Banerjee K, et al. Mitochondrial dysfunction during brain aging: role of oxidative stress and modulation by antioxidant supplementation [J]. Aging Dis,2011,2(3):242-256.
[15] Zou Y, Zhu W, Sakamoto M, et al. Heat shock transcription factor 1 protects cardiomyocytes from ischemia/reperfusion injury[J].Circulation, 2003,108(24):3024-3030.
[16] Venkatakrishnan C D, Tewari A K,Moldovan L, et al. Heat shock protects cardiac cells from doxorubicin-induced toxicity by activating p38 MAPK and phosphorylation of small heat shock protein 27[J]. Am J Physiol Heart Circ Physiol,2006,291(6):2680-2691.
[17] Brundel B J, Shiroshita-Takeshita A, Qi X, et al. Induction of heat shock responde protects the heart against atrial fibrillation[J]. Circ Res,2006,99(12):1394-1402.
[18] Panneerselvam L, Raghunath A, Perumal E. Differential expression of myocardial heat shock proteins in rats acutely exposed to fluoride[J]. Cell Stress Chaperones,2017, 22(5):743-750.
[19] Zhou N, Ye Y, Wang X, et al. Heat shock transcription factor 1 protects against pressure overload-induced cardiac fibrosis via Smad3[J]. J Mol Med (Berl),2017,95(4):445-460.
[20] Hensen S M, Heldens L, van Genesen S T, et al. A delayed antioxidant response in heat-stressed cells expressing a non-DNA binding HSF1 mutant[J]. Cell Stress Chaperones,2013,18(4):455-473.
[21] Verma P, Pfister J A, Mallick S, et al. HSF1 protects neurons through a novel trimerization-and HSP-independent mechanism[J]. J Neurosci,2014,34(5): 1599-1612.
[22] Theriault B L, Basavarajappa H D, Lim H, et al. Transcriptional and epigenetic regulation of KIF14 overexpression in ovarian cancer[J]. PLoS One,2014, 9(3): e91540.
[23] Kim G, Meriin A B, Gabai V L, et al. The heat shock transcription factor Hsf1 is downregulated in DNA damage-associated senescence, contributing to the maintenance of senescence phenotype[J]. Aging Cell,2012,11(4):617-627.
[24] Christians E S, Yan L J, Benjamin I J.Heat shock factor 1 and heat shock proteins: Critical partners in protection against acute cell injury[J]. Crit Care Med,2002,30(Suppl 1):S43-S50.
[25] Ozaki M, Deshpande S S, Angkeow P, et al. Rac1 regulates stress-induced redox-dependent heat shock factor activation[J]. J Biol Chem,2000,275(45):35377-35383.
[26] 费硕,郑桓,张义东,等.锌离子在心肌线粒体保护作用中的研究进展[J].中国煤炭工业医学杂志,2016,19(3):489-492.

