轻度认知障碍静息态功能磁共振研究低频振幅分析
樊 响 杨延辉 贾秀琴 卢 洁 李坤成*
(1.首都医科大学宣武医院放射科,北京 100053;2.磁共振成像脑信息学北京市重点实验室,北京 100053)
阿尔茨海默病(Alzheimer’s disease,AD)是老年期痴呆的最常见类型。AD是以进行性认知功能损害和记忆力下降为特征的常见中枢神经系统变性疾病,一旦发病,尚无有效方法治愈。因此,人们力图早期发现该病,希望及时给予干预,以延缓病程进展。轻度认知障碍(mild cognitive impairment,MCI)是AD的痴呆前期阶段,主要表现为记忆力下降,但是日常生活能力尚好。
功能磁共振成像(functional magnetic resonance imaging,fMRI)是无创伤、活体研究脑功能的常用影像学方法,在被试执行不同任务时,可观察激活脑区(功能中枢)。Biswal等[1]最早提出在静息状态下分析自发性低频震荡信号可反映脑自发活动的观点,与任务态fMRI相比较,静息态fMRI(resting-state fMRI,rs-fMRI)在扫描过程中被试无需配合完成任务,操作简单、易行,尤其适用于患者[2]。在rs-fMRI的后处理方法中,中国学者[3]提出分析低频振荡幅度(amplitude of low-frequency fluctuation,ALFF)以评价自发性脑活动改变的方法,已由一系列文献报道[4-6]证实。
1 对象与方法
1.1 研究对象
依据美国国立老年研究院及阿尔茨海默病协会工作组(National Institute on Aging and the Alzheimer’s Association Workgroup,NIA-AA)2011年推出的AD的轻度认知功能减退阶段即AD所致MCI(MCI due to AD)诊断标准[7]。MCI入组标准:①患者认知减退且经知情者证实;②客观检查有一个或多个认知域损害;③临床痴呆评价量表(Clinical Dementia Rating,CDR)得分为0.5;④日常生活能力正常。选取性别、年龄及教育程度与MCI组相匹配的正常健康老年人作为正常对照组(normal controls,NC),入组标准:①无神经和精神疾病病史;②常规头颅MRI扫描未见异常改变;③无记忆障碍或认知下降等主诉。排除标准:①其他各种已知原因(如严重抑郁,脑血管病,感染、中毒和代谢疾病等)所致痴呆;②有MRI检查禁忌证者(如幽闭恐惧症、心脏起搏器植入等)。本研究所有被试在试验前均签署知情同意书,并完成神经心理学量表评估,包括简易精神状态量表(Mini-Mental State Exam,MMSE)、蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)和CDR。
1.2 数据采集
所有rs-fMRI扫描均在首都医科大学宣武医院放射科磁共振室完成,应用高场强磁共振扫描仪(3.0T Trio,德国Siemens公司)采集三维梯度回波脑结构像和rs-fMRI数据。扫描过程中要求被试保持清醒,平静闭眼,保持不动,不进行思考。采用海绵垫固定被试头部,戴耳塞降低噪音。采用单次激发回波平面成像(echo planar imaging,EPI)脉冲序列获取rs-fMRI数据,具体扫描参数为TR/TE=2 000 ms/40 ms,90°翻转角,4 mm层厚、1 mm层间隔,256 mm×256 mm视野;采用磁化准备快速梯度回波(magnetization-prepared rapid gradient echo,MPRAGE)脉冲序列采集T1加权(T1 weighted imaging,T1WI)脑结构像,具体参数为:TR/TE=1 900 ms/ 2.2 ms,9°翻转角,1 mm层厚,无层间距,在矢状位连续扫描176层。
1.3 图像后处理
采用Dpabi软件包进行图像数据处理[8]。首先进行图像预处理,剔除前10个时间点的图像数据,然后进行层间时间校正、头动校正、配准、图像分割、再进行空间标准化至蒙特利尔神经研究所(MNI)空间,采用6 mm全宽半高(full width at half maximum,FWHM)的高斯卷积核对标准化后的图像进行空间平滑处理,提高信噪比,进一步去线性漂移、噪声回归,利用傅立叶变换在0.01~0.08 Hz频段对所得信号进行带通滤波,以除去低频漂移、高频噪声的影响。应用傅立叶变换将预处理图像每个体素的时间序列转换为频率范围,获得功率谱。将全脑每个体素内信号频率的功率谱进行开方后平均,进而得到0.01~0.08 Hz频段的ALFF值并对获得的ALFF值进行标准化。
1.4 统计学方法
应用SPSS 19.0进行人口学数据的统计学处理,将两组的年龄、受教育年限、MMSE及MoCA分数进行两独立样本t检验,以P<0.05为差异有统计学意义。在Dpabi软件包中采用两独立样本t检验,以性别、年龄、受教育程度为协变量,将MCI与正常对照组标准化后的0.01~0.08 Hz频段的ALFF值进行统计学分析。
2 结果
本研究共纳入100例被试,其中50例MCI(男性26例、女性24例),50例为NC组(男性23、女性27例),均为右利手,MCI组CDR均为0.5分,NC组CDR均为0分,人口统计学资料详见表1。两组的性别组成、年龄及受教育年限差异无统计学意义。
表1 MCI与NC组人口学特征Tab.1 Demographic characteristics of MCI and NC groups
将连续激活体素数大于20个体素以上,非校正P值<0.001的脑区定义为差异有统计学意义区域。与正常对照组比较,MCI组的双侧海马旁回、双侧尾状核、左侧壳核和左侧岛叶的ALFF减弱。本组病例未检测出ALFF增强脑区(图1,表2)。
3 讨论
AD的发生机制通常被认为与β-淀粉样蛋白(amyloid β-protein,Aβ)沉积相关[9]。已有rs-fMRI研究[10]表明,Aβ沉积的部位与默认网络(default mode network,DMN)具有高度重叠性。本研究是基于ALFF算法的rs-fMRI研究,得到的ALFF值能较直接反映静息状态下大脑低频振荡活动情况,本研究旨在探索MCI与NC组的ALFF值是否有差异。
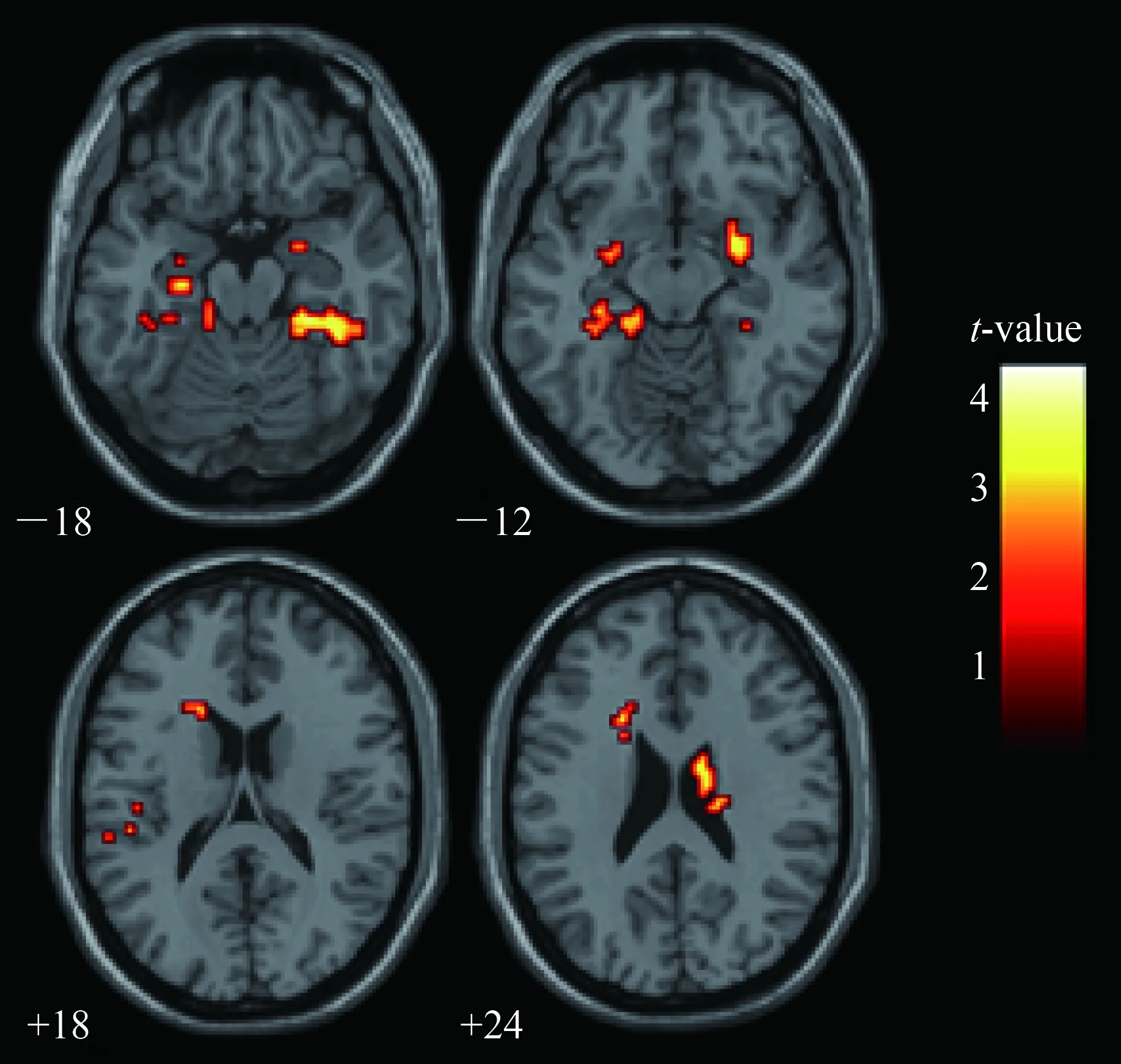
图1 MCI组ALFF显著降低的脑区Fig.1 Brain regions of decreased ALFF in MCI group
内颞叶(medial temporal lobe,MTL)包含海马、海马旁回、内嗅皮质和杏仁核等区域,参与信息储存、提取,与情景记忆密切相关,在长期回忆和短期记忆中发挥关键作用。本研究显示MCI双侧海马旁回ALFF值较NC组低,提示脑活动减弱,与一些文献[5-6,11]报道结果相似,其中部分研究者认为上述改变与患者认知表现及神经心理学量表评分减低相一致。MTL是AD早期即出现病理改变的脑区[12]。但是,也有一些MCI研究[13-15]未见海马或海马旁回的ALFF改变,可能与不同研究组搜集MCI病例的病情程度不同,且MCI具有较大异质性有关。
基底节是参与认知活动的重要皮质下结构。既往有研究[11]显示MCI基底节ALFF值减低。本研究显示MCI双侧尾状核、左侧壳核ALFF值减低,与之结果相符合。既往也有文献[13-14]显示壳核在MCI认知减退中发挥一定作用;但关于尾状核改变的报道较少[15],本研究证实了上述文献报道的ALFF改变。
本研究首次发现MCI左侧岛叶ALFF减低,提示左侧岛叶脑功能活动减弱。岛叶是边缘系统的重要组成部分,参与内脏活动,并在认知、语言、运动、感觉、多模态感觉整合等方面发挥重要作用[16]。rs-fMRI功能连接的研究[17]显示岛叶与前扣带回及额叶皮质有较强连接。一项高角度分辨率弥散成像(high angular reso1ution diffusion imaging,HARDI)研究[18]显示,岛叶前部与前额叶皮质腹外侧纤维连接密切。有研究[19]显示AD的岛叶ALFF值在不同频段(slow-5:0.01~0.027 Hz,slow-4:0.027~0.073 Hz)具有显著差异。有研究[20]应用全脑三维伪连续动脉自旋标记成像研究AD脑灌注,结果表明左侧岛叶的灌注减低。MCI的功能连接与ALFF线性回归的结果提示岛叶是显著相关的脑区之一[21]。MCI默认网络的左侧额中回、额下回与左侧岛叶的功能连接下降[22]。本研究组发现MCI的Meynert核与左侧岛/屏状核的功能连接显著减低[23]。目前,MCI与岛叶关系的研究少见,岛叶在AD发展过程中扮演何种角色,尚有待于进一步研究。
文献[5,11,15]显示MCI的ALFF值减低脑区最多见于扣带回,而且额顶叶ALFF增强[6,14],后者提示脑功能代偿。本研究未见扣带回ALFF值减低和ALFF增强脑区,可能与MCI自身的异质性或样本量相关,也可能提示MCI的脑功能代偿机制不是一个连续存在的过程。
由于样本量较小、未进行随访观察且未将ALFF不同频段进行差异分析,本研究结果存在着一定的局限性,需要更大样本的纵向研究来进一步证实。
本研究采用rs-fMRI技术,运用ALFF方法进行分析,显示MCI在静息状态下双侧海马旁回、双侧尾状核、左侧壳核和左侧岛叶等脑区的脑功能活动减弱,为进一步探索MCI的神经病理学机制奠定了基础。
[1] Biswal B, Yetkin F Z, Haughton V M, et al. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J]. Magn Reson Med, 1995,34(4):537-541.
[2] 王志群, 李坤成. 阿尔茨海默病的静息态功能磁共振、弥散张量成像及脑灌注研究进展[J]. 首都医科大学学报, 2015,36(4):640-644.
[3] Zang Y F, He Y, Zhu C Z, et al. Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J]. Brain Dev, 2007,29(2):83-91.
[4] Zou Q H, Zhu C Z, Yang Y, et al. An improved approach to detection of amplitude of low-frequency fluctuation (ALFF) for resting-state fMRI: fractional ALFF[J]. J Neurosci Methods, 2008,172(1):137-141.
[5] Zhao Z L, Fan F M, Lu J, et al. Changes of gray matter volume and amplitude of low-frequency oscillations in amnestic MCI: an integrative multi-modal MRI study[J]. acta Radiol, 2015,56(5):614-621.
[6] 席芊, 赵小虎, 王培军, 等. 遗忘型轻度认知损害患者基于低频振幅的静息态功能磁共振成像研究[J]. 上海交通大学学报:医学版, 2014,34(8):1162-1166.
[7] Albert M S, DeKosky S T, Dickson D, et al. The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Dement, 2011,7(3):270-279.
[8] Yan C G, Wang X D, Zuo X N, et al. DPABI: data processing & analysis for (resting-state) brain imaging[J]. Neuroinformatics, 2016,14(3):339-351.
[9] Doré V, Villemagne V L, Bourgeat P, et al. Cross-sectional and longitudinal analysis of the relationship between Abeta deposition, cortical thickness, and memory in cognitively unimpaired individuals and in Alzheimer disease[J]. JAMA Neurol, 2013,70(7):903-911.
[10] Buckner R L, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease[J]. J Neurosci, 2009,29(6):1860-1873.
[11] Han Y, Wang J, Zhao Z, et al. Frequency-dependent changes in the amplitude of low-frequency fluctuations in amnestic mild cognitive impairment: a resting-state fMRI study[J]. NeuroImage, 2011,55(1):287-295.
[12] Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes[J]. Acta Neuropathol, 1991,82(4):239-259.
[13] Ren P, Lo R Y, Chapman B P, et al. Longitudinal alteration of intrinsic brain activity in the striatum in mild cognitive impairment[J]. J Alzheimers Dis, 2016,54(1):69-78.
[14] 李阳. 神经心理学量表及fMRI低频振幅在阿尔茨海默病早期诊断中的应用[D]. 重庆:重庆医科大学, 2014.
[15] 吴钦娟. AD、MCI患者情景记忆与静息脑功能活动关系的研究[D]. 青岛: 青岛大学, 2013.
[16] 牛朝诗, 李冬雪. 提高岛叶应用解剖认识,规范岛叶外科手术行为[J]. 中华解剖与临床杂志, 2016,21(6):498-500.
[17] Cauda F, D’Agata F, Sacco K, et al. Functional connectivity of the insula in the resting brain[J]. Neuroimage, 2011,55(1):8-23.
[18] 陈一勇, 尹维刚, 林荣, 等. 成人岛叶纤维连接的显示和分析[J]. 解剖学杂志, 2014,37(5):661-663, 675.
[19] Liu X, Wang S, Zhang X, et al. Abnormal amplitude of low-frequency fluctuations of intrinsic brain activity in Alzheimer’s disease[J]. J Alzheimers Dis, 2014,40(2):387-397.
[20] 王筝, 傅雪梅, 曾祥柱, 等. 基于3D动脉自旋标记技术核磁灌注成像中动脉通过时间的研究[J]. 中国医疗设备, 2015,30(9):24-26, 5.
[21] Mascali D, DiNuzzo M, Gili T, et al. Intrinsic patterns of coupling between correlation and amplitude of low-frequency fMRI fluctuations are disrupted in degenerative dementia mainly due to functional disconnection[J]. PLoS One, 2015,10(4):e0120988.
[22] Li M, Zheng G, Zheng Y, et al. Alterations in resting-state functional connectivity of the default mode network in amnestic mild cognitive impairment: an fMRI study[J]. BMC Med Imaging, 2017,17(1):48.
[23] Li H, Jia X, Qi Z, et al. Altered functional connectivity of the basal nucleus of meynert in mild cognitive impairment: a resting-state fMRI study[J]. Front Aging Neurosci, 2017,9:127.

