血管紧张素转化酶2对肝细胞凋亡的影响
宋丽妮 曹 曦 刘 薇 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730;2.糖尿病防治研究北京市重点实验室,北京 100730)
肾素-血管紧张素系统(renin-angiotensin system, RAS)在冠状动脉粥样硬化性心脏病(以下简称冠心病)、糖尿病心肌病及糖尿病肾病中起重要作用。ACE2-Ang-(1-7)-MAS轴作为新发现的 RAS 调节轴, 可拮抗经典轴ACE/AngⅡ/AT1(Ang Ⅱ type 1 receptor)的生物效应[1]。近年来,研究[2]显示肝细胞的异常凋亡与各种急、慢性肝病的发生、发展和预后以及肝脏恶性肿瘤的形成密切相关。肝脏作为胰岛素作用的主要靶器官,同时也是脂代谢的重要器官,对于机体糖脂代谢的调节起着十分重要的作用,肝细胞的过度凋亡,可严重影响肝脏功能,从而引起或加重糖、脂代谢紊乱。目前,有研究[3-7]表明ACE2过表达可以改善氧化应激、炎性反应以及内质网应激等,从而减少小鼠胰岛细胞[3]与肺内皮细胞[4]、大鼠视网膜内皮细胞[5]、人脐静脉内皮细胞[6]以及心肌细胞[7]的凋亡,但其对肝细胞的生长与凋亡的影响及具体机制尚不明确。本文将通过以棕榈酸处理人肝癌细胞(HepG2 cell)诱导凋亡的细胞模型探讨ACE2对肝细胞生长和凋亡的影响及其作用机制。
1 材料与方法
1.1 实验动物
8周龄雄性野生型C57BL/6小鼠,体质量18~24 g,购自北京维通利华实验动物中心,实验动物许可证号:SCXK(京) 2016-0011,ACE2-/y小鼠由Prof. Dr. Josef Penninger from Institute for Molecular Biotechnology GmbH教授馈赠。实验所使用的所有动物均经过首都医科大学附属北京同仁医院动物委员会批准,SPF级别动物房饲养。
1.2 细胞培养
人肝癌细胞株HepG2 细胞购自中国协和医科大学细胞资源中心(Cell Resource Center, IBMS, CAMS /PUMC),用含10%(体积分数)胎牛血清(fetal bovine serum,FBS)的DMEM 进行体外培养(100 U/mL青霉素和0.1 mg/mL链霉素),调整细胞密度为 2×105个/mL, 分别接种于96 孔板、6孔板,置37 ℃ 、5% (体积分数)CO2饱和湿度的 CO2孵箱内培养。 HepG2 细胞在Ad-rACE2-eGFP[adenovirus coding for rat ACE2 (rACE2) upstream of an enhanced green florescent protein,购自Sino-GenoMax, China]病毒(1.0×107pfu/mL)或对照Ad-eGFP(adenovirus of an enhanced green florescent protein)病毒(1.0×107pfu/mL)孵育24 h后荧光显微镜观察病毒感染效率。
1.3 细胞活性检测(MTT)法
以不同浓度(0、0.25、0.4、0.8、1.0 mmol/L)棕榈酸[8]分别处理已感染ACE2腺病毒或GFP病毒的HepG2细胞,于各组中(96孔培养板)加入MTT[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazoliumbromide, 美国Sigma公司]10 μL置37 ℃孵箱孵育4 h,用磷酸缓冲盐溶液(phosphate buffered saline, PBS)洗涤两次,每孔加150 μL 二甲基亚砜(DMSO, 美国Sigma公司),振荡,孵育30 min,置多功能酶联免疫检测仪上测每孔570 nm 吸光度值。
1.4 TUNEL法检测肝细胞凋亡
采用北京全式金生物公司(TransGen Biotech)提供的TUNEL细胞凋亡检测试剂盒测定同周龄雄性ACE2-/y和C57BL/6小鼠肝脏中的细胞凋亡情况。具体步骤严格按说明书进行操作。高倍荧光显微镜(Leica)随机选取4个视野进行观察,与细胞核重叠并且发绿光的为阳性细胞,即凋亡肝细胞。
1.5 RNA 的提取和实时定量 RT-PCR
应用Trizol法抽提HepG2细胞总RNA(Invitrogen公司,美国),以2 mg RNA 为模板利用Rever TraAceqPCR RT试剂盒(Toyobo 公司,日本) 反转出cDNA。利用ABI GeneAmp 5700PCR系统(Applied Biosystems公司,美国),SYBR Green PCR master mix反应液检测RNA 的表达。 经分析系统进行相关表达的定量。 引物序列如表1。
1.6 Western blotting
在4 ℃条件下,加入裂解液提取HepG2细胞蛋白。用BCA蛋白分析试剂盒测定样品蛋白浓度。每个样本取30 ~ 60 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上,用含5% (质量分数)脱脂奶粉的TBST[TBS+0.1%(质量分数)Tween-20]溶液封闭1.5 h,用封闭液将一抗按照一定比例稀释(抗Bcl-2、Bax、caspase-3、cleaved-caspase-3、JNK、P-JNK、CHOP、beta-actin抗体均购自Cell signaling technology,抗ACE2抗体购自美国Santa Cruz公司),将膜与一抗4 ℃摇床孵育过夜。次日TBST漂洗3次,每次5 min,再与辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(1∶2 000)室温孵育1 h,TBST漂洗3次,每次10 min,以肌动蛋白(beta-actin)作为内参,滴加增强化学发光(enhanced chemiluminescence, ECL)发光液后用Chemi-Doc Touch凝胶成像系统显影成像,并用Image J软件对图像进行灰度分析。分别计算出Bcl-2、Bax、caspase-3、cleaved-caspase-3、JNK、P-JNK和CHOP与内参beta-actin的吸光度积分值之比分别作为其相对含量值。
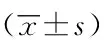
表1 引物序列Tab.1 Primer sequence
1.7 统计学方法
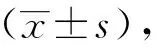
2 结果
2.1 ACE2载体感染HepG2细胞
将Ad-rACE2-eGFP和Ad-eGFP分别感染HepG2细胞,24 h后观察绿色荧光蛋白表达情况。两种GFP荧光均有明显表达,两种腺病毒均成功感染HepG2细胞(图1A)。采用Western blotting检测ACE2蛋白在HepG2细胞中的表达,ACE2蛋白在HepG2细胞中有表达,GFP组相较正常对照组ACE2的表达有增长趋势,但差异无统计学意义(P>0.05)。而HepG2细胞经ACE2腺病毒感染的ACE2组相较于control组和GFP组其ACE2蛋白的表达显著增加,其中ACE2组相较于GFP组其ACE2蛋白的表达明显增加且差异有统计学意义 (P<0.05,图1B)。
2.2 ACE2改善了棕榈酸诱导的HepG2细胞的凋亡
HepG2细胞在转染Ad-rACE2-eGFP或Ad-eGFP后以不同浓度棕榈酸处理24 h。MTT结果显示,两组随着棕榈酸浓度的增加细胞活性均逐渐下降,当棕榈酸浓度分别为0.4、0.8、1.0 mmol/L时过表达ACE2的HepG2细胞活性明显高于对照GFP组,差异有统计学意义。其中棕榈酸浓度为0.4 、1.0 mmol/L时(P<0.05),棕榈酸浓度为0.8 mmol/L时过表达ACE2组较对照GFP组其细胞存活率显著增加(P<0.001),详见图2。
2.3 ACE2敲除小鼠肝细胞凋亡增多
同周龄成年雄性ACE2敲除小鼠的肝脏石蜡切片经TUNEL染色结果显示,其凋亡细胞数明显多于野生型C57BL/6小鼠(图3)。ACE2基因的敲除增加了肝细胞的凋亡。
2.4 ACE2对凋亡及内质网应激相关基因表达的影响
将ACE2过表达于HepG2细胞后,采用RT-PCR方法检测凋亡及内质网应激相关基因水平的表达。ACE2过表达HepG2细胞后,与对照GFP组相比,抗凋亡基因Bcl-2的mRNA明显升高,而促凋亡基因Bax、caspase-3、caspase-12的mRNA均显著降低,ACE2有抑制细胞凋亡的作用(图4A)。与此同时,内质网应激凋亡通路相关IRE1a、Xbp1、PERK、ATF6、GRP78、CHOP、GADD34的mRNA水平均显著降低图4B。
2.5 ACE2对凋亡通路相关蛋白表达的影响
将ACE2过表达于HepG2细胞后,检测凋亡通路相关蛋白(Bcl-2、Bax、caspase-3、cleaved-caspase-3、P-JNK、JNK、CHOP)的表达。Western blotting分析结果显示,经PA处理的3组之间总的caspase-3和JNK的表达均无差异。同时,经PA处理的GFP组相较于正常对照组Bcl-2、Bax、P-JNK以及CHOP的表达无差异,其中cleaved-caspase-3有升高趋势,但差异无统计学意义。而ACE2组与GFP组比较,抗凋亡Bcl-2蛋白表达明显升高,其凋亡通路相关基因Bax、cleaved-caspase-3、P-JNK、CHOP蛋白水平显著降低(图5,P<0.05)。
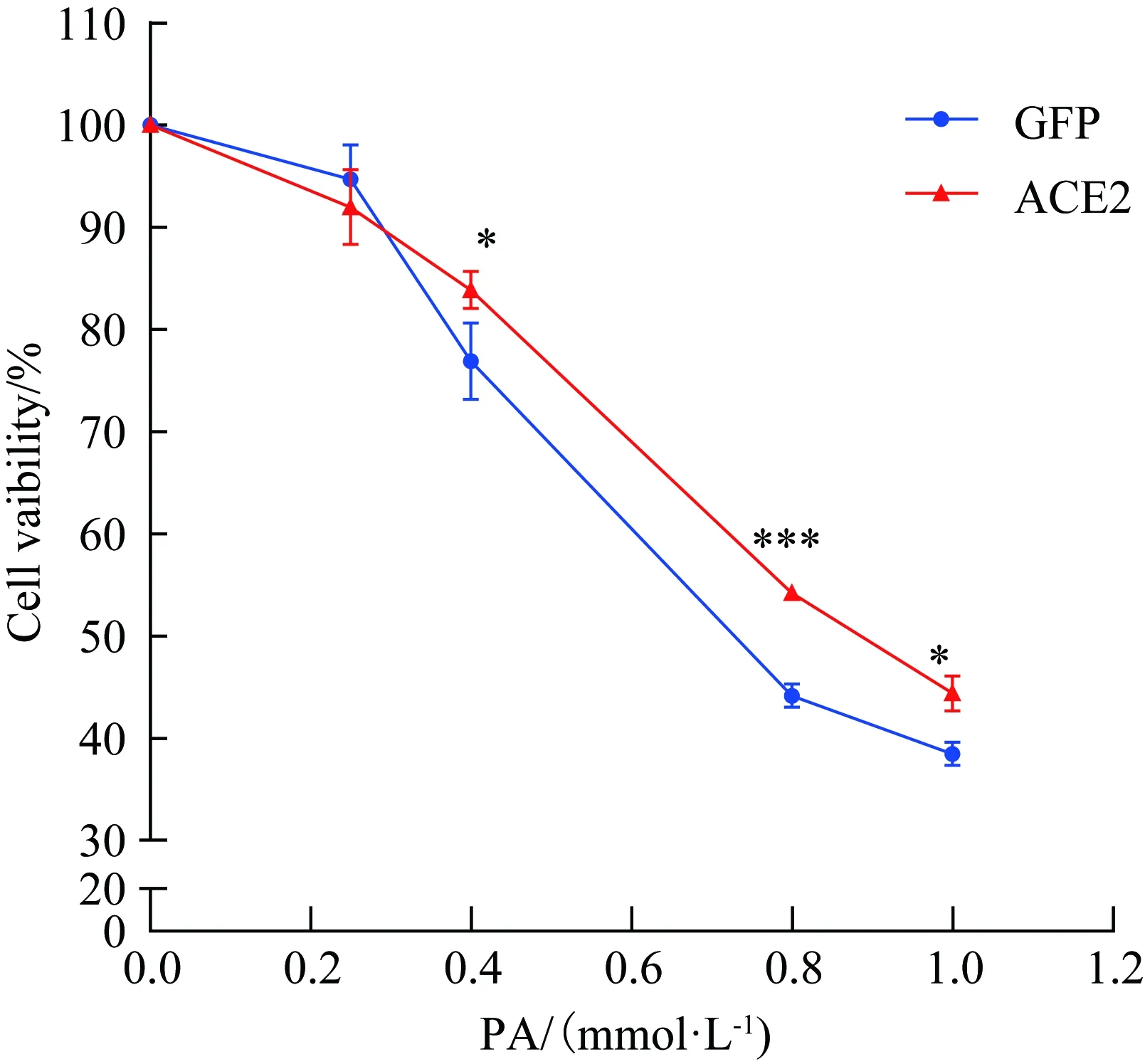
图2 MTT法检测不同处理下细胞活性Fig.2 MTT assay measuring cell viability in HepG2 cells
3 讨论
糖尿病作为一种以自身胰岛素分泌不足和胰岛素抵抗为主要特征的疾病,发病率逐年升高。肝脏作为糖脂代谢的主要器官,肝脏胰岛素抵抗被认为是2 型糖尿病的主要原因之一,并且在糖尿病不断发展的过程中也同样会导致一系列的肝功能损伤,从而形成恶性循环[9]。所以,肝细胞的正常代谢与生长状态直接影响着机体的糖脂代谢平衡。本课题组[3]的前期研究表明,ACE2基因敲除的小鼠表现为糖耐量受损及胰岛素分泌功能障碍,而ACE2的上调可以通过减少胰岛细胞的氧化应激与凋亡从而对胰岛素分泌起到保护作用。笔者研究结果表明,ACE2敲除小鼠肝脏中凋亡的肝细胞明显增多,而在棕榈酸处理下经ACE2过表达载体转染的HepG2细胞活力显著增高。所以,ACE2与肝细胞凋亡之间存在一定的联系,并且ACE2基因敲除小鼠表现的糖耐量受损很可能与肝细胞凋亡增多有关。
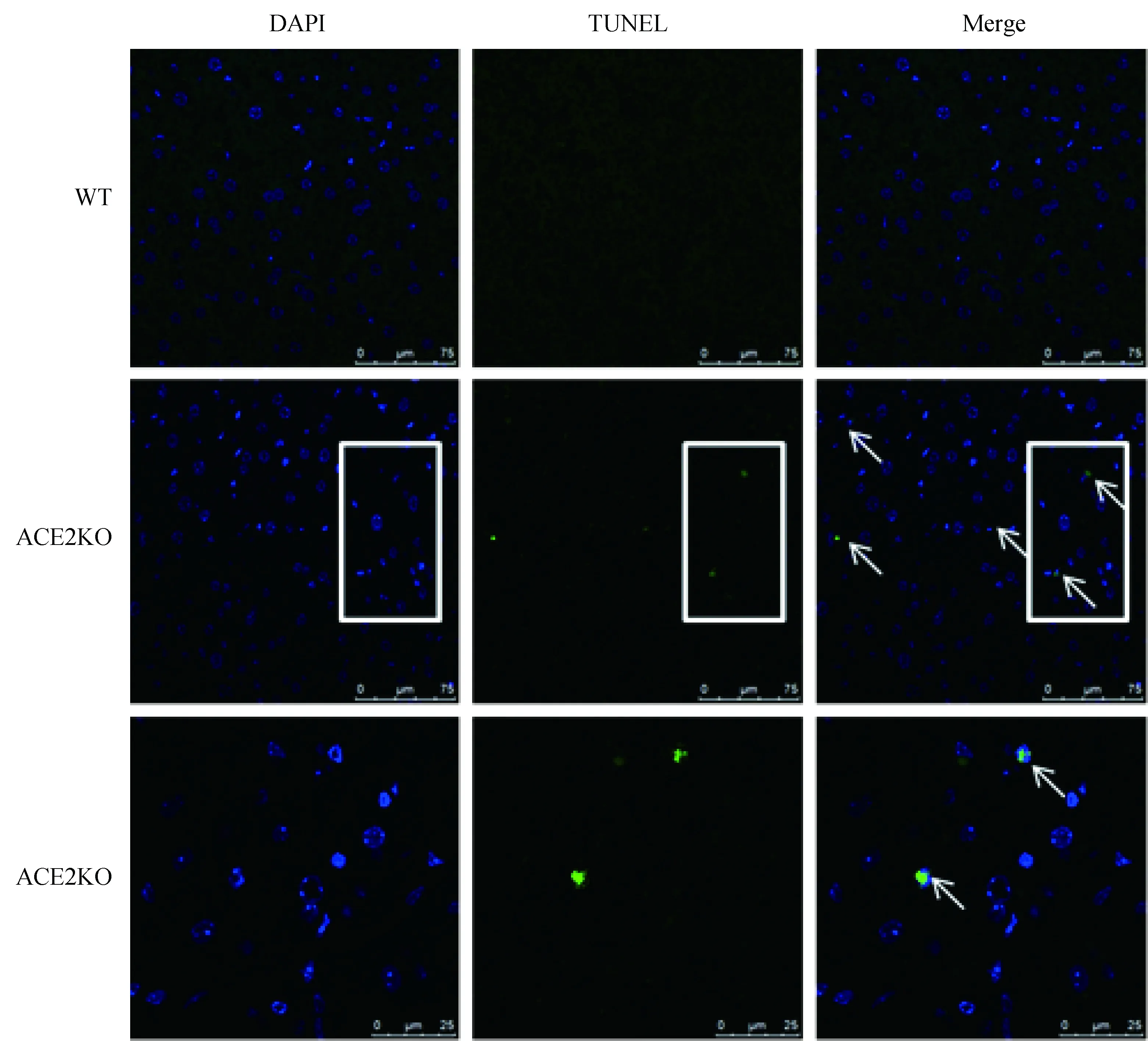
图3 细胞原位TUNEL法(绿色)检测肝细胞的凋亡Fig.3 Liver cell apoptosis detected by TUNEL(green)
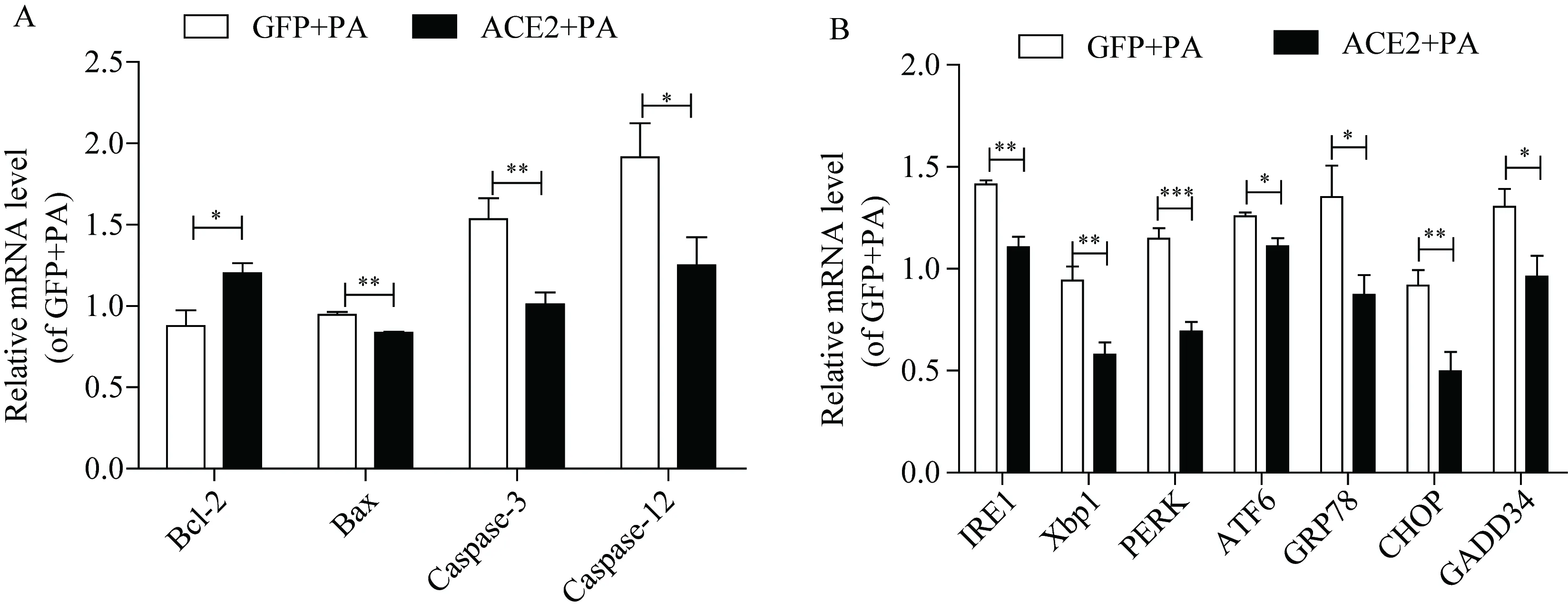
图4 ACE2对凋亡及内质网应激相关基因表达的影响Fig.4 Effect of ACE2 on apoptosis and endoplasmic reticulum stress-related gene expression
棕榈酸可以对细胞产生脂毒性从而引起内质网应激和细胞凋亡[10]。在内质网应激(endoplasmic reticulum stress, ERS)早期,ER通过减少蛋白合成以及降解蓄积的错误折叠或未折叠蛋白质来维持细胞正常功能,但当ERS过强或持续时间过久,细胞通过激活非折叠蛋白反应(unfold protein response, UPR)[11],继而诱导ERS下游C-Jun氨基酸末端激酶(JNK)、C/EBP同源蛋白(CHOP)和含半胱氨酸的天冬氨酸蛋白水解酶12(caspase-12)基因的表达[12],最终直接或间接的引起级联凋亡反应,激活下游的caspase-3从而引起细胞凋亡[13]。Caspase-3通路是经典的凋亡通路,其表达上调提示细胞凋亡水平的增加[14]。在本研究中,笔者以棕榈酸处理HepG2细胞诱导凋亡为模型,并以ACE2过表达载体转染细胞,在此基础上检测到内质网应激诱导细胞凋亡的IRE1/JNK/Bax/caspase-3通路,PERK/ATF4/CHOP/caspase-3通路以及caspase-12 基因[15]的表达均显著降低。该现象表明ACE2可以通过抑制caspase-3通路从而减少凋亡的发生,其机制可能是ACE2改善了细胞内质网应激的水平,从而降低UPR介导的细胞凋亡通路相关蛋白的表达。
本研究证实了ACE2可以通过改善内质网应激从而减少肝细胞的凋亡,但还存在以下不足:目前的实验结果为体外实验,下一步笔者计划在ACE2敲除小鼠及高脂喂养小鼠模型上进一步观察ACE2-Ang(1-7)-Mas轴对肝细胞内质网应激及糖脂代谢的影响。目前,ACE2对内质网应激的影响得到证实,但其具体机制还需进一步探讨,笔者将在线粒体和内质网方面进行进一步研究。
综上所述,本研究结果表明,ACE2上调可以减少肝细胞的凋亡,这一过程可能是通过降低内质网应激水平来实现的。本研究结果进一步明确了ACE2在肝细胞生长与凋亡中的调节作用,并为糖尿病的治疗提供了新的线索。
[1] Jia Y, Xi Z, Yu X, et al. Renin-angiotensin system activation accelerates atherosclerosis in experimental renal failure by promoting endoplasmic reticulum stress-related inflammation[J]. Int J Mol Med, 2017, 39(3):613.
[2] Kroy D C, Fabienne S, Pierluigi R, et al. Hepatocyte specific deletion of c-Met leads to the development of severe non-alcoholic-steatohepatitis in mice[J]. J Hepatol, 2014, 61(4):883-890.
[3] 史婷婷, 杨芳远, 曹曦,等. 血管紧张素转化酶2减少胰岛细胞的氧化应激及凋亡[J]. 首都医科大学学报, 2017,38(2):151-155.
[4] Ji Y, Gao F, Sun B, et al. Angiotensin-converting enzyme 2 inhibits apoptosis of pulmonary endothelial cells during acute lung injury through suppressing SMAD2 phosphorylation[J]. Cell Physiol Biochem, 2015, 37(2):759-767.
[5] 林振浩, 倪云杰, 侯良磊,等. 替米沙坦通过上调大鼠视网膜ACE2-Ang-(1-7)-Mas轴抑制细胞凋亡[J]. 中华心血管病杂志, 2015, 43(7):625-630.
[6] 晋学庆, 王前胜, 卢卓强,等. 血管紧张素转化酶2基因过表达改善人脐静脉内皮细胞生长[J]. 福建医科大学学报, 2012, 46(5):310-314.
[7] 陈旭. ACE2基因过表达对糖尿病心肌病内质网应激介导的心肌细胞凋亡的研究[D]. 济南: 山东大学, 2014.
[8] Jung T W, Hwang H J, Hong H C, et al. Resolvin D1 reduces ER stress-induced apoptosis and triglyceride accumulation through JNK pathway in HepG2 cells[J]. Mol Cell Endocrinol, 2014, 391(1-2):30-40.
[9] Bechmann L P, Hannivoort R A, Gerken G, et al. The interaction of hepatic lipid and glucose metabolism in liver diseases[J]. J Hepatol, 2012, 56(4):952-964.
[10] Gentile C L, Frye M, Pagliassotti M J. Endoplasmic reticulum stress and the unfolded protein response in nonalcoholic fatty liver disease[J]. Antioxid Redox Signal, 2011, 15(2):505-521.
[11] Degracia D J, Kumar R, Owen C R, et al. Molecular pathways of protein synthesis inhibition during brain reperfusion|[colon]| Implications for Neuronal Survival or Death[J]. J Cerebral Blood Flow Metab, 2002, 22(2):127-141.
[12] Xu X, Liu T, Zhang A, et al. Reactive oxygen species-triggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation ofcCaspase-12, CHOP, and the JNK pathway in toxoplasma gondii infection in mice[J]. Infect Immun, 2015, 83(4):1735.
[13] 吴涛, 季光, 郑培永,等. 内质网应激与肝细胞凋亡[J]. 世界华人消化杂志, 2007, 15(23):1569-1576.
[14] Zhu B, Zhang L, Zhang Y, et al. DNase I aggravates islet β-cell apoptosis in type 2 diabetes[J]. Mol Med Rep, 2016, 13(6):4577.
[15] Hetz C, Chevet E, Harding H P. Targeting the unfolded protein response in disease[J]. Nat Rev Drug Dis, 2013, 12(9):703-719.
——疾病防治的新靶标

