以肝病为首发表现的Wilson病患者病理及突变位点分析
李 慢,周新刚,张 亮,王 鹏
首都医科大学附属北京地坛医院病理科,北京 100015
Wilson病(Wilson’s disease, WD),又称肝豆状核变性综合征(hepatolenticular degeneration, HLD),是一种常染色体隐性遗传的铜代谢障碍引起的疾病[1],全世界范围的WD患病率为1/30 000~1/100 000。WD基因位于人13号染色体[2],表达产物为能够参与铜跨膜转运的P型三磷酸腺苷酶(ATP7B)[3]。WD患者因为ATP7B基因发生突变,导致铜跨膜转运蛋白功能异常,铜在机体内沉积,铜离子的过多蓄积会导致机体发生肌肉震颤、角膜色素环、肝硬化和神经退行性病变等[4]。ATP7B基因共包含21个外显子和20个内含子,全长80 kb,目前已经报道存在500多种突变位点[5]。
WD患者ATP7B基因所有的外显子都可以发生突变,由于种族地域和临床表现的差异,ATP7B基因突变位点不同。通过对ATP7B基因外显子测序研究,有助于我们进一步完善对WD的认识。本研究通过对以肝病为首发表现的中国WD患者ATP7B基因外显子进行测序,总结我国WD患者ATP7B基因外显子突变的特点,探讨基因突变位点和肝脏病理的相关性。
1 资料与方法
1.1一般资料收集2012年4月至2016年4月首都医科大学附属北京地坛医院肝病科诊治的WD患者,经患者同意后进行基因检测。共收集45例患者,男29例,女16例,年龄(26.8±10.6)岁(0.2~55岁),另选20名无亲缘关系健康者为对照组,男12名,女8名,年龄(27.7±2.7)岁(24~33岁)。两组性别、年龄相比,差异无统计学意义(P>0.05),具有可比性。
1.2WD诊断标准目前临床上WD的诊断依据以下标准[6-7]:(1)家族遗传史:父母是近亲婚配,同胞有WD患者或死于原因不明的肝病;(2)缓慢进行性震颤、肌僵直、构音障碍等锥体外系症状、体征或/和肝症状;(3)肉眼或裂隙灯证实有K-F角膜色素环;(4)血清铜蓝蛋白(CP)<200 μg/ml,或血清铜氧化酶<0.2活力单位;(5)24 h尿铜排泄量>1 000 μg(1.56 μmol);(6)肝铜>250 μg/g(干质量)。凡完全具备上述1~3项或1和4项者,可确诊为临床表现型;具备上述3~5项者或3~4项者为症状前型;仅有1~2项或1、3项者,怀疑为WD,通过第6项确诊。
1.3超声引导下肝脏穿刺及组织学检查采用日本Aloa-4000型超声仪,5.0 MHz专用穿刺探头,固定18 G×20 cm穿刺针入自动活检枪,无菌操作,体表定位后,用质量浓度为20 g/L的利多卡因麻醉,在穿刺探头的引导下,上活检栓,完成切割组织的动作后,迅速拔针,穿刺点进行消毒包扎。标本经质量浓度为40 g/L的中性甲醛固定,梯度酒精脱水,二甲苯透明,石蜡包埋后连续切片,进行HE染色、网织纤维染色和罗丹宁铜染色,封片后,由2名病理医师阅片。
1.4基因组DNA的提取及引物设计采用全血基因组DNA提取试剂盒(DP348,天根生化科技有限公司)提取全血基因组DNA。实验方法如下:抽取WD组和健康对照组外周静脉血各1 ml并抗凝,1~2.5倍血液样品体积的细胞裂解液裂解,细胞核沉淀加入缓冲液和20 μl蛋白酶K(100 μg/ml)置56 ℃水浴锅孵育10 min,混合液加入离心柱内,离心,漂洗,加入50 μl的洗脱缓冲液,室温静置2 min,离心,收集DNA,保存在-20 ℃备用。使用Primer Premier 6软件设计引物,Invitrogen公司合成所需要的引物。引物序列及反应条件见表1。
1.5PCR反应及测序反应体系为25 μl,BIO-RAD PCR仪进行扩增。PCR扩增条件为:94 ℃变性5 min,94 ℃热变性15 s,从61 ℃开始复性,每进行一个热循环,复性温度降低0.5 ℃,持续至55 ℃,复性时间为45 s,72 ℃延伸1 min,共进行30个循环。PCR产物5 μl加入质量浓度为10 g/L的琼脂糖凝胶中,100 V电泳30 min,凝胶成像仪观察PCR产物的扩增片段。PCR产物纯化后,由天津金唯智公司进行双向测序。

表1 ATP7B基因的引物序列及扩增条件Tab 1 Primers and amplication conditions of ATP7B gene
2 结果
2.1WD患者组织学表现以肝病为首发症状的WD患者具有程度不等的肝脏损伤,22例(48.9%)有脂肪变性,45例患者均有不同程度的肝纤维化,严重肝纤维化14例(31.1%),其中,诊断为活动性肝硬化4例(8.9%),铜染色阳性患者39例(86.7%)。组织学改变相对特异,光镜下可见肝细胞弥漫肿胀,部分肝细胞显著气球样变,胞浆内可见Mallory小体形成(见图1A);肝脏汇管区周围肝细胞观察到数量较多的糖原性空泡核(见图1B);部分病例可进展到肝硬化期,汇管区明显扩大,纤维组织增生形成假小叶(见图1C),网织纤维染色可见纤维间隔形成(见图1D)。当肝细胞内有过量的铜沉积时,HE染色可见细胞内有棕褐色脂褐素样颗粒(见图1E),罗丹宁染色,可见肝细胞胞浆内橘红色铜颗粒沉积(见图1F)。
2.2WD患者ATP7B基因突变位点检测对45例WD患者ATP7B基因外显子突变位点情况进行分析,结果显示,第12和16号外显子为高频率的突变位点,最常见的突变类型为碱基替换。16号外显子c.3419C>T(即Val1140Ala)突变频率达30.2%,ATP7B基因在12号外显子c.2855A>G位点(即Lys952Arg)的突变频率也高达30.2%(见表2)。
2.3ATP7B基因新发现的突变位点本研究共检测到4种新发的突变位点,分别是位于8号外显子CTC-TTC(即Leu732Phe),突变频率为1.7%(见图2A);位于11号外显子GCG-CCG(即Ala874Pro),突变频率为0.6%(见图2B);位于13号外显子CTG-CCG(即Leu989Pro),突变频率为0.8%(见图2C);位于13号外显子CAG-TAG(即Gln1004Thr),突变频率为1.7%(见图2D)。

图1 WD患者组织学表现 A:肝细胞肿胀,气球样变性(HE 400×);B:肝细胞空泡样变(HE 400×);C:肝纤维组织增生,假小叶形成(HE 100×);D:纤维间隔形成(网织纤维染色100×);E:肝细胞胞浆内棕褐色脂褐素样颗粒(HE 400×);F:肝细胞内铜颗粒沉积(罗丹宁铜染色 400×)Fig 1 Histological appearance of WD patients A: liver cell swelling and ballooning degeneration (HE 400×); B: hepatocyte vacuolation (HE 400×); C: fibrous tissue hyperplasia of the live, false lobule formation (HE 100×);D: fibrous septum formation (Gordon-Sweets 100×); E: deposition of lipofuscin in hepatocyte (HE 400×); F: copper deposition in hepatocyte (Rhodamine 400×)

表2 45例WD患者ATP7B基因突变位点Tab 2 ATP7B gene mutations in 45 Chinese WD patients
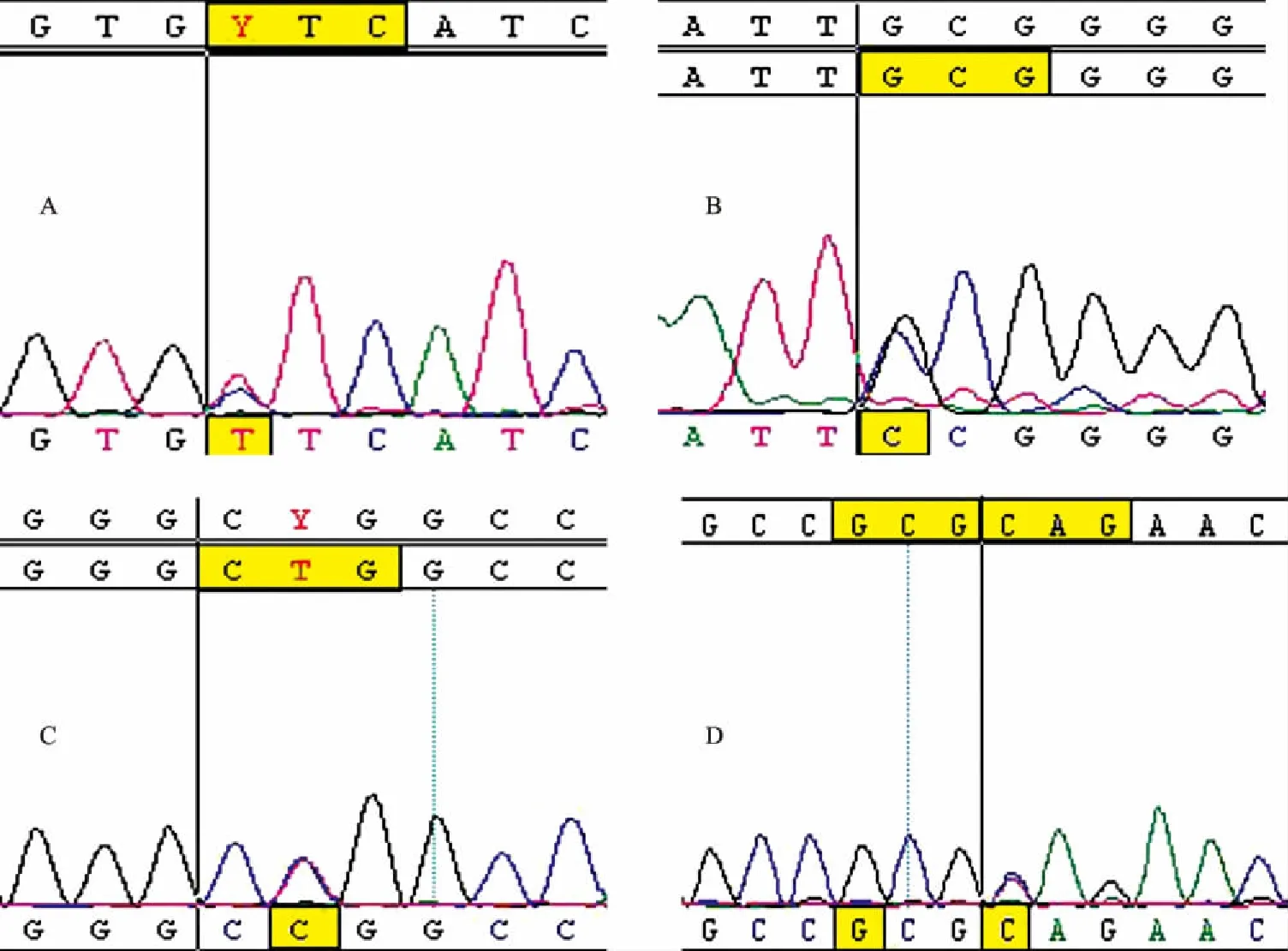
图2 ATP7B基因突变患者的DNA测序图 A:外显子8突变位点Leu732Phe;B:外显子11突变位点Ala874Pro;C:外显子13突变位点Leu989Pro;D:外显子13突变位点Gln1004Thr
3 讨论
WD是由于ATP7B基因发生突变导致P型铜转运ATP酶发生障碍的遗传性疾病。WD在中国人群中发病率更高,占单基因病的第2位。机体内蓄积的铜可以沉积在肝脏、脑、眼角膜、肾脏、关节、心脏等器官,导致相应的损伤。肝脏是铜代谢的主要器官,容易发生损伤,患者可以出现肝功能异常,甚至肝功能衰竭[8-9]。目前人类基因组数据库中已经统计的ATP7B基因突变有500多种,但以少数几种突变类型为主,且不同种族和地区基因突变类型不同,其中关于中国人群存在的突变有120多种。突变类型主要以错义突变为主,缺失、插入和剪接突变较少见。对临床疑似WD的患者进行ATP7B基因突变位点检测,可以尽早明确诊断,进行干预治疗,降低组织器官损伤的风险,对产前诊断和新生儿筛查具有重要意义[10]。
目前关于ATP7B基因突变的研究表明,不同地域人群中ATP7B基因的突变类型和突变频率并不相同[11]。THOMAS等[12]首次报道了在欧洲人中WD患者His1069Gln(位于14号外显子)和Gly1266Lys(位于18号外显子)突变率较高,分别占总患者的28%和10%。研究[13]表明,欧洲人14和18号外显子为突变热区,同时还存在其他外显子的众多突变类型。在亚洲一项对印度患者的研究中发现,常见的突变有Cys271Stop(位于2号外显子)和Arg778Leu(位于外显子8),突变频率较高,这一点和欧洲等其他人群不同。针对台湾的一项研究[14]也显示,22例WD患者中有27%的患者出现了778密码子突变,主要为Arg778Leu和Arg778Gln,此后陆续报道的突变分布在外显子5、7、8、12、14、18。因为WD患者基因突变类型和临床表现复杂多样,导致突变类型和临床表现的相关性还未得到证实,且这一疾病和患者的种族及地域都有相关性,导致基因突变和临床表型的相关性并没有统一的认识。但根据临床症状来研究患者的基因突变类型对于发现WD的发病规律、疾病进展及临床治疗有重要的参考意义。
本研究中的45例WD患者ATP7B基因测序结果显示,共发现21个多态性位点,其中有17个突变位点为已知突变位点,另外4个为首次发现的突变位点。其中位于12号外显子的2855A>G和位于16号外显子的3419C>T突变频率最高,均达到30.2%。目前国内学者普遍认为,8号外显子的2333G>T突变频率最高,该突变被多次报道,这个位点突变后能够改变ATP7B的基因结构,导致蛋白转运功能失效,铜离子蓄积。我们的研究结果显示,2333G>T突变频率为10.9%,是本研究中第三突变热点,和以往的研究有所不同。位于12号外显子2804C>T发生的错义突变一直认为是我国WD患者的第二突变热点,该位点突变后可导致ATP7B基因第五跨膜区蛋白的构象发生改变,导致铜代谢障碍。本研究中2804C>T突变频率没有2855A>G高,表明该突变位点可以作为另一个值得关注的位点。本研究还发现,16号外显子3419C>T突变频率也很高,与国内部分报道结果不符,这提示我们,中国WD患者基因突变除了主要发生在第8和第12外显子上,16号外显子的突变也要引起重视,极有可能也是中国WD患者的高频突变位点之一。本研究发现的ATP7B基因突变位点与以往研究不同,可能是因为本研究是以肝病为首发症状的WD患者为研究对象,且不同地域、不同种族WD患者基因突变类型和临床表现具有较大差异,另外不同个体差异及环境因素也会造成患者不同的基因突变类型和临床表型。
我国以肝病为首发表现的WD患者除了外显子8和12这两个突变位点以外,16号外显子也是一个重要的突变位点,另外,本研究还发现4个新的错义突变,分别位于第8、11和13号外显子上,由于这4个新的错义突变发生的频率较低(0.8%~1.7%),有关突变与临床表型、地域等方面的相关性还需进一步加大样品量进行分析。我国以肝病为首发症状的WD患者ATP7B基因突变是以少数几个热点突变和广泛存在的罕见突变为特征,不同地区、不同临床症状的患者突变热点并不一致。因此,对临床上疑似WD患者尽早行ATP7B基因突变位点检测,可以在早期对患者进行及时的干预和治疗,改善患者的生活状态和预后。
[1] 陈志惠, 陈东风. 肝性脊髓病研究进展[J]. 胃肠病学和肝病学杂志, 2016, 25(7): 832-834. DOI: 10.3969/j.issn.1006-5709.2016.07.028.
CHEN Z H, CHEN D F. Progress of hepatic myelopathy [J]. Chin J Gastroenterol Hepatol, 2016, 25(7): 832-834. DOI: 10.3969/j.issn.1006-5709.2016.07.028.
[2] LU C X, QING L, HUANG W Q, et al. New mutations and polymorphisms of the ATP7B gene in sporadic Wilson disease [J]. Eur J Med Genet, 2014, 57(9): 498-502. DOI: 10/1016/j.ejmg.014.04.016.
[3] POLISHCHUK E V, CONCILLI M, IACOBACCI S, et al. Wilson disease protein ATP7B utilizes lysosomal exocytosis to maintain copper homeostasis [J]. Dev Cell, 2014, 29(6): 686-700. DOI: 10/1016/j.devcel.2014.04.033.
[4] VRABELOVA S, LETOCHA O, BORSKY M, et al. Mutation analysis of the ATP7B gene and genotype/phenotype correlation in 227 patients with Wilson disease [J]. Mol Genet Metab, 2005, 86(1-2): 277-285. DOI: 10/1016/j.ymgme.2005.05.004.
[5] DIAO S P, HONG M F, HUANG Y Q, et al. Identification and characterization of a novel splice-site mutation in the Wilson disease gene [J]. J Neurol Sci, 2014, 345(1-2): 154-158. DOI: 10/1016/j.jns.2014.07.031.
[6] ROBERTS E A, SCHILSKY M L. Diagnosis and treatment of Wilson disease: an update [J]. Hepatology, 2008, 47(6): 2089-2111. DOI: 10.1002/hep.22261.
[7] 延永琴, 郑智勇, 曾德华, 等. 肝脏Wilson病的临床病理特征[J]. 世界华人消化杂志, 2016, 24(5): 782-789. DOI: 10.11569/wcjd.v24.i5.782.
YAN Y Q, ZHENG Z Y, ZENG D H, et al. Clinicopathologic features of Wilson disease of the liver [J]. World Chinese Journal of Digestology, 2016, 24(5): 782-789. DOI: 10.11569/wcjd.v24.i5.782.
[8] 杨波, 吴元凯, 曹红, 等. 血浆铜蓝蛋白在乙型肝炎不同肝功能状态的水平及意义[J]. 胃肠病学和肝病学杂志, 2012, 21(9): 841-843. DOI: 10.3969/j.issn.1006-5709.2012.09.017.
YANG B, WU Y K, CAO H, et al. The levels and significance of ceruloplasmin in hepatitis B with different liver function status [J]. Chin J Gastroenterol Hepatol, 2012, 21(9): 841-843. DOI: 10.3969/j.issn.1006-5709.2012.09.017.
[10] POON K S, TAN K M, KOAY E S. Targeted next-generation sequencing of the ATP7B gene for molecular diagnosis of Wilson disease [J]. Clin Biochem, 2016, 49(1-2): 166-171. DOI: 10.106/j.clinbiochem.2015.10.003.
[11] 张丽静, 余保平, 蒲鹏. 17例肝豆状核变性病例分析[J]. 胃肠病学和肝病学杂志, 2011, 20(2): 156-157. DOI: 10.3969/j.issn.1006-5709.2011.02.018.
ZHANG L J, YU B P, PU P. Clinical analysis of 17 cases of hepatolenticular degeneration [J]. Chin J Gastroenterol Hepatol, 2011, 20(2): 156-157. DOI: 10.3969/j.issn.1006-5709.2011.02.018.
[12] THOMAS G R, FORBES J R, ROBETS E A, et al. The Wilson disease gene: spectrum of mutation and their consequences [J]. Nat Gene, 1995, 9(2): 210-217. DOI: 10.1038/ng0295-210.
[13] POUJOIS A, WOIMANT F, SAMSON S, et al. Characteristics and prevalence of Wilson’s disease: A 2013 observational population-based study in France [J]. Clin Res Hepatol Gastroenterol, 2018, 42(1): 457-463. DOI: 10.1016/j.clinre.2017.05.011.
[14] CHUANG L M, WU H P, JANG M H, et al. High frequency of two mutationsin codon 778 in exon8 of the ATP7B gene in Taiwanese families with Wilson disease [J]. J Med Genet, 1996, 33(6): 521-523.

