食管下段及食管胃连接处黏膜下肿物内镜经黏膜下隧道肿瘤切除术的疗效分析
曾 西, 陈明锴, 吴楠楠, 王 芳
武汉大学人民医院消化内科,湖北 武汉 430060
食管下段及食管胃连接处(esophagogastric junction,EGJ)是胃肠道间质瘤、平滑肌瘤、脂肪瘤、神经鞘瘤等黏膜下肿物形成的常见部位[1]。临床上根据超声内镜(endoscopic ultrasonography,EUS)下肿瘤的部位、肿瘤的大小、生长方式、来源部位、局部浸润深度采用不同的手术方式。黏膜下肿物的手术方式有腹腔镜下楔形切除术(laparoscopic wedge resection, LWR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。目前临床上开展的ESD有:内镜下结扎切除术(endoscopic ligation,ELR)、内镜黏膜下挖除术(endoscopic submucosal excavation,ESE)、内镜下全层切除技术(endoscopic full-thickness resection,EFR)、内镜经黏膜下隧道肿瘤切除术(submucosal tunnelling endoscopic resection,STER)及腹腔镜内镜联合术(laparoscopic endoscopic combined surgery,LECS)[2]。由于食管下段括约肌的特殊结构,EGJ管腔狭窄并有急剧的转角,既往多选择采用开腹或腹腔镜手术,由于食管下段及EGJ部位的开放性,手术切除往往会造成胃食管反流、消化道畸形、胃排空障碍等并发症。自2000年以来,随着内镜技术发展,ESD也开始用于食管下段及EGJ部。XU等[3]首先开展了STER切除食管下段黏膜下肿物,随着STER的推广,已运用于食管下段及EGJ黏膜下肿物。STER可一次性完整剥离绝大多数黏膜下肿瘤,同时保持消化道黏膜的完整性,即使出现穿孔,也可以非常快速地闭合隧道口。
近年来,关于STER的病例报道及相关疗效探讨越来越多[4-6],但STER与传统ESD的临床对照研究仍较少,现对本中心采用两种术式切除食管下段及EGJ部黏膜下肿物的病例的疗效及安全性进行比较研究,为临床术式选择提供参考依据。
1 资料与方法
1.1一般资料2015年7月至2016年12月,武汉大学人民医院内镜中心共对23例发现食管下段及EGJ部黏膜下肿物患者进行了STER治疗,所有病例经EUS明确病变来源于黏膜下层,其中6例起源于黏膜肌层,1例起源于黏膜下层,16例起源于固有肌层,各病例均为低回声或无回声病灶,边界清晰。男18例,女5例,中位年龄49岁(25~75岁)。肿瘤位于食管下段14例,EGJ部9例。肿瘤直径0.7~4 cm。6例无任何症状,体检偶然发现黏膜下肿物,17例因胸腹部不适(胸骨后疼痛、腹胀痛等)发现。选取同时段23例行ESE的病例作为对照组。对照组病例经EUS明确病变来源于黏膜下层,其中16例起源于黏膜肌层,2例起源于黏膜下层,5例起源于固有肌层,各病例均为低、无或混合回声病灶,边界清晰。男17例,女6例,中位年龄48岁(35~70岁)。肿瘤位于食管下段15例,EGJ部8例。肿瘤直径0.4~3 cm。13例经体检偶然发现黏膜下肿物,10例因胸腹部不适(胸骨后疼痛、腹胀痛等)发现。所有患者入院后常规行胸部CT、心电图检查及血常规、凝血功能检查,排除有食管外组织压迫改变或有凝血障碍性疾病者,术前2周禁用抗炎药和抗凝血药物。所有病例于术前均进行麻醉评估及签署手术知情同意书。手术由共完成ESD及经口内镜下肌切开术(peroral endoscopic myotomy, POEM)300例以上,且操作经验5年以上的内镜医师完成。所有患者随访时间至少6个月,术后1、3、6个月复查胃镜。
1.2STER及ESE方法
1.2.1 手术器械和设备:Olympus公司GIF-Q260Z胃镜,GIF-2T240双钳道胃镜,Fujinon超声内镜系统SU-8000,0lympus D-201-11804透明帽,FD-411高频治疗钳,ICC-200高频电切装置,KD-620LR Hook刀,NM-400L-1注射针,ENDO-FLEX圈套器,HX-600-135止血夹,APC300氩离子凝固器,CO2气泵。
1.2.2 手术过程:患者均于气管插管、全身麻醉下行STER。清除口鼻分泌物保持呼吸道通畅,手术全程使用CO2气泵。定位黏膜下肿物具体位置,内镜前端装透明帽,选距肿瘤近端3~5 cm处黏膜下注射,一次性高频切开刀纵向切开黏膜,稍加分离,内镜进入黏膜下继续剥离,建立黏膜下隧道,用一次性高频切开刀完整剥离病灶后(或用一次性圈套器完整圈套病灶并将其切除),用一次性高频治疗钳及氩气隧道内充分止血,确认没有活动性出血,退出隧道后沿食管腔进镜至贲门口观察,病灶取出送检,予以钛夹封闭隧道入口,术后创面喷洒生物止血流体膜预防出血,退镜,必要时予以胃管减压引流。ESE手术过程参考时强等[7]所述。术后2 d禁食,避免剧烈运动,常规使用抗生素预防感染、止血、抑酸及营养支持治疗。术后第3天开始进流质饮食,逐渐过渡至正常饮食。术后常规给予质子泵抑制剂(PPI)抑酸及黏膜保护剂4~6周。

2 结果
2.1STER组与ESE组临床特征及手术特点比较两组患者的性别、年龄、黏膜下肿物位置、就诊原因方面差异无统计学意义(P>0.05)。STER组肿物面积、肿物直径较ESE组更大,ESE组术后住院时间较STER组更长,差异均有统计学意义(P<0.05)。STER术在处理食管下段及EGJ部较大肿物方面更有优势。两组患者总手术费用、钛夹使用数量、手术时间差异无统计学意义(P>0.05)。STER组肿物单位面积手术费用较ESE组低,差异有统计学意义(P<0.05)(见表1)。
2.2STER组与ESE组病理活检及并发症情况两组患者黏膜下肿物均完全切除,完全切除率均为100%,无患者追加外科手术治疗。STER组中仅有1例因病灶体积过大(占据1/2管腔)分块切除(见图1),其余病例均完整切除病灶,术后病理活检提示STER组中13例为平滑肌瘤,5例为慢性炎症,5例病理资料缺失;ESE组中11例为平滑肌瘤,7例为慢性炎症,1例为海绵状血管瘤,4例病理资料缺失。STER组患者中有1例患者出现纵膈积气及术后发热,经保守治疗后恢复正常,ESE组中有1例患者出现术后发热,保守治疗后好转。两组患者均无术后迟发型出血、穿孔、局部病灶复发。
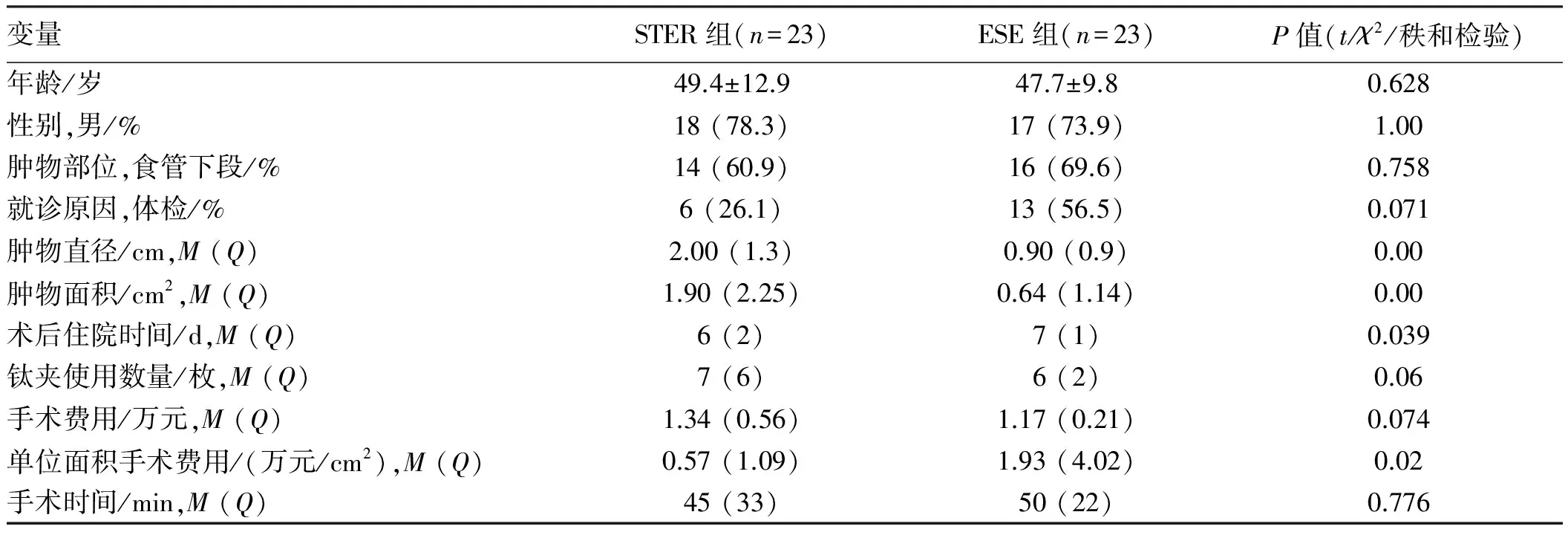
表1 STER组与ESE组临床特征及手术特点比较Tab 1 Comparison of clinical features and surgical characteristics between the STER group and ESE group

图1 食管黏膜下肿瘤STER过程及随访 A:食管距门齿25~29 cm处见一大小约2 cm ×4 cm黏膜下肿瘤,EUS 提示肿瘤起源于固有肌层;B:于肿瘤口侧端上方5 cm处纵形切开食管黏膜层,建立黏膜下隧道,暴露瘤体,并逐步剥离肿瘤;C:肿瘤取出后,观察隧道内有无出血、穿孔;D:多枚金属钛夹封闭纵形隧道入口;E:切除后的瘤体;F:术后1个月胃镜随访见隧道入口处部分钛夹未脱落,黏膜稍肿胀,未见出血
3 讨论
虽然临床上认为多数黏膜下肿物是良性的,但某些黏膜下肿物仍有恶变潜能,且目前的检查手段(如普通胃镜、EUS、CT等)无法精准判别其良恶性[8]。随访复查可能会延误病情,错失最佳治疗时间,并且增加患者经济负担,相对频繁的内镜检查也增加患者的精神压力并影响患者的生活质量。由于EGJ管腔狭窄并有急剧的转角,是内镜手术的“禁区”,对于EGJ部位的病变,既往几乎均选择采用开腹或腹腔镜手术。随着内镜技术的发展,早期病变的发现率增加,ESE等方法被应用于治疗食管下段及EGJ部黏膜下肿物,但上述治疗破坏了食管黏膜层的完整性,有可能发生穿孔,瘤体较大致创面较大穿孔时,可能因金属夹封闭失败追加外科手术治疗。近几年来,国内学者XU等[3]在经口内镜隧道下肌切开术的启发下,开创了STER治疗黏膜下肿物的舞台。该方法可一次性完整剥离绝大多数来源于固有肌层的黏膜下肿瘤,同时保持消化道黏膜的完整性,即使出现穿孔,也可以非常快速闭合隧道口。相对于传统ESD,该手术方式不但可避免术后再次出现消化道瘘和胸腹腔感染,而且手术创面小,恢复较快,住院时间缩短,减少了医疗费用,充分体现了微创的优越性。
本研究中尽管两组患者术中钛夹使用数量、手术费用、手术时间等方面差异无统计学意义,但手术者对于黏膜下肿物体积较大者倾向于采用STER术,STER组肿物最大直径、肿物面积均较ESE组大,说明STER在处理食管下段及EGJ部较大肿物方面更具优势。且STER组术后住院时间较ESE组短,STER组病灶单位面积手术费用较ESE组更低。
两组患者黏膜下肿物均完全切除,完全切除率均为100%,无1例追加外科手术治疗。STER组中仅有1例因病灶体积过大(占据1/2管腔)分块切除,其余两组病例均完整切除病灶,术后病检提示平滑肌瘤、慢性炎症等。STER组1例病灶过大者术后出现纵膈积气伴发热,经内科保守治疗后积气消失。ESE组中有1例患者出现术后发热,保守治疗后好转。两组患者术后随访未见出血、穿孔等并发症,术后1个月复查胃镜创面愈合中,6个月复查胃镜未见肿物复发。
STER将消化管由单层变成了双层,利用固有肌层隔离人体的消化管腔与其他腔隙,避免气体和消化液进入其他腔隙,保证了组织结构的完整性,同时能够防止消化道瘘和胸腹腔感染,且手术创伤较小。因为STER手术特点遵循腔隙完整、无菌、无化学刺激、自然腔道条件、良好的预防和止血、预防封闭腔隙间相互贯通、病变完整切除和防止转移等原则,又具有手术时间短、创面小、并发症少、恢复快及住院时间短的优点,值得临床大力推广。
本文章仍有许多不足之处,病理资料部分缺失无法进行进一步统计学分析。两组患者病灶大小未匹配,样本量较小,随访时间较短。
[1] MIETTINEN M, SOBIN L H, LASOTA J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1 765 cases with long-term follow-up [J]. Am J Surg Pathol, 2005, 29 (1): 52-68.
[2] 朱建伟, 王雷, 郭杰芳, 等. 超声内镜在胃肠道间质瘤诊断中的应用价值[J]. 中华消化内镜杂志, 2014, 31(6): 342-344. DOI: 10.3760/cma.j.issn.1007-5232.2014.06.014.
[3] XU M D, CAI M Y, ZHOU P H, et al. Submucosal tunneling endoscopic resection: a new technique for treating upper GI submucosal tumors originating from the muscularis propria layer (with videos) [J]. Gastrointest Endosc, 2012, 75(1): 195-199. DOI: 10.1016/j.gie.2011.08.018
[4] YE L P, ZHANG Y, MAO X L, et al. Submucosal tunneling endoscopic resection for small upper gastrointestinal subepithelial tumors originating from the muscularis propria layer [J]. Surg Endosc, 2014, 28(2): 524-530. DOI: 10.1007/s00464-013-3197-8.
[5] CHEN T, ZHANG C, YAO L Q, et al. Management of the complications of submucosal tunneling endoscopic resection for upper gastrointestinal submucosal tumors [J]. Endoscopy, 2016, 48(2): 149-155. DOI:10.1055/s-0034-1393244.
[6] CHEN H, XU Z, HUO J, et al. Submucosal tunneling endoscopic resection for simultaneous esophageal and cardia submucosal tumors originating from the muscularis propria layer (with video) [J]. Dig Endosc, 2015, 27(1): 155-158. DOI: 10.1111/den.12227.
[7] 时强, 钟芸诗, 姚礼庆. 以内镜黏膜下剥离术为基础的消化内镜外科微创治疗的进展[J]. 中华普通外科杂志, 2011, 26(11): 966-968. DOI: 10.3760/cma.j.issn.1007-631x.2011.11.030.
[8] LV X H, WANG C H, XIE Y. Efficacy and safety of submucosal tunneling endoscopic resection for upper gastrointestinal submucosal tumors: a systematic review and meta-analysis [J]. Surg Endosc, 2017, 31(1): 49-63. DOI: 10.1007/s00464-016-4978-7.

