联动模式成像内镜对检出结直肠息肉的诊断价值
丁慧慧,于红刚,季梦遥
武汉大学人民医院消化内科,湖北 武汉 430060
结肠息肉是常见的结肠疾病之一, 分为肿瘤性和非肿瘤性息肉。肿瘤性息肉主要为腺瘤样息肉,非肿瘤性息肉包括炎性息肉、增生性息肉和幼年性息肉等。有报道[1-4]证实,50%~70%的结直肠癌(colorectal cancer,CRC)来源于腺瘤,腺瘤性息肉的癌变率为2.9%~9.4%,而结肠炎性息肉和增生性息肉也有癌变的可能。同时,结肠息肉的大小也与癌变有一定的相关性,即结肠息肉的直径越大,其癌变的可能性越大,一般认为直径>20 mm的结肠息肉的癌变率达10%[5]。结肠镜是检出结肠息肉及CRC的重要途径[6]。已有研究[7-8]表明,内镜下切除结直肠息肉,尤其是腺瘤样息肉可显著降低CRC死亡的风险,因此,内镜下发现并切除结直肠息肉对降低CRC的发生至关重要。然而,在结肠镜检查期间常遗漏了许多息肉。有研究[9-10 ]显示,结肠镜检查息肉漏检率为20%~26%。因此,在结肠镜检查期间提高息肉的检出率非常关键[10-11 ]。但是在传统内镜下检查常错过某些息肉,而这些病变可能是构成结肠癌的主要原因。息肉检测取决于许多因素,其中最重要的因素之一是息肉可见度。由于结肠肠腔较宽,普通内窥镜不能提供足够的亮度,很大程度上影响了结肠病变的有效检出率。在白光内镜(white light endoscopy, WLE)检查期间,有些息肉尤其是扁平的小息肉经常被漏诊,我们通过不断优化的可视化内窥镜检查方法提高息肉的检出率。最近几年,随着图像增强内窥镜(image-enhanced endoscopic,IEE)的不断演变,显著改善了图像亮度和质量,提供更好的可见性。蓝激光镜联动成像模式(linked color imaging,LCI)是一种新开发的IEE模式内置于激光内窥镜系统,通过同时使用窄带短波长光和白光在适当的平衡中获取图像,旨在增强黏膜红色区域的轻微色差,其将所获取的颜色信息重新分配,以区分与黏膜颜色相似的颜色,从而改善描绘血管的性能,可以清晰地显示红色血管和白色凹陷[12-13]。LCI及白光模式是蓝激光内镜的两种不同观察模式,两者之间可进行自由切换,LCI图像是白光图像的颜色增强模式,该模态提供增强图像亮度和色调,更生动地绘制红色和白色。LCI可以通过提高结肠黏膜血管的可见性提高结直肠息肉的检出率。目前有关LCI对检测结直肠息肉的敏感性研究相对较少。本研究中,我们进行了一项随机对照试验,以比较使用LCI和WLE检查结直肠息肉,评估LCI相比WLE改善结直肠息肉检测的能力,并从可视性的角度对比LCI的有效性。
1 资料与方法
1.1一般资料收集2017年4月至2017年5月于武汉大学人民医院使用富士公司LASEREO系统(FUJIFILM,Tokyo,Japan)中EC-L590WM内窥镜进行结肠镜检查的192例患者,男90例,女102例,年龄(53.2±11.9)岁(19~84岁)。所纳入患者排除有结肠切除术病史、炎症性肠病、家族性腺瘤息肉病、P-J综合征或其他息肉综合征,保证所纳入患者可进镜至回盲部,且肠道清洁度均为Ⅱ级以上[14-15],在检查前确保患者充分了解该研究的基础上签署结肠镜检查同意书,患者相关诊治和监护措施均以临床指南相关原则为依据,对患者的治疗和安全有充分保障。并提前1 d电话通知患者开始肠道清洁工作,确保肠道清洁度。该试验符合武汉大学人民医院伦理学。
1.2内镜设备本研究采用富士公司LASEREO系统(FUJIFILM,Tokyo,Japan)EC-L590WM广角肠道内窥镜进行。该系统具有不同波长的2个激光器。一个是白光激光器,波长(450±10)nm,其提供适合于一般观察的宽谱白光照明。另一种是具有短波长和窄带的蓝色激光图像(BLI)模式激光,波长(410±10)nm。本研究中使用的LCI技术是新型基于BLI-bright图像增强模式,具有增强红色分色的附加图像处理,允许更加生动地显示红色和白色的颜色。
1.3受试者分组使用计算机设计了一个随机对照试验,将在武汉大学人民医院消化内镜中心进行结肠镜检查的192例受试对象分为两组,其中A组为LCI组,B组为WLE组。
1.4内窥镜检查由同一个内镜医师进行LCI和WLE检查,要求该内窥镜操作医师需尽快插管至受试者回盲部,退镜时全程分别用WLE和LCI模式退镜,仔细观察结肠黏膜寻找息肉,记录息肉形态、位置及大小。另在LCI组,当发现部分息肉时转换至白光模式,记录下在相同位置息肉的白光图像以便对比观察。本试验中该内镜操作医师在参与研究之前,已有3年结肠镜操作经验,并有200次以上的在LCI模式下进行结肠镜操作的经验。操作时需尽快插管至受试者回盲部后退镜观察,退镜观察时间需在7 min以上。
1.5观察指标研究的主要结局指标是LCI和WLE在结肠镜检查期间结直肠息肉检出率、息肉类型、大小等。
1.6统计学分析采用SPSS 16.0统计软件处理数据,采用Pearsonχ2检验比较LCI与WLE下整体息肉、扁平息肉及隆起息肉的检出率。同时采用Mann-WhitneyU秩和检验比较LCI与WLE下检出的总息肉个数、扁平息肉个数、隆起息肉个数及不同大小息肉个数的差异,P<0.05为差异有统计学意义。
2 结果
2.1受试者一般情况192例受试者分为两组,LCI组96例,WLE组96例,年龄(53.2±11.9)岁(19~84岁)。如表1所示,两组年龄(P=0.85)、性别(P=0.39)、症状(P=0.47)比较,差异无统计学意义。临床症状主要有腹痛腹胀、便秘腹泻、便血、大便习惯及性状改变,检查时及检查后均无不良事件发生。
2.2患者结直肠息肉检出率本研究76例检出息肉,共170枚。LCI组有47例受试者发现有息肉,其中36例有扁平息肉,25例有隆起息肉;总息肉共123枚(72.4%),其中扁平息肉80枚,隆起息肉43枚;WLE组有29例受试者发现有息肉,其中11例有扁平息肉,20例有隆起息肉;总息肉共47枚(27.6%),扁平息肉15枚,隆起息肉32枚。LCI组整体息肉检出率是49.0%,与WLE组(30.2%)比较,差异有统计学意义(P<0.05),且LCI组患者扁平息肉检出率为37.5%,与WLE组(11.5%)比较,差异有统计学意义(P<0.05);隆起息肉检出率为26.0%,与WLE组(20.8%)比较,差异无统计学意义(P>0.05)(见表2)。

表1 人口统计基线Tab 1 Demographic baselines
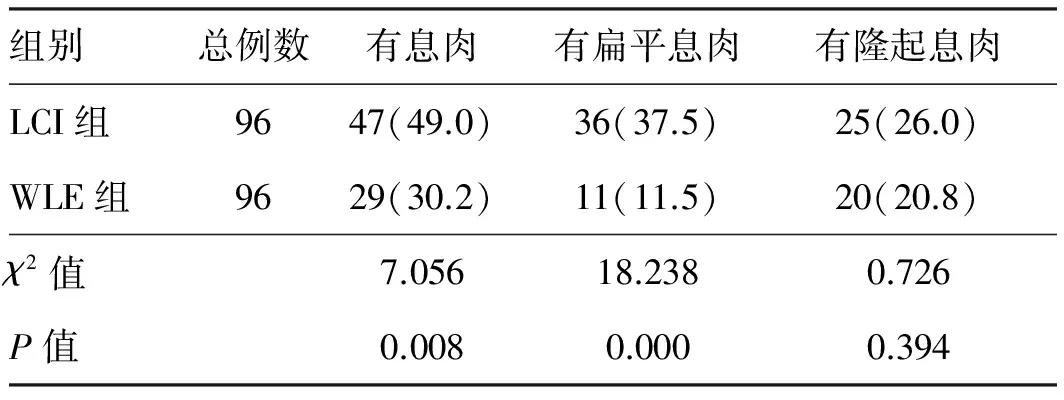
表2 LCI组及WLE组患者息肉检出率Tab 2 The detection rate of polyp in patients under LCI and WLE 比例/%
2.3两组受试者检测出的息肉的形态、大小和位置息肉的形态、大小和位置如表3~4所示,LCI及WLE镜下典型息肉图像如图1所示。息肉形态分为扁平型及隆起型,共检测出95枚扁平息肉,其中LCI组检出80枚(84.2%),与WLE组比较,差异有统计学意义(P<0.05);另LCI组及WLE组分别检出43枚(57.3%)及32枚(42.7%)隆起息肉,两组差异无统计学意义(P=0.973); 此外,LCI组发现的极小息肉(1~3 mm)明显高于WLE组(P<0.05)。
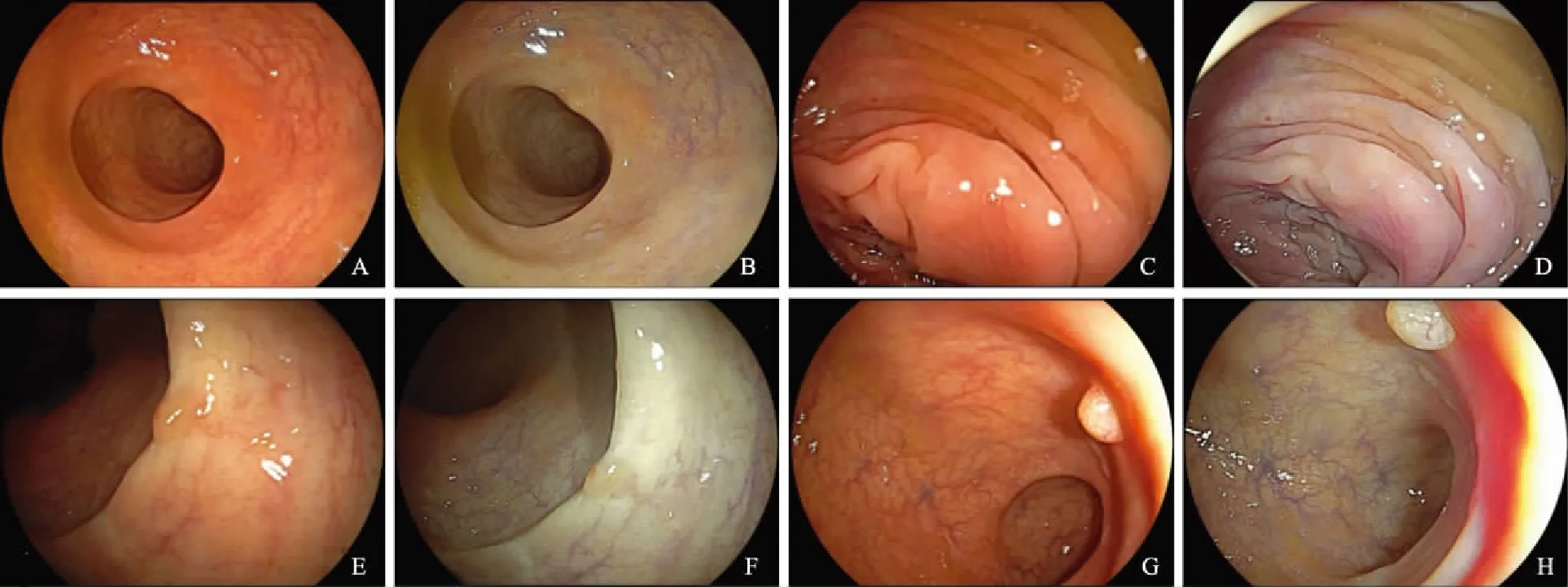
注:A、C、E、G:WLE组;B、D、F、H:LCI组;A、B、C、D:息肉<5 mm;A、B、C、D、E、F:扁平息肉;G、H:隆起息肉。
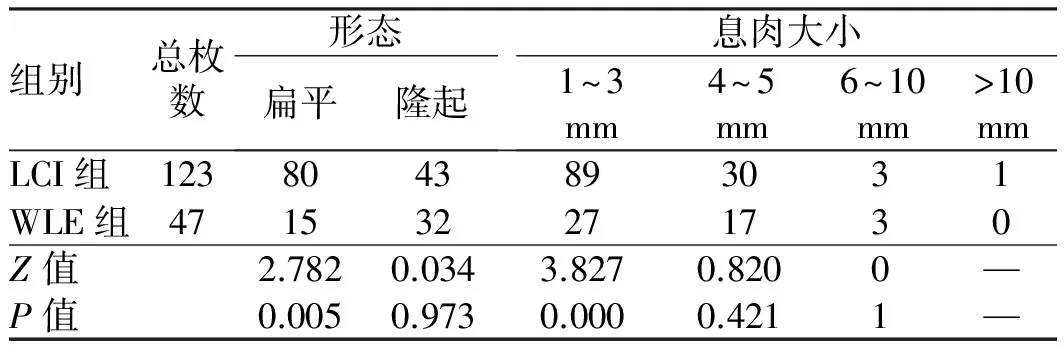
表3 LCI及WLE息肉特点分析Tab 3 Analysis of the characteristics of polyps under LCI and WLE

表4 LCI及WLE检出息肉的位置分布Tab 4 Polyp distribution under LCI and WLE
3 讨论
CRC是由许多原发性息肉经数年的发生、发展逐步产生的,在结肠镜检查下切除息肉可以预防CRC[16]。然而,在结肠镜检查时容易遗漏许多息肉,造成结肠镜检查期间息肉漏诊率较高。扁平及凹陷的息肉在WLE下漏诊率更高。息肉检测取决于许多因素,其中最重要的因素之一是息肉可见度。检测率有望随着内窥镜可视度的优化逐步提高。许多临床研究报道了使用IEE系统的结肠镜如窄带成像(NBI)、灵活的光谱成像(FICE)和自发荧光成像(AFI),结直肠息肉的检出率得以改善。
MIN等[17]研究证实了LCI模式在结直肠息肉检测中具有明显优势。目前国内尚无关于LCI在结直肠息肉中检测优势的报道。本试验的研究结果显示,蓝激光内镜中LCI和WLE在检出结直肠息肉尤其是扁平及小息肉上有明显差异。我们观察到LCI结肠镜检查将总体息肉检出率显著提高了19%,LCI比WLE对息肉的检出更有效。 此外,LCI相较于WLE,更容易发现扁平及小息肉。
本研究的数据来自于单一中心,研究的样本量相对较小,因此,研究结果还需今后多中心大样本研究进一步证实。但从上述研究可以看出,LCI凭借其独特的窄带激光结合白光光源系统,增强黏膜红色区域的轻微色差来区分与黏膜颜色相似的颜色,增强红色分色的附加图像处理可以清晰地显示红色血管和白色凹坑。即使使用非放大内窥镜,也可通过明亮的LCI显著提高结直肠息肉尤其是扁平及小息肉的检出率。
综上所述,LCI可以明显提高结直肠息肉的检出率,值得在临床上推广应用。
[1] MORSON B C. Genesis of colorectal cancer [J]. Clin Gastroenterol, 1976, 5(3): 505-525.
[2] 李伏娥, 叶红军, 李坚, 等. 796例大肠息肉的临床、内镜及病理观察[J]. 中南大学学报(医学版), 2005, 30(4): 463-466. DOI: 10.3321/j.issn:1672-7347.2005.04.024.
LI F E, YE H J, LI J, et al. Clinical, enteroscopic, and pathological characteristics of 796 cases of colorectal polyps [J]. J Cent South Univ (Med Sci), 2005, 30(4): 463-466. DOI:10.3321/j.issn:1672-7347.2005.04.024.
[3] JASS J R. Hyperplastic polyps and colorectal cancer: is there a link [J]. Clin Gastroenterol Hepatol, 2004, 2(1): 1-8.
[4] 杜爱民, 毛勇, 石延敏, 等. 结肠息肉的临床特征分析[J].胃肠病学和肝病学杂志, 2010, 19(1): 53-55. DOI: 10.3969/j.issn.1006-5709.2010.01.015.
DU A M, MAO Y, SHI Y M, et al. Analysis of clinical characteristics of colonic polyps [J]. Chin J Gastroenterol Hepatol, 2010, 19(1): 53-55. DOI: 10.3969/j.issn.1006-5709.2010.01.015.
[5] 武和平, 李萍, 郑昱. 1032例大肠息肉治疗探讨[J].中华消化杂志, 2005, 25(6): 374. DOI: 10.3760/j.issn:0254-1432.2005.06.019.
[6] 陈平, 袁晓琴, 谢玲, 等. 上海市嘉定地区1265例结肠直肠息肉内镜下诊治临床资料回顾性分析[J]. 胃肠病学和肝病学杂志, 2016, 25(5): 524-528. DOI: 10.3969/j.issn.1006-5709.2016.05.011.
CHEN P, YUAN X Q, XIE L, et al. A clinical retrospective study of colonoscopy in diagnosis and treatment of colorectal polyps in Jiading district of Shanghai [J].Chin J Gastroenterol Hepatol, 2016, 25(5): 524-528. DOI: 10.3969/j.issn.1006-5709.2016.05.011.
[7] WINAWER S J, ZAUBER A G, HO M N, et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup [J]. N Engl J Med, 1993, 329(27): 1977-1981. DOI:10.1056/NEJM199312303292701.
[8] ZAUBER A G, WINAWER S J, O’BRIEN M J, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths [J]. N Engl J Med, 2012, 366(8): 687-696. DOI: 10.1056/NEJMoa1100370.
[9] MUNROE C A, LEE P, COPLAND A, et al. A tandem colonoscopy study of adenoma miss rates during endoscopic training: a venture into uncharted territory [J]. Gastrointest Endosc, 2012, 75(3): 561-567. DOI: 10.1016/j.gie.2011.11.037.
[10] VAN RIJN J C, REITSMA J B, STOKER J, et al. Polyp miss rate determined by tandem colonoscopy: a systematic review [J]. Am J Gastroenterol, 2006, 101(2): 343-350. DOI:10.1111/j.1572-0241.2006.00390.x.
[11] HERESBACH D, BARRIOZ T, LAPALUS M G, et al. Miss rate for colorectal neoplastic polyps: a prospective multicenter study of back-to-back video colonoscopies [J]. Endoscopy, 2008, 40(4): 284-290. DOI: 10.1055/s-2007-995618.
[12] OSAWA H, YAMAMOTO H. Present and future status of flexible spectral imaging color enhancement and blue laser imaging technology [J]. Dig Endosc, 2014, 26 (Suppl 1): 105-115. DOI: 10.1111/den.12205.
[13] OKADA M, SAKAMOTO H, TAKEZAWA T, et al. Laterally spreading tumor of the rectum delineated with linked color imaging technology [J]. Clin Endosc, 2016, 49 (2): 207-208. DOI: 10.5946/ce.2015.077.
[14] 陈仕武, 朱娟. 1233例大肠息肉的临床与内镜分析[J].临床荟萃, 2007, 22(10): 728-729. DOI: 10.3969/j.issn.1004-583X.2007.10.022.
CHEN S W, ZHU J. Clinical and endoscopic analysis of 1233 colorectal polyps [J]. Clinical Focus, 2007, 22(10): 728-729. DOI: 10.3969/j.issn.1004-583X.2007.10.022.
[15] LAI E J, CALDERWOOD A H, DOROS G , et al. The Boston bowel preparation scale: a valid and reliable instrument for colonoscopy-oriented research [J]. Gastrointest Endosc, 2009, 69(3 Pt 2): 620-625. DOI: 10.1016/j.gie.2008.05.057.
[16] LIEBERMAN D A, REX D K, Winawer S J, et al. Guidelines for colonoscopy surveillance after screening and polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer [J]. Gastroenterology, 2012, 143(3): 844-857. DOI: 10.1053/j.gastro.2012.06.001.
[17] MIN M, DENG P, ZHANG W, et al. Comparison of linked color imaging and white-light colonoscopy for detection of colorectal polyps: a multicenter, randomized, crossover trial [J]. Gastrointest Endosc, 2017, 86(4): 724-730. DOI: 10.1016/j.gie.2017.02.035.

