随机光学重构显微镜在外泌体观察中的应用
马 迪,夏仁品,冯志坚,杨筱燕,付珏兰,马各富昆明医科大学第二附属医院肾脏内科,云南 昆明 650500;昆明医科大学第一附属医院移植科,云南 昆明6500;昆明医科大学第二附属医院石林天奇医院检验科,云南 昆明 650500
外泌体是由大多数有核细胞的多囊泡体与细胞膜融合后释放至细胞外基质中的囊泡,直径约30~150 nm,在电镜下呈球形及杯状形,可在多种体液中检测到外泌体的存在。外泌体携带有多种生物活性物质,目前研究发现外泌体在机体中发挥着重要的生物学作用。几个世纪来,光学显微镜在细胞和分子生物学的研究中发挥了重要,其中也包括外泌体的研究。由于外泌体直径小于150 nm,而传统光学显微镜因光学衍射极限的限制其分辨率为几百纳米,不能对外泌体进行准确定位和成像。随机光学重构显微镜(STORM)突破了光学衍射极限,将高发光强度的经化学荧光标记的样品,利用高强度激光使样品上的荧光基团随机快速转换明暗态,经过基态-激发态-稳暗态-基态的循环后重复记录荧光点,最终经计算后合成高分辨率图,图像分辨率达20~50 nm,随机光学重构显微镜可对细胞培养液中的外泌体进行精确的单分子定位,超高分辨率成像。相较于传统光学显微镜,STORM在对外泌体的追踪和观察拍照中具有更大优势,同时能提供更多未被观测到的外泌体结构和动态变化过程的细节。基于上述优势,有理由相信随机光学重构显微镜及其他超高分辨率成像系统的出现将在外泌体及外泌体参与的生物学过程的研究中发挥重要作用。
1 材料与方法
1.1 实验材料
试剂:胶原酶Ⅰ(Sigma)、RPMI 1640培养液(HyClone)、青链霉素(HyClone)、10%成品去外泌体小牛血清(SBI)、100 μm网筛、PTH检测试剂盒(电化学发光法,罗氏公司)、EXOQUICK-TC外泌体沉淀剂(SBI)、磷钨酸、抗CD63蛋白抗体(SBI)、Alexa Fluor647荧光标记的CD63蛋白羊抗兔抗体、DiD细胞膜荧光染料。设备:ME104型万分之一天平、恒温水浴槽、低速自动平衡离心机、垂直洁净工作台及311型气套式CO2培养箱、0.22 μm一次性滤器、电镜观察用铜网、超高分辨率成像系统:SPiS2.0。
1.2 肾性甲旁亢甲状旁腺组织的细胞原代培养
甲状旁腺组织来源于2016年8月~2017年7月期间于昆明医科大学第二附属医院行手术切除的5例甲状旁腺全切加前臂移植术的肾性甲旁亢患者,5位患者均为尿毒症维持性血液透析患者,平均血液透析年限为6~10年,术前全血段PTH为1500~3000 pg/mL,碱性磷酸酶为150~300 U/L,结合甲状旁腺放射性核素扫描机B超检查确诊为“慢性肾衰竭继发性甲状旁腺功能亢进”。术中冰冻切片提示“甲状旁腺增生及腺瘤”。手术切除后的CKD继发性甲旁亢患者的甲状旁腺组织,取一半组织送冰冻切片病理学检查,剩余的组织立即放入装有PBS缓冲液的15 mL无菌离心管中,30 min内送至细胞培养室。将组织倒入培养皿中去除包膜、结缔组织、脂肪组织、出血、坏死及钙化部分后,再挤压出组织间隙的红细胞,将切除组织剪成1 mm×1 mm×1 mm~2 mm×2 mm×2 mm大的组织块,加入10 mL浓度为0.2%的胶原酶Ⅰ消化液混匀后,吸入50 mL离心管中,于37 ℃水浴槽中消化90~120 min,每隔10 min摇动1次。将消化处理后的细胞悬液离心4 min(2000 r/min,r=16 cm),弃上清,加入PBS20 mL,用吸管反复吹打沉淀,促使细胞进一步分散。将细胞悬液经100 μm网筛过滤后,重复离心3次(2000 r/min,4 min),以去除部分成纤维细胞、脂肪细胞、红细胞等。加入含10%成品去外泌体小牛血清 、青霉素(100 U/mL)及链霉素(100 μg/mL)的RPMI 1640培养液,调整细胞浓度约为5×103/mL。将培养瓶置于37 ℃ CO2培养箱中培养(相对湿度为95%,CO2浓度为5%)。隔日换液,每天在显微镜下观察细胞形态。留取12、24、48、72 h、4 d、5 d的上清。以统一检测PTH水平。
1.3 ExoQuick Precipitation法提取细胞分泌的外泌体
将1.2中留取的原代细胞培养的上清液,以3000 g离心15 min,取上清;将上清过0.22 μm一次性滤器,所得上清液按照试剂说明书,加入沉淀剂(5∶1),混合均匀后4 ℃条件下放置30 min;将孵育好的样品以1500 g离心5 min,弃上清,沉淀以100 μL PBS重悬,分装,于–80 ℃保存。
1.4 电镜下观察外泌体
透射电镜形态观察提取的exosome悬液 20 μL载样于铜网表面,室温静置1 min,用滤纸从侧面小心吸干液体;滴加20 g/L的磷钨酸室温复染5 min,用滤纸从侧面小心吸干复染液; 双蒸馏水洗涤铜网3次,室温晾干,透射电镜观察照相。
1.5 随机光学重构显微镜SPiS2.0系统观察外泌体沉淀,MiJi-imagine软件测量外泌体直径
外泌体沉淀中加入PBS溶液,以1 : 20的比例稀释,稀释后的外泌体悬液100 μL滴加至多聚赖氨酸涂层的盖玻片上。取1 μL一抗(抗CD-63抗体)以1 : 200的比例稀释,将稀释后的抗体100 μL与多聚赖氨酸涂层盖玻片上的外泌体悬液混合,于4 ℃冰箱中孵育过夜。PBS溶液漂洗盖玻片3遍后滴加稀释的Alexa Fluor647荧光标记的CD63蛋白羊抗兔抗体(1 : 1000),室温孵育1.5 h。滴加DiD膜染料至盖玻片上,染色5 min,PBS漂洗盖玻片3遍。封闭盖玻片,加入新制备的成像缓冲液,准备行随机光学重建显微成像。
1.6 统计学方法
采用SPSS19.0统计软件包,基本描述正态分布计量资料采用均数±标准差表示,假设检验采用完全随机设计的方差分析,两两比较采用LSD-t,P<0.05表示差异有统计学意义。
2 结果
2.1 肾性甲旁亢甲状旁腺细胞原代培养
细胞形态特点:甲状旁腺细胞培养初期,细胞表现出明显的聚集性,培养24 h后开始贴壁,4~5 d后生长成单层,细胞外形呈多角形或星形,细胞核为圆形,居中,细胞胞浆内含分泌颗粒(图1)。
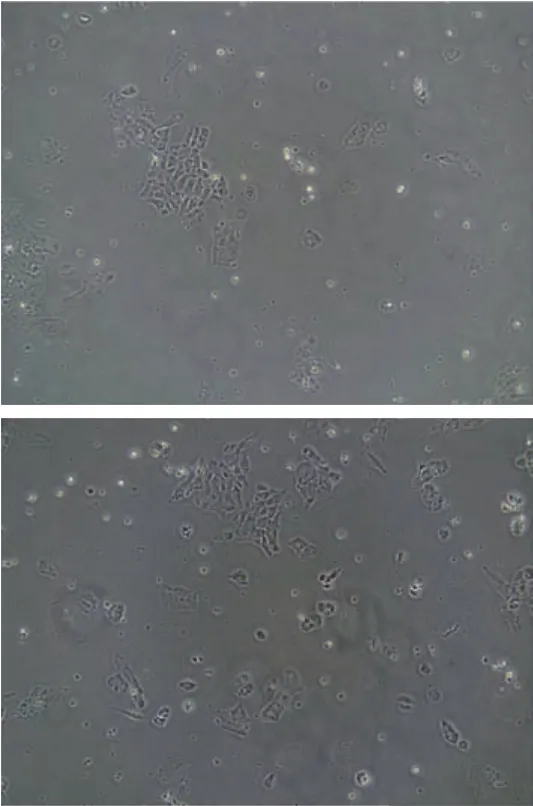
图1 原代培养3 d的甲状旁腺细胞(×200)
2.2 原代培养甲状旁腺细胞iPTH的分泌水平及统计学分析
经完全随机设计的方差分析:不同时间差异有统计学意义(F=23.657,P<0.001),进一步行LSD-t两两比较:12、48、72 h的差异无统计学意义(548.38±91.58 pg/mLvs540.16±55.83 pg/mLvs533.76±70.10 pg/mL,P>0.05),其余时间点间(24、72、96、120、144 h)差异有统计学意义(650.56±72.22 pg/mLvs533.76±70.10 pg/mLvs244.78±35.75 pg/mLvs400.36±53.00 pg/mLvs365.20±49.58 pg/mL),甲状旁腺细胞分泌的甲状旁腺激素水平随时间延长呈下降趋势(图2)。
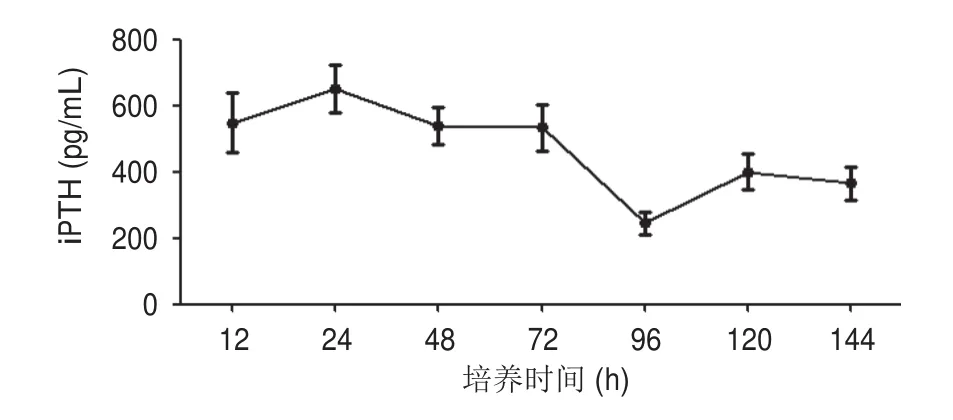
图2 144 h内甲状旁腺细胞iPTH的分泌
2.3 肾性甲旁亢甲状旁腺细胞原代培养上清液中的外泌体
肾性甲旁亢甲状旁腺细胞原代培养上清液中的外泌体电镜图片如图3,随机光学重构显微镜SPiS2.0系统对外泌体沉淀进行观察、拍照, MiJi-imagine软件测量外泌体直径(图4)。
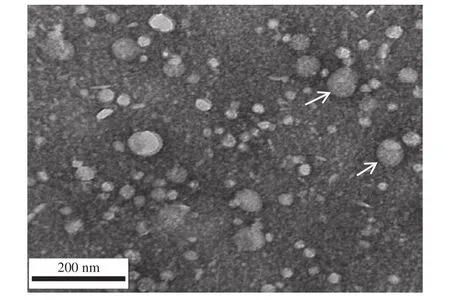
图3 外泌体电子显微镜下的图片
3 讨论
本实验以肾性甲旁亢患者原代培养的甲状旁腺细胞培养上清中分离的外泌体为研究对象,将外泌体膜表面的特异性跨膜蛋白CD63行免疫荧光标记后利用随机光学重构显微技术对外泌体行超高分辨率成像。甲状旁腺细胞的原代培养参考其他学者的实验方法[1]。实验结果表明,消化后的甲状旁腺细胞能立即分泌甲状旁腺素[2],在甲状旁腺细胞原代培养的24 h内,细胞分泌的甲状旁腺素呈上升趋势,24 h后甲状旁腺细胞分泌的甲状旁腺素水平随时间延长呈下降趋势,这与甲状旁腺细胞胞外的钙离子浓度下降及细胞膜表面的钙敏感受体表达下降有关[3]。
甲状旁腺细胞原代培养初期细胞活性良好,实验中收集细胞培养48~72 h的细胞培养上清液利用ExoQuick沉淀法[4],获取外泌体沉淀。
外泌体是有人在研究网织红细胞成熟过程中,意外发现了网织红细胞分泌的囊泡[5],最初认为外泌体是细胞清除“垃圾”的方式。近些年研究发现外泌体在蛋白分泌、细胞间通讯、抗原提呈等生物学过程中发挥了重要作用。外泌体是一种直径约30~150 nm的膜性囊泡,电镜下为球体或杯状体[6],由细胞内多囊泡体与细胞膜融合后,释放到细胞外的囊泡,其分泌主要依赖高尔基体转运的连续或诱导分泌[7],外泌体具有脂质双层膜结构,独特的脂质双层膜结构使外泌体具备了抵御蛋白酶及核糖核酸酶降解的能力[8],外泌体都携带有膜转运融合蛋白(如Annexins和Flotillin)、跨膜蛋白(如CD63、CD81)、热休克蛋白(HSP70、HSP90),此外外泌体内还含有脂类物质,如磷酸甘油、长饱和脂肪酰基链、胆固醇等,某些核酸,如miRNA、非编码RNA及mRNA等[9]。目前研究发现,外泌体可由多种细胞分泌,并可在多种体液中检测到外泌体的,如血液、腹水、尿液、唾液等[10]。据文献报道,外泌体参与了机体内多种生物学过程,如(1)非经典蛋白分泌:经外泌体介导的血管内皮细胞非经典分泌方式释放热休克蛋白70[11];(2)细胞间通讯:外泌体通过表面黏附分子与目的细胞接触后融合,通过释放miRNA、蛋白质等进行信息转运,也可通过细胞外信号转导分子进行信息转运[12];(3)抗原提呈:研究发现树突细胞来源的外泌体可将组织相容性复合体与病原体抗原结合形成的抗原肽复合体,递送至T淋巴细胞,提示外泌体参与了抗原提呈[13];(4)蛋白质及RNA转运:外泌体将携带的多种蛋白、RNA、miRNA等转运至靶细胞,发挥生物学作用[14];(5)免疫应答的调节:人骨髓间充质干细胞所分泌的外泌体可抑制胰腺移植后的免疫反应,改善胰腺功能,提示外泌体对移植后免疫排斥有调控作用[15];(6)外泌体参与肿瘤侵袭、转移、逃避凋亡等其他多种生理学过程[16-18]。
STORM是一种具有超高分辨率的显微系统,其成像理论由庄小威团队研究提出,是一种基于具有光控开关性质的荧光团,行精确定位的高分辨率荧光显微镜技术,观察样本位置能以纳米级精度确定,在每个成像周期中只有部分荧光团被打开,通过将一系列成像周期获得的荧光团位置重建后获得样本图像,其图像分辨率可达20 nm,研究中庄小威团队利用STORM技术对分布于DNA双链上的两个,相距46 nm的具有光控开关性质的荧光团的位置进行精确定位后行超高分辨率成像[19-20]。
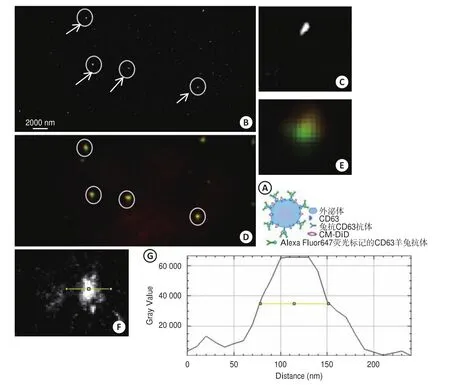
图4 间接荧光标记外泌体跨膜蛋白CD63和CM-DiD对外泌体膜染色的示意图
STORM具有的核心技术为随机和重构[21],将观察样品用发光强度高的荧光染料标记,通过高强度激光激发荧光基团随机快速的进行明暗态转换,在成像中每次至采集部分随机处于“开放状态”的荧光分子而大部分荧光分子则选择性关闭,保证了采集到的荧光光斑的空间距离足够大,这样重复若干次,使样品中每个具有光控开关的荧光团产生的光斑至少被采集到1次,后将单点荧光发射源的点用标准高斯函数拟合,计算得到荧光基团的中心点位置并利用上述荧光光斑的位置信息重新构建出样本结构,因此STORM得到的图像是经数学拟合点构成的拼图[22]。
研究发现随机光学重构显微镜突破了光学衍射极限的限制,较传统宽场显微镜,可获得更高的分辨率,可对外泌体行单分子精确定位、直径测量、超高分辨率成像[23]。基于STROM的成像技术优势,相信STROM及其他超高分辨率成像技术将在外泌体及外泌体参与的生物学过程的研究中发挥重要作用。感谢香港纳观生物有限公司提供的设备、技术支持。
参考文献:
[1]Liu W,Ridefelt P,Akerström G,et al.Differentiation of human parathyroid cells in culture[J].J Endocrinol,2001,168(3): 417-25.
[2]王宁宁,王笑云,陆福明,等.肾性甲旁亢患者原代培养的甲状旁腺细胞PTH分泌的变化[J].肾脏病与透析肾移植杂志,2000,9(02): 193-5.
[3]Goodman WG, Quarles LD. Development and progression of secondary hyperparathyroidism in chronic kidney disease: lessons from molecular genetics[J].Kidney Int,2008,74(3): 276-88.
[4]Zlotogorski-Hurvitz A,Dayan D,Chaushu G,et al.Human salivaderived exosomes: comparing methods of isolation[J]. J Histochem Cytochem,2015,63(3): 181-9.
[5]Pan BT,Johnstone RM.Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor[J].Cell,1983,33(3): 967-78.
[6]Gholizadeh S,Shehata Draz M,Zarghooni M,et al.Microfluidic approaches for isolation, detection, and characterization of extracellular vesicles: Current status and future directions[J].Biosens Bioelectron,2017,91(2): 588-605.
[7]Théry C,Ostrowski M,Segura E.Membrane vesicles as conveyors of immune responses[J].Nat Rev Immunol,2009,9(8): 581-93.
[8]Akers JC,Gonda D,Kim R,et al.Biogenesis of extracellular vesicles (EV): exosomes,microvesicles,retrovirus-like vesicles,and apoptotic bodies[J].J Neurooncol,2013,113(1): 1-11.
[9]Vlassov AV,Magdaleno S,Setterquist R,et al.Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J].Biochim Biophys Acta,2012,1820(7): 940-8.
[10]Pant S,Hilton H,Burczynski ME.The multifaceted exosome:biogenesis, role in normal and aberrant cellular function, and frontiers for pharmacological and biomarker opportunities[J].Biochem Pharmacol,2012,83(11): 1484-94.
[11]Zhan R,Leng X,Liu X,et al.Heat shock protein 70 is secreted from endothelial cells by a non-classical pathway involving exosomes[J].Biochem Biophys Res Commun,2009,387(2): 229-33.
[12]Coppieters K,Barral AM,Juedes A,et al.No significant CTL cross-priming by dendritic cell-derived exosomes during murine lymphocytic choriomeningitis virus infection[J].J Immunol,2009,182(4): 2213-20.
[13]Théry C,Duban L,Segura E,et al.Indirect activation of naïve CD4+ T cells by dendritic cell-derived exosomes[J].Nat Immunol,2002,3(12): 1156-62.
[14]Villarroya-Beltri C,Gutiérrez-Vázquez C,Sánchez-Madrid F,et al.Analysis of microRNA and protein transfer by exosomes during an immune synapse[J].Methods Mol Biol,2013,1024(1024): 41-51.
[15]Wen D,Peng Y,Liu D,et al.Mesenchymal stem cell and derived exosome as small RNA carrier and Immunomodulator to improve islet transplantation[J].J Control Release,2016,238(10): 166-75.
[16]Ostenfeld MS,Jeppesen DK,Laurberg JR,et al.Cellular disposal of miR23b by RAB27-dependent exosome release is linked to acquisition of metastatic properties[J].Cancer Res,2014,74(20):5758-71.
[17]Franzen CA,Blackwell RH,Todorovic V,et al.Urothelial cells undergo epithelial-to-mesenchymal transition after exposure to muscle invasive bladder cancer exosomes[J].Oncogenesis,2015,4(11): e163-8.
[18]Jeppesen DK, Nawrocki A, Jensen SG, et al. Quantitative proteomics of fractionated membrane and lumen exosome proteins from isogenic metastatic and nonmetastatic bladder Cancer cells reveal differential expression of EMT factors[J].Proteomics,2014,14(6): 699-712.
[19]Bates M,Jones SA,Zhuang X.Stochastic optical Reconstruction microscopy (STORM): a method for superresolution fluorescence imaging[J].Cold Spring Harb Protoc,2013,13(6): 498-520.
[20]Rust MJ,Bates M,Zhuang X.Sub-diffraction-limit imaging by stochastic optical Reconstruction microscopy (STORM)[J].Nat Methods,2006,3(10): 793-5.
[21]杨 洁,田翠萍,钟桂生.随机光学重构显微成像技术及其应用[J].光学学报,2017,16(03): 51-63.
[22]Endesfelder U, Heilemann M. Direct stochastic optical Reconstruction microscopy (dSTORM)[J]. Methods Mol Biol,2015,1251(1): 263-76.
[23]Chen C,Zong S,Wang Z,et al.Imaging and intracellular tracking of cancer-derived exosomes using Single-Molecule Localization-Based Super-Resolution microscope[J]. Acs Appl Mater Interfaces,2016,8(39): 25825-33.